轉錄組學在茶樹研究中的應用進展
江新鳳 劉本英 李友勇 李洪波
(1.江西省蠶桑茶葉研究所 330202;2.云南省茶學重點實驗室 666201)
中國是茶的故鄉,茶產業的發展源遠流長,茶樹種質資源豐富,截至2017年,通過國家級審(認、鑒)定的茶樹品種有134個,數量位于世界前列[1~3]。長期以來,對于茶樹種質資源以及品種特性研究均通過形態學特征和農藝特征觀察來實現,但由于茶樹是一種長期異化授粉、自交不親和性的作物,表現為高度雜合的生殖特點,加上品種選育均采用傳統的系統和雜交選育,且父母本親緣關系較近,其后代發生的遺傳變異小,故通過表型來進行品種鑒定存在一定的難度和不確定性。
轉錄組學為茶樹基因研究開辟了新途徑,對茶樹的進化、基因突變以及翻譯調控等多種生物學過程提供有效工具,也可作為標記進行輔助育種,降低標記選擇成本,縮短了育種進程[4~6]。本文對近年來茶樹轉錄組學研究進展進行總結,為轉錄組測序技術在茶樹上的進一步應用提供參考。
1 轉錄組學概況
轉錄組學(Transcriptomics)是研究細胞在某一功能狀態下所含mRNA的類型與拷貝數;比較不同功能狀態下mRNA表達的變化,搜尋與功能狀態變化緊密相關的重要基因群,對每種轉錄本在發育過程中和不同條件下表達水平的變化進行量化[7~8]。轉錄組的概念是由Velculescu等人[9~10]于1997年最早提出的,20 世紀90 年代中期,轉錄組學開始在生物學領域作為一門新技術,成為研究熱點并且得到廣泛的應用[11~12],比如EST(Expressed Sequence tags,表達序列標簽 )是從已建好的cDNA庫中隨機抽取克隆,從5’末端或3’末端對插入的cDNA片段進行一輪單向自動測序,所獲得的約60~500bp的一段cDNA序列。20世紀90年代初Craig Venter提出了EST的概念,并測定了609條人腦組織的EST,宣布了cDNA大規模測序時代的開始[13]。1993年前EST數據收錄于GenBank、EBI和DDBJ。同年NCBI(National Center of Biotechnology Information)建立了一個專門的EST數據庫dbEST來保存和收集所有的EST數據。1995年中期GenBank中EST的數目超過了非EST的數目。現在GenBank中EST的數目已經超過了三千五百萬,約占GenBank中序列數的60%。轉錄組學方法尤其是cDNA微陣列的應用促進基因表達數據爆炸性增長,但如何對這些數據進行分析,從中提取有意義的生物學信息,是未來一段時間轉錄組學的研究熱點和需要攻克的技術瓶頸。
2 轉錄組學的研究方法
隨著科學研究的不斷深入,雜交技術、PCR 技術、標簽序列分析等新方法、新技術已成功地應用于轉錄組學研究。轉錄組學研究方法到目前為止,經歷三代發展。早期,由于測序價格昂貴、基因序列數目有限,轉錄組學研究者只能進行極少數特定基因的結構功能分析和表達研究。最早廣泛應用測序技術為70年代的 Sanger 法,這也是完成人類基因組計劃的基礎。最近十幾年, 分子生物學技術的快速發展使高通量分析成為可能,高通量研究方法主要可以分為兩類:一類是基于雜交的方法,主要是指微陣列技術(Microarray);一類是基于測序的方法,這類方法包括表達序列標簽技術(Expression Sequence Tags Technology,EST)、基因表達系列分析技術(Serial analysis of gene expression,SAGE)、大規模平行測序技術(Massively parallel signature sequencing,MPSS)、RNA 測序技術(RNA sequencing,RNA-seq)。自2005年以來,以Roche 公司的454技術、Illumina 公司的 Solexa 技術以及 ABI 公司的 Solid 技術為標志的高通量測序技術相繼誕生[14~15]。不同轉錄組研究方法比較見表1[16~17]。轉錄組學研究有助于了解特定生命過程中相關基因的整體表達情況,進而從轉錄水平初步揭示該生命過程的代謝網絡及其調控機理。隨著后基因組時代的到來,轉錄組測序成為率先發展且應用相對廣泛的技術 。
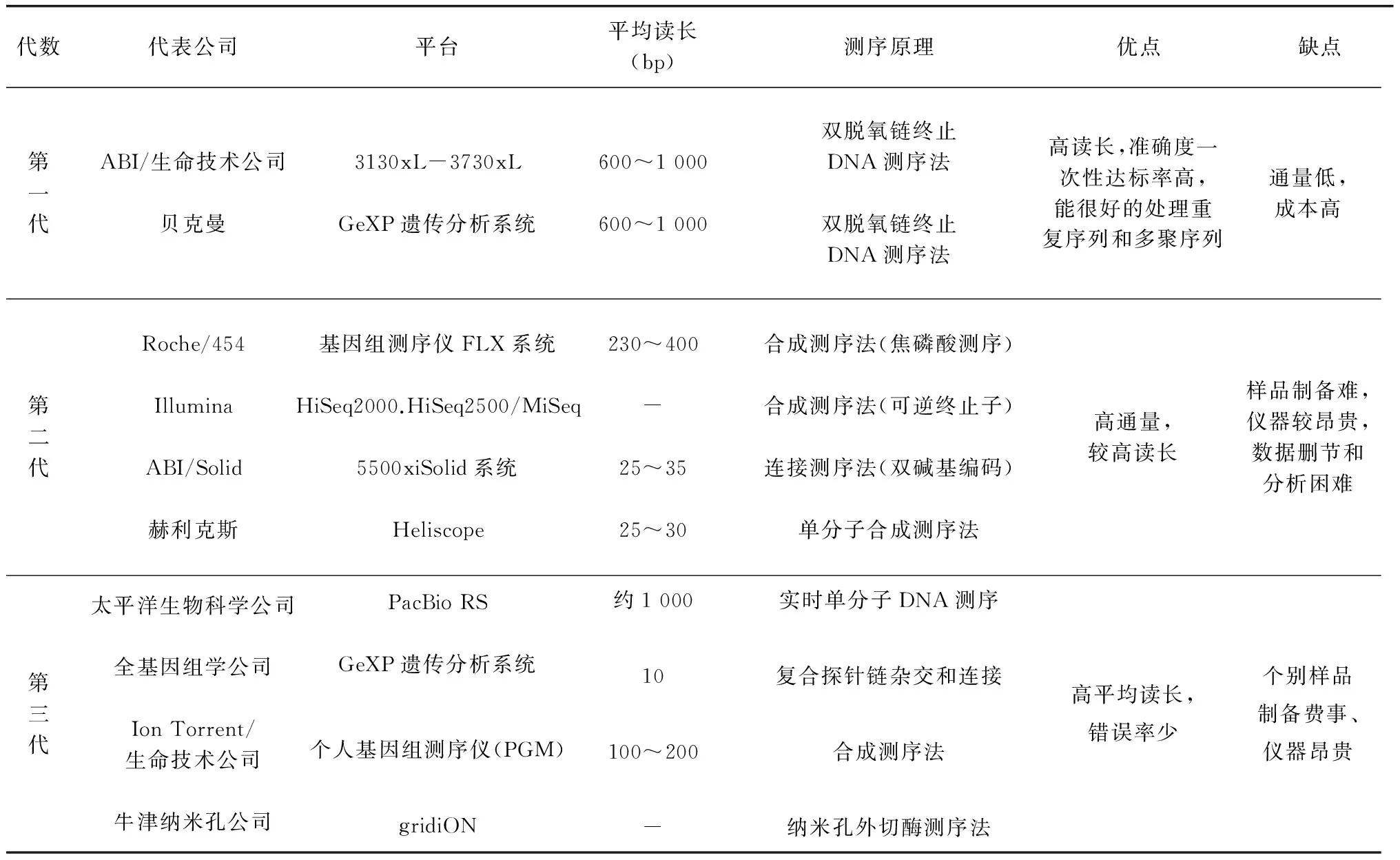
表1 各種轉錄組(測序技術)研究方法比較
3 轉錄組學在茶樹研究中的應用
高通量測序技術的發展極大推動了轉錄組學的研究,使研究者能發現更多新轉錄本,挖掘更多分子標記,更清晰地繪制轉錄圖譜以及更準確地確定代謝途徑通路[6]。轉錄組技術在茶樹中的應用較玉米、大豆、水稻等大田作物較少[18]。但是隨著第三代測序技術的不斷完善和發展,將來測序成本會大大降低,測序的通量和準確性也會不斷提高,其在茶樹的功能基因挖掘、次生代謝調控、抗性及茶樹遺傳育種和進化分析等研究中將進一步拓展。
3.1 功能基因挖掘
目前,由于基因組測序的功能注釋還不夠完備,因此基因優化可以通過轉錄組測序技術進行,通過深入比較分析已知基因組注釋模型與轉錄組測序結果,從而挖掘該物種的新基因及完善其基因組的注釋[19]。張成才[20]以中茶108和福鼎大白茶為材料,進行了自交(SP)和雜交授粉(CP),選取了自交和雜交授粉后24h、48h和72h的花柱,進行轉錄組學分析,結果發現,自交和雜交授粉花柱在基因表達模式上有顯著差異,篩選到了大量可能與茶樹育性相關的重要基因;韋康[21~22]使用Illumina測序法對茶樹扦插枝條使用吲哚丁酸(IBA)進行轉錄組分析,發現許多基因參與了植物激素信號轉導、次生代謝、細胞壁組織和谷胱甘肽代謝;譚立強[23]利用Illumina測序平臺進行高通量測序,分析了茶樹的轉錄組,構建SSR覆蓋1 156.9cm的237個SSR標記分布的15個連鎖群遺傳連鎖圖譜;馬春雷[24]利用第一代cDNA微陣列方法對“安吉白茶”泛白不同階段基因表達進行了分析,篩選部分茶樹功能基因;韋朝領[25]發現了茶樹特有化合物主要代謝途徑的大量候選基因。
3.2 次生代謝調控
近年,轉錄組技術在次生代謝調控方面運用頗多,對茶樹特征性次生代謝相關基因進行挖掘,以及對基因的結構、功能、表達及調控方面研究也有相關報道[26]。李春芳[27]通過對茶樹的13個不同組織部位進行轉錄組測序,得到了34.7萬條特異的茶樹基因序列,找到了1 719個基因參與次生代謝產物的合成,其中206個基因參與類黃酮、咖啡因和茶氨酸的合成,找到了339個可能調控類黃酮、咖啡因和茶氨酸合成途徑基因的轉錄因子。邰玉玲[28]對茶樹和油茶轉錄組數據進行比較分析,研究了茶樹特征性代謝成分形成的分子機制,結果表明,在茶樹特征性成分積累的過程中,與兒茶素、茶氨酸和咖啡堿相關的代謝途徑的基因表達量茶樹比油茶高;王璐[29]通過比較龍井43和中黃2號,分析了兩品種的生化成分、葉綠體結構、基因表達與代謝途徑,發現中黃2號與龍井43中存在4 902個差異基因,其中259個與氨基酸代謝、光合作用和色素代謝有關;吳華玲[30]用20個特色茶樹品系的嫩梢、幼葉、成熟葉為材料,構建cDNA文庫并利用Roche/454轉錄組測序,共讀取437 908個基因序列,通過重組裝得到25 637條,并用這些序列與公眾數據庫進行比對。結果發現這些基因的大多數映射到碳水化合物代謝、能量代謝和次生代謝產物生物合成途徑。
3.3 抗性研究
劉聲傳[31]以“寧州2 號”為RNA-Seq材料進行了轉錄組測序,揭示了干旱脅迫與復水下茶樹激素代謝和信號轉導以及可溶性糖和脯氨酸代謝的機理;王璐[32]、王新超[33]、張悅[34]使用Illumina及RNA-Seq技術對茶樹冷脅迫下進行全轉錄組測序,通過比較轉錄組或基因表達譜的研究以揭示生物學現象或疾病發生的分子機制。王丹[35~36]比較不同茶樹品種轉錄組差異,借助生物信息學方法分析海量數據后,對茶樹抵御茶尺蠖抗性相關基因進行了功能注釋、代謝通路分析,同時關鍵基因進行了篩選。
4 展望
目前,轉錄組測序技術已在醫學和農學等基礎以及應用基礎研究中廣泛應用。由于測序技術和生物信息學的不斷發展,分析其測序結果會越來越真實可靠,基于轉錄組數據的分析研究,將有助于得到新的功能基因和代謝通路,為茶樹種質資源鑒定、保存與優良種質選育提供分子基礎;通過對次生代謝途徑關鍵酶基因的研究,為茶樹活性成分的生物合成與調控提供新的思路和方法,或通過基因轉錄水平的調節,提高茶樹功能成分的產量與活性,為茶樹的良種選育、規范化種植和質量控制提供技術支撐。當然,作為一種快速、高通量、全面解讀茶樹基因組信息的全新技術手段,茶樹轉錄組研究在基礎理論和生產實踐中均具有重要的意義的同時也存在一些弊端,如樣本需求量大、容易受環境因素的影響,因此轉錄組學的應用結合眾多新興組學,例如蛋白質組學和代謝組學的研究,實現高通量與高效率的結合,揭示傳統茶樹生物學內涵,為茶產業的發展提供助力。
[1]江新鳳,李文金,楊普香.江西省茶樹種質資源研究進展[J].蠶桑茶葉通訊,2016(5):29~31.
[2]Kamunya S M, Wachira F N, Pathak R S, et al. Genomic mapping and testing for quantitative trait loci in tea (Camelliasinensis(L.) O. Kuntze) [J]. Tree Genetics & Genomes, 2010, 6(6): 915~929.
[3]Zhao L P, Liu Z, Chen L, et al. Generation and characterization of 24 novel EST derived microsatellites from tea plant (Camelliasinensis) and cross-species amplification in its closely related species and varieties [J]. Conservation Genetics, 2008, 9(5):1327~1331.
[4]Chen L, Zhou Z X, Yang Y J, et al. Genetic improvement and breeding of tea plant (Camelliasinensis) in China: from individual selection to hybridization and molecular breeding [J]. Euphytica, 2007, 154:239~248.
[5]史碩博,陳濤,趙學明.轉錄組平臺技術及其在代謝工程中的應用[J].生物工程學報,2010,26(9):1 187~1 198.
[6]王繼玥,余庭躍,張彩波.玉米轉錄組學研究進展[J].華北農學報,2014,29(增刊):10~15.
[7] Wang Z, Gerstein M, Snyder M, et al. RNA-Seq: a revolutionary tool for transcriptomics[J]. Nat Rev Genet, 2009,10(1):57~63.
[8] Costa V, Angelini C, De F I, et al. Uncovering the complexity of transcriptomes with RNA-Seq [J]. Journal of Biomedicine & Biotechnology, 2010, 5 757 (2 010):e853916.
[9] Velculescu V E, Zhang L, Zhou W, et al. Characterization of the yeast transcriptome[J]. Cell, 1997, 88(2):243~251.
[10] 徐云碧.分子植物育種[M].北京:科學出版社,2014:79~80.
[11] Lockhart D J,Winzeler E A. Genomics,gene expression and DNA arrays[J].Nature,2000, 6 788 (405): 827~836.
[12] Birzele F,Schaub J,Rust W,et al.Into the unknown: expression profiling without genome sequence information in CHO by next generation sequencing[J].Nucleic Acids Research,2010,38 ( 12 ) :3 999~4 010.
[13] Adams M D, Kerlavage A R, Fleischmann R D, et al. Initial assessment of human gene diversity and expression patterns based upon 83 million nucleotides of cDNA sequence[J]. Nature, 1995, 6 547 (377,Suppl):3.
[14] Maher C A, Kumarsinha C, Cao X, et al. Transcriptome sequencing to detect gene fusions in cancer[J]. Nature, 2009, 7 234 ( 458):97~101.
[15] Zhou X, Ren L, Li Y, et al. The next-generation sequencing technology: a technology review and future perspective.[J]. Science China Life Sciences, 2010, 53(1):44.
[16]楊曉玲,施蘇華,唐恬.新一代測序技術的發展及應用前景[J].生物技術通報,2010(10):76~82.
[17]田李,張穎,趙云峰.新一代測序技術的發展和應用[J]. 生物技術通報,2015,31(11):1~8.
[18]劉冠,趙婷婷,楊歡歡,等.番茄轉錄組學研究進展[J].基因組學與應用生物學,2016,35(10):2 802~2 807.
[19] 竇孝銳.馬鈴薯轉錄組測序研究進展[J].現代農業科技,2015(13):81~83.
[20] Zhang C C, Wei K,Ni D J, et al. Transcriptome analysis reveals self-incompatibility in the tea plant (Camelliasinensis) might be under gametophytic control [J]. BMC Genomics,2016,17(1):359.
[21] Wei K, Wang L Y, Wu L Y, et al. Transcriptome analysis of indole-3-butyric acid-induced adventitious root formation in nodal cuttings ofCamelliasinensis(L.)[J]. Plos One, 2014, 9(9):e107201.
[22] Wei K, Wang L, Zhang C, et al. Transcriptome analysis eveals key flavonoid 30-hydroxylase and lavonoid 30,50-hydroxylase genes in affecting the ratio of dihydroxylated to trihydroxylated catechins inCamelliasinensis. [J].Plos One 2015,10(9): e0137925.
[23]Tan L Q, Wang L Y, Wei K, et al. Floral transcriptome sequencing for SSR marker development and linkage map construction in the tea plant (Camelliasinensis)[J]. Plos One, 2013, 8(11):e81611.
[24]Ma C L, Chen L, Wang X C,et al. Differential expression analysis of different albescent stages of Anji Baicha (Camelliasinensis(L.) O. Kuntze) using cDNA microarray[J]. Scientia Horticulturae ,2012,148:246~254.
[25] Shi C Y, Yang H, Wei C L, et al. Deep sequencing of theCamelliasinensistranscriptome revealed candidate genes for major metabolic pathways of tea-specific compounds[J]. BMC Genomics, 2011, 12(1):131.
[26]宛曉春,夏濤.茶樹次生代謝[M].北京:科技出版社,2015:180.
[27] Li C F, Zhu Y, Yu Y, et al. Global transcriptome and gene regulation network for secondary metabolite biosynthesis of tea plant (Camelliasinensis)[J]. BMC Genomics, 2015, 16(1):560.
[28] Tai Y L,wei C L,Wan X C,et al.Transcriptomic and phytochemical analysis of the biosynthesis of characteristic constituents in tea (Camelliasinensis) compared with oil tea (Camelliaoleifera)[J]. BMC Plant Biology,2015, 15(1): 190.
[29] Wang L, Yue C, Cao H, et al. Biochemical and transcriptome analyses of a novel chlorophyll-deficient chlorina teaplantcultivar[J]. BMC Plant Biology, 2014, 14(1):352.
[30] Wu H L, Chen D, Li J, et al. De Novo characterization of leaf transcriptome using 454 sequencing and development of EST-SSR markers in tea (Camelliasinensis)[J]. Plant Molecular Biology Reporter, 2013, 31(3):524~538.
[31] Liu S C, Jin J Q, Ma J Q, et al. Transcriptomic analysis of tea plant responding to drought stress and recovery[J]. Plos One, 2016, 11(1):e0147306.
[32] Wang L, Wang X, Yue C, et al. Development of a 44 K custom oligo microarray using 454 pyrosequencing data for large-scale gene expression analysis ofCamelliasinensis[J]. Scientia Horticulturae, 2014, 174(1):133~141.
[33] Wang X C, Zhao Q Y, Ma C L, et al. Global transcriptome profiles ofCamelliasinensis, during cold acclimation[J]. BMC Genomics, 2013, 14(1):415.
[34] Zhang Y, Zhu X, Chen X, et al. Identification and characterization of cold-responsive microRNAs in tea plant (Camelliasinensis) and their targets using high-throughput sequencing and degradome analysis[J]. BMC Plant Biology, 2014, 14(1):271.
[35] Wang D, Li C F, Ma C L, et al. Novel insights into the molecular mechanisms underlying the resistance ofCamelliasinensisto Ectropis oblique, provided by strategic transcriptomic comparisons[J]. Scientia Horticulturae, 2015, 192(2):429~440.
[36]王丹,陳亮.茶樹對茶尺蠖抗性機制研究[J].茶葉科學,2014,34(6):541~547.

