基于化學核心素養發展的教學設計
——以《鹽類水解》第一課時為例
劉 偉
(深圳市華僑城中學 深圳 518053)
一、教材分析
本課程為高中化學選修新課程4第三章第三節《鹽類的水解》(第一課時)。鹽的水解是基于化學平衡的原理,學生已經學會討論電解質在水溶液中的電離行為,進而探討水溶液中酸堿度的規律,有助于促進學生的認知發展。同時,鹽類水解是后續電化學學習的必要基礎。從知識結構來看,鹽水解平衡是繼弱酸、弱堿和水的電離平衡系統之后,電解質溶液的另一種平衡系統,它便于學生形成完整的電解質溶液平衡系統。因此,這一節的內容在過去和未來的教學中起著一定的作用,它是理論教學的重點和難點。[1]
二、學生分析
在研究本節內容之前,學生有一定的離子反應、強弱電解質電離、建立化學平衡、水電離、溶液酸堿度等基礎,并具有分析溶液中離子水解平衡的能力。[2]
三、教學目標
1.知識與技能
⑴能夠知道哪些鹽在溶液中發生水解,知道鹽類水解的本質;
⑵能夠判斷鹽溶液的酸堿性;
⑶能夠書寫簡單的鹽類水解的離子方程式。
2.過程與方法
通過鹽類水解規律的學習幫助學生構建電解質溶液的平衡體系,培養學生提出問題、分析問題和解決問題的科學探究能力;
3.情感態度價值觀、
學會依據本質推現象,透過現象看本質,感受化學世界的奇妙與和諧,培養學生科學探究精神,在學習中感受合作學習的樂趣。
四、教學重、難點
教學重點:鹽類的水解的實質和規律
教學難點:鹽類的水解的實質
五、教學策略
問題導學,實驗探究
六、教學流程
[新課引入]
1.新聞鏈接:被蜜蜂蟄了下,差點要了命!設問:當蜜蜂叮咬后應如何利用家庭常用物質加以處理?
2.工業上焊接金屬為何用硫酸銨溶液清洗金屬表面?
[點評]以生活、生產實例設疑,激發學生興趣。
[活動與探究1]鹽溶液的酸堿性
測定食鹽(NaCl)、純堿(Na2CO3)、除銹劑(NH4Cl)、小蘇打(NaHCO3)、硫酸銨、醋酸鈉(NaAC)溶液的pH,并將實驗結果填入下表
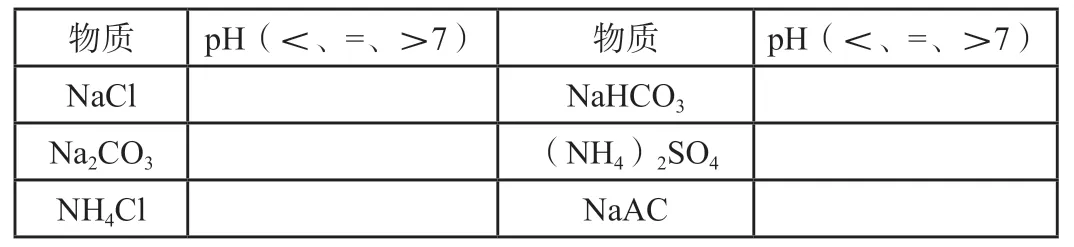
物質pH(<、=、>7)物質pH(<、=、>7)NaCl NaHCO3 Na2CO3(NH4)2SO4 NH4Cl NaAC
[點評]小組探究實驗,用pH試紙測定不同鹽溶液的酸堿性,并派代表對實驗結果進行匯報。通過讓學生親自動手測定不同鹽溶液的酸堿性,為尋找鹽類的水解的規律、探尋鹽類的水解的本質設懸念。通過自主、合作、探究學習,進一步培養學生實驗探究與創新意識的核心素養。
[活動與探究2]鹽溶液呈現不同酸堿性的原因
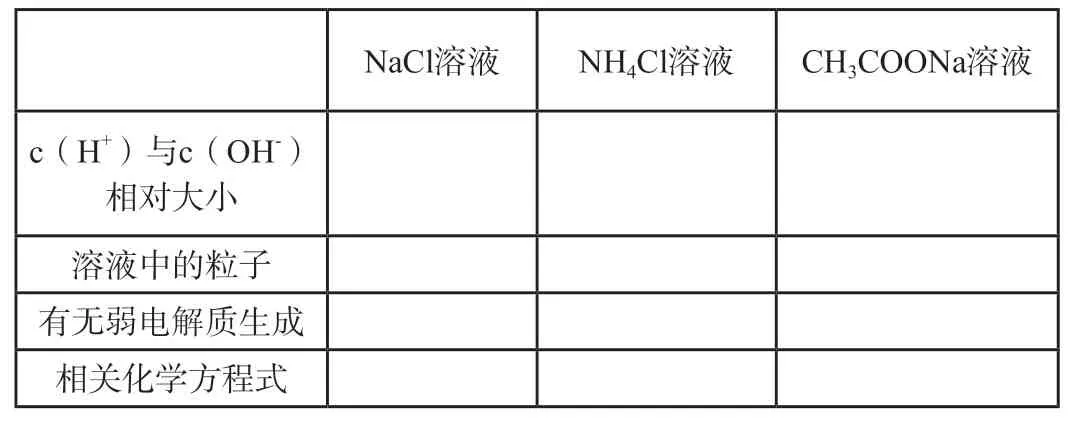
NaCl溶液NH4Cl溶液CH3COONa溶液c(H+)與c(OH-)相對大小溶液中的粒子有無弱電解質生成相關化學方程式
[點評]從微觀角度對鹽溶液呈現不同酸堿性進行分析以期得出原因,鍛煉學生的歸納思維,歸納總結出鹽類水解的本質,進一步培養學生宏觀辨識與微觀探析、變化觀念與平衡思想的核心素養。
[活動與探究3]鹽的類別與鹽溶液酸堿性
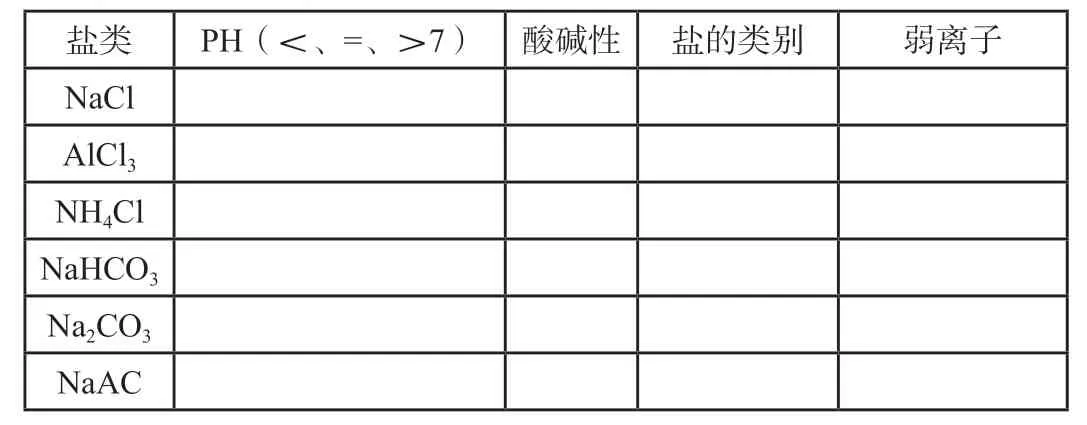
鹽類PH(<、=、>7)酸堿性鹽的類別弱離子NaCl AlCl3 NH4Cl NaHCO3 Na2CO3 NaAC
[點評]從鹽的類別與鹽溶液酸堿性的關系總結鹽類水解的基本規律:有弱才水解,誰弱誰水解;誰強顯誰性,同強顯中性。同時規范水解方程式和離子方程式的書寫。一方面激發學生興趣從鹽類別去認識和掌握鹽類水解規律,培養學生邏輯思維能力,另一方面通過鹽類水解方程式和離子方程式書寫,學生進一步體會鹽類水解的本質,學會鹽類水解的表達方式,培養學生規范應用化學用語的能力,從而進一步培養學生證據推理與模型認知的核心素養。
[知識應用]
1.請設計一個合理而比較容易進行的方案證明某酸HA是弱電解質(應用水解原理,做簡明扼要表述)
2.Na2CO3、NaHCO3和肥皂水溶液能減輕蜜蜂蟄后帶來的痛楚說明了什么?
3.食用純堿大量用于面條、面包等食品加工中,主要成分Na2CO3,它明明是鹽為何要稱為“堿”?
4.工業上焊接金屬為何用硫酸銨或氯化銨溶液溶液清洗金屬表面?
5.為何草木灰(K2CO3)和銨態氮肥(NH4NO3)不能混用?
6.家庭小實驗:用pH試紙測試家中食鹽、味精、蘇打、小蘇打溶液的酸堿性
[點評]鞏固本節所學內容,強調鹽類水解在日常生活、實驗室和工農業生產中實際應用;培養學生學以致用的意識,感受所學內容的價值;從而進一步培養學生科學精神與社會責任的核心素養。
七、板書設計(略)
八、教學反思
通過本節課學習,激發了學生的學習興趣,達到了師生間的雙向活動,學生取得了較好的學習效果;此外,“活動探究”、“交流研討”的設置,能更好地調動學生的學習主動性,更有利于實現“過程與方法”的三維目標,能幫助學生掌握解決問題的方案,達到遷移和應用的目的。實驗的設置可以使抽象問題具體化,有利于“情感態度與價值觀”目標的實現。本節課基本上能從五個方面(宏觀辨識與微觀探析、變化觀念與平衡思想、證據推理與模型認知、實驗探究與創新意識、科學精神與社會責任)培養學生化學核心素養。

