miR-25在乳腺癌組織、細胞的表達及對細胞增殖的影響
董超,黃遠麗,徐正豐
(華中科技大學同濟醫學院附屬荊州醫院,湖北荊州434020)
乳腺癌近年來發病率逐年上升,且呈年輕化趨勢[1]。研究顯示,微小RNA(miRNA)廣泛參與細胞的各種生理病理過程,與腫瘤的發生發展關系密切[2,3]。miRNA在乳腺癌發生發展中起重要作用[4~6]。miR-25是近年來發現的腫瘤相關miRNA
分子之一,位于人第7號染色體長臂(7q22.1)上的MCM7基因內含子上,在多種腫瘤中表達上調,在腫瘤發生過程中起重要調控作用[7]。但目前有關miR-25在乳腺癌中的表達及作用機制尚不完全清楚。2017年3~4月,我們采用qRT-PCR法檢測乳腺癌組織和細胞系中miR-25表達,并探討miR-25對乳腺癌細胞增殖的影響。
1 材料與方法
1.1材料收集2014年1月~2015年1月本院手術切除的乳腺癌組織89例及相應距腫瘤邊緣5 cm以上的癌旁組織,組織離體30 min內液氮速凍,-80 ℃保存。患者術前均未接受放化療、免疫治療等抗腫瘤治療,均為女性,年齡28~75歲,平均46.9歲,均經術后病理檢查確診。組織學分級:Ⅰ級15例、Ⅱ+Ⅲ級74例;TNM分期:Ⅰ+Ⅱ期61例、Ⅲ+Ⅳ期28例;淋巴結轉移52例。本實驗經醫院倫理委員會批準,患者均知情同意并簽署知情同意書。RMPI1640培養基購自美國Corning公司,TRIzol試劑購自北京達科為生物技術公司,miR-25及內參U6引物由廣州銳博生物公司構建和提供,RNA逆轉錄試劑盒、qRT-PCR試劑盒購自美國Bio-Rad公司,LipofectamineTM2000購自美國Invitrogen公司,miR-25inhibitor及陰性對照inhibitor-NC購自上海吉瑪制藥技術有限公司,CCK-8試劑盒購自上海碧云天生物公司。人乳腺癌細胞系SK-BR-3、MCF-7、MDA-MB-231和人乳腺上皮細胞系HBL-100均購自美國典藏細胞庫(ATCC),培養于含10%胎牛血清的RMPI1640培養基中,置入37 ℃、5% CO2的培養箱中。
1.2乳腺癌組織和細胞中miR-25表達檢測按照TRIzol試劑盒說明書提取組織或細胞總RNA,核酸蛋白測定儀檢測OD260nm/OD280nm在1.7~2.0,符合實驗要求,按逆轉錄試劑盒說明書操作逆轉錄得到cDNA。miR-25引物序列:正向引物:5′-ATCCAGTGCGTGTCGTG-3′,反向引物:5′-TGCTCATTGCACTTGTCTC-3′。以cDNA為模板,配置qRT-PCR反應體系,反應條件:94 ℃ 2 min,94 ℃ 20 s,60 ℃ 30 s,共40個循環。以U6作為內參基因,miR-25表達量數值采用2-ΔΔCt法計算。收集乳腺癌患者的臨床病理特征,包括年齡、TNM分期、腫瘤最大直徑、組織學分級、ER狀態、PR狀態、C-erbB-2狀態及淋巴結轉移等。每項臨床病理特征分為兩個亞組,比較兩個亞組患者乳腺癌組織中miR-25的相對表達情況。
1.3miR-25 inhibitor轉染乳腺癌細胞將對數生長期的乳腺癌細胞系SK-BR-3接種于細胞培養板中,嚴格按照LipofectamineTM2000說明書操作,分別將miR-25 inhibitor和inhibitor-NC轉染至SK-BR-3細胞,轉染后的SK-BR-3細胞分別為miR-25 inhibitor組和inhibitor-NC組,轉染后48 h收集細胞進行后續實驗。
1.4乳腺癌細胞增殖能力檢測采用CCK-8法。將轉染48 h后的各組細胞按3 000/孔的密度分別種于96孔板上,每孔設3個復孔,每24 h加入CCK-8反應液孵育30 min,后在490 nm處測定各孔的光密度(OD),連續測定3 d,繪制細胞增殖曲線。
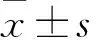
2 結果
2.1miR-25在乳腺癌組織和細胞系中的表達比較miR-25在乳腺癌組織和癌旁組織中的表達分別為5.47±0.54、1.03±0.05,miR-25在乳腺癌組織中的表達高于癌旁組織(P<0.01);miR-25在乳腺癌細胞系SK-BR-3、MCF-7、MDA-MB-231和人乳腺上皮細胞系HBL-100中的表達分別為7.48±0.81、4.47±0.48、4.99±0.51、1.02±0.04,miR-25在各乳腺癌細胞系中的表達高于正常乳腺上皮細胞系(P均<0.01)。其中miR-25在SK-BR-3中表達水平最高,因此選擇SK-BR-3作為后續細胞學實驗的研究對象。
2.2miR-25表達與乳腺癌患者臨床病理特征的關系miR-25表達與乳腺癌患者TNM分期、淋巴結轉移有關﹙P均<0.01﹚,而與年齡、腫瘤最大直徑、ER、PR、C-erbB-2及組織學分級等無關(P均>0.05)。見表1。
2.3miR-25 inhibitor組和inhibitor-NC組細胞中miR-25表達比較miR-25 inhibitor組和inhibitor-NC組細胞中miR-25的相對表達量分別為0.38±0.11、1.01±0.03,兩組比較,P<0.01。

表1 miR-25表達與患者臨床病理特征的關系
2.4miR-25 inhibitor組與inhibitor-NC組乳腺癌細胞增殖能力比較CCK-8實驗結果顯示,miR-25 inhibitor組SK-BR-3細胞的增殖速度較inhibitor-NC組細胞下調(P<0.05)。miR-25 inhibitor組24、48、72、96 h時OD值分別為0.46±0.03、0.56±0.12、1.10±0.10、1.72±0.16;inhibitor-NC組24、48、72、96 h時OD值分別為0.45±0.04、0.95±0.13、1.81±0.12、3.40±0.10,miR-25 inhibitor組48、72、96 h時OD值低于inhibitor-NC組(P均<0.05)。
3 討論
miRNA是一類約22個核苷酸長度的小分子非編碼RNA,通過與靶基因mRNA的3′端非編碼區結合,在轉錄水平上通過降解mRNA或抑制翻譯,調控人類約1/3基因表達,在細胞增殖、代謝、分化等過程中起重要作用[8]。隨著目前對miRNA研究不斷深入,miRNAs已被證實發揮癌基因或抑癌基因的作用,參與惡性腫瘤的發生發展[9],其表達失衡與多種惡性腫瘤的發生密切相關。
miR-25屬于miR-106b家族成員之一,是近年來發現的腫瘤相關miRNA分子。miR-106b家族編碼三種成熟miRNA(miR-106b、miR-25、miR-93)。miR-106b和miR-93具有相似的種子序列,而miR-25與兩者的序列不一致。已有研究表明,miR-25在多種腫瘤中表達異常,且參與腫瘤的增殖、侵襲及轉移[10]。Xiang等[11]研究發現,miR-25在非小細胞肺癌中表達上調,且通過靶向調控FBXW7表達促進腫瘤細胞增殖和轉移;Chen 等[12]發現miR-25能靶向調控RGS3表達,抑制非小細胞肺癌細胞凋亡;Peng等[13]發現miR-25靶向調控NEFL基因促進膠質瘤的增殖和轉移。本研究中我們發現,miR-25在乳腺癌組織中的表達高于癌旁組織,同時miR-25在乳腺癌細胞中的表達高于正常乳腺上皮細胞,差異均有統計學意義,提示miR-25在乳腺癌中具有癌基因功能,且進一步統計分析發現,miR-25與乳腺癌患者的臨床分期、淋巴結轉移密切相關,miR-25可促進乳腺癌的進展。
miR-25作為癌基因參與惡性腫瘤發生發展過程是一個復雜的調控網絡,其分子機制主要包括促進腫瘤增殖、侵襲與轉移,抑制腫瘤凋亡、調控細胞周期等[10]。田川等[14]報道miR-25通過調控Klf4促進肝癌細胞的增殖。本研究中我們通過miR-25 inhibitor成功抑制了乳腺癌細胞中miR-25表達,CCK-8法檢測發現,抑制乳腺癌細胞中miR-25表達能明顯抑制乳腺癌細胞的增殖活性,提示miR-25與乳腺癌的細胞增殖能力有關,可能為乳腺癌的基因治療提供新的治療靶點。
綜上所述,miR-25在乳腺癌組織和細胞系中表達上調,且與臨床分期和淋巴結轉移密切相關;體外實驗證實,抑制miR-25表達能抑制乳腺癌細胞增殖,miR-25有望成為治療乳腺癌的新靶點。
參考文獻:
[1] 謝曉娟,汪旭,佟仲生.不同年齡段乳腺癌患者臨床病理特征分析[J].山東醫藥,2015,55(34):32-33.
[2] Farazi TA, Spitzer JI, Morozov P, et al. miRNAs in human cancer[J]. J Pathol, 2011,223(2):102-115.
[3] Sorel O, Dewals BG. MicroRNAs in large herpesvirus DNA genomes: recent advances[J]. Biomol Concepts, 2016,7(4):229-239.
[4] Singh T, Adams BD. The regulatory role of miRNAs on VDR in breast cancer[J]. Transcription, 2017,8(4):232-241.
[5] Campos-Parra AD, Mitznahuatl GC, Pedroza-Torres A, et al. Micro-RNAs as Potential Predictors of Response to Breast Cancer Systemic Therapy: Future Clinical Implications[J]. Int J Mol Sci, 2017,18(6).pii: E1182.
[6] Mandujano-Tinoco EA, Garcia-Venzor A, Munoz-Galindo L, et al. miRNA expression profile in multicellular breast cancer spheroids[J]. Biochim Biophys Acta, 2017,1864(10):1642-1655.
[7] Liu Q, Wang Y, Yang T, et al. Protective effects of miR-25 against hypoxia/reoxygenation-induced fibrosis and apoptosis of H9c2 cells[J]. Int J Mol Med, 2016,38(4):1225-1234.
[8] Hammond SM. An overview of microRNAs[J]. Adv Drug Deliv Rev, 2015,87:3-14.
[9] Zhao L, Chen X, Cao Y. New role of microRNA: carcinogenesis and clinical application in cancer[J]. Acta Biochim Biophys Sin, 2011,43(11):831-839.
[10] 丁小麗,胡蓉.microRNA-25在腫瘤中的研究進展[J].重慶醫學,2017,46(4):545-548.
[11] Xiang J, Hang JB, Che JM, et al. MiR-25 is up-regulated in non-small cell lung cancer and promotes cell proliferation and motility by targeting FBXW7[J]. Int J Clin Exp Pathol, 2015,8(8):9147-9153.
[12] Chen Z, Wu Y, Meng Q, et al. Elevated microRNA-25 inhibits cell apoptosis in lung cancer by targeting RGS3[J]. In Vitro Cell Dev Biol Anim, 2016,52(1):62-67.
[13] Peng G, Yuan X, Yuan J, et al. miR-25 promotes glioblastoma cell proliferation and invasion by directly targeting NEFL[J]. Mol Cell Biochem, 2015,409(1-2):103-111.
[14] 田川,姚姍姍,董笑,等.微小RNA-25通過調控Klf4表達促進肝癌細胞的增殖和遷移[J].腫瘤,2016,36(5):512-520.

