阻斷Wnt信號通路對人絨毛膜癌細胞株JEG-3遷移及侵襲能力的影響
絨毛膜癌是一種惡性度極高的滋養層細胞腫瘤,其轉移、侵襲發生較早,是造成患者死亡的重要原因。上皮-間質轉化(epithelial to mesenchymal transition, EMT)是指上皮細胞轉化為具有間質細胞表型并具有遷移能力的過程[1]。近年來,越來越多的研究[2-3]表明,EMT在許多惡性腫瘤侵襲、轉移過程中扮演著重要角色。經典的Wnt信號通路在EMT過程中發揮著重要作用[4-5],但關于其在絨毛膜癌EMT中的作用及機制研究較少。本研究采用Wnt 信號通路外源性阻滯劑DKK-1作用于人絨毛膜癌細胞株JEG-3細胞,探討Wnt 信號通路在絨毛膜癌細胞EMT及遷移、侵襲過程的作用機制,以期為臨床提供參考。
1 材料與方法
1.1材料與主要試劑人絨毛膜癌細胞株JEG-3細胞購自北京中科院動物研究所計劃生育及生殖生物學國家重點實驗室,RPMI-1640 培養基為美國 GIBCO 公司產品(批號為Z-SD-0018-02),DKK-1為美國Sigma公司產品(使用前用細胞培養基混合粉末配制成1 000 ng/mL,-20 ℃保存),兔抗人β-catenin抗體(批號:3170906259F)、Wnt抗體(批號:2760906248E)、Vimentin抗體(批號:170503178C)、E-cadherin抗體(批號:170712589E)均為英國Abcam公司產品,聚合酶鏈反應(polymerase chain reaction,PCR)擴增試劑盒(批號:303E058)為法國Transgene公司產品,北京博大泰克生物技術有限公司完成引物設計、合成,Transwell小室(批號:GR166578-6)、十二烷基硫酸鈉聚丙烯酰胺凝膠電泳凝膠(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)(批號:GR157569-4)、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF,批號:GR162467-6)購自美國costar公司,垂直電泳儀、轉膜儀、D-140圖像分析系統為大連競邁儀器有限公司產品,常規試劑購自天津科密歐化學試劑公司。焦碳酸二乙酯(diethy pyrocarbonate,DEPC),1.0 mL的DEPC加入1000 mL雙蒸水,過夜后備用。溴化乙錠(Ethidium bromide,EB)染液配制:將1.0 g的EB加入100 mL去離子水中,用磁力攪拌器攪拌至完全溶解,室溫避光保存。
1.2方法
1.2.1細胞培養絨毛膜癌細胞復蘇后,用含10%胎牛血清的RPMI-1640培養基培養至對數生長期,再用培養液將其制備成細胞濃度為5×104cells/mL的單細胞懸液。取細胞懸液4 mL接種于50 mL培養瓶中,37℃、5% CO2培養箱中常規培養,待其貼壁生長。采用2.5 g/L胰酶消化2~3 min后繼續培養,再將其制備成5×104/ mL單細胞懸液,吸取懸液接種于6孔板內,密度為1×106/孔,每組設平行孔6 個,接種12 h后細胞貼壁生長[6]。
1.2.2蛋白印跡法(Western blot法)檢測兩組細胞中不同蛋白的表達細胞接種于6孔板內24 h后更換培養基,按完全隨機法將細胞分為實驗組與對照組,每組6孔,實驗組給予100 ng/mL的DKK-120 μL(廠家:博士德生物工程有限公司,批號:753223A),對照組加入同體積細胞培養基。干預48 h 后取兩組細胞分別經PBS漂洗、4 000 r/min離心后,加入細胞裂解液,置于冰上裂解30 min,提取總蛋白質。蛋白上樣于10 %SDS-PAGE凝膠并電泳2.5 h,電壓80 V;常規電轉移至PVDF;將PVDF膜至于封閉液中封閉,搖床平衡1 h,每組分別加入5%牛血清白蛋白/磷酸鹽吐溫緩沖液(bovineserum albumin/phosphatebuffered salinewith tween 20,BSA/PBST)緩沖液(1∶1 000)稀釋的兔抗人β-catenin 20 μL、Snail抗體20 μL、Vimentin抗體20 μL、E-cadherin抗體20 μL,4 ℃孵育過夜;PBST充分漂洗,加入用5%的脫脂牛奶/PBST緩沖液稀釋1 000倍的二抗20 μL,室溫孵育2h;取出PVDF膜用PBST充分漂洗3次;顯影曝光采用ECL電發光試劑盒。用凝膠圖像分析系統掃描各目標條帶,記錄其分子量及灰度值,待測蛋白的表達量=各目標條帶與內參蛋白甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的灰度值之比[7]。
1.2.3RT-PCR法檢測兩組細胞中不同基因的表達所有引物均由北京賽百勝生物技術公司設計并合成,引物序列詳見表1。
表1RT-PCR引物序列

引物名稱上游(5’-3’)下游(5’-3’)引物大小(bp)退火溫度(℃)β-cateninGGCACCTCTGTGAACATGCTAATCTTGTGGCTTGTCGTCA52154WntTCGCACAGCGCATCATCTATTCCGACTAGCTACCAATACC20555E-cadherinGGTCTCTCTCAGCACCTCCACCTCGGACACTACCACTCTC26350VimentinAGAGAACATAGCGGTTGTAGCACGTAGGTGTCGACGCAAT19556GAPDHTGGCTAGAGCAACACGGTGATCGCAACTGAGACGAGGG17654
干預48 h 后取出兩組細胞,將培養板中培養基吸出棄去,用PBS液充分洗滌3次。分別提取各組細胞總RNA,然后檢測其完整性、濃度和純度,如RNA合格則將 mRNA逆轉錄為模版DNA。逆轉錄反應體系:總 RNA 5~500 ng,T重復寡核苷酸(0.5 μg/μL)1 μL,酶系統反應混合物10 μL,即刻反應酶混合物1 μL,補DEPC水至20 μL。取2 μL用于PCR擴增反應,反應體系:模版 DNA 2 μL,正向引物1 μL,反向引物1 μL,1 mol/L Mg2+5 μL,三磷酸脫氧核糖核苷酸4 μL,DNA 聚合酶 0.5 μL,補雙蒸水至50 μL。
反應條件:94 ℃預變性2 min,循環1次;95 ℃變性15 s,60℃退火30 s(引物不同退火溫度也不同),72 ℃延伸1 min,共循環35次[8];72 ℃總延伸6 min。將擴增產物與緩沖液混合,然后加入2 %瓊脂糖凝膠的加樣孔中開始電泳,每孔5 μL,電壓4~10 V,電泳后EB染色,在紫外線投射儀下觀察電泳條帶。數據記錄及分析運用D-140圖像分析系統處理,目的基因表達量=目的基因的DNA條帶灰度值/內參GAPDH 的DNA條帶灰度值。
1.2.4細胞劃痕實驗觀察兩組細胞的遷移能力接種細胞前用記號筆在6孔板底部畫間隔均勻的網格線,以便觀察細胞遷移情況。細胞接種于6孔板內24 h后更換培養基,實驗組給予100 ng/mL的DKK-1 20 μL,對照組加入同體積細胞培養基。繼續培養24 h 后用無菌槍頭沿著6孔板正中畫1條劃痕,仔細刮去劃痕線右側所有的細胞,標記好劃痕線。PBS 液充分漂洗以去除漂浮的腫瘤細胞,劃痕后繼續培養。分別在劃痕后即刻、12、24及48小時時在400倍倒置相差顯微鏡下觀察細胞遷移情況。計數方法:沿劃痕線從上至下觀察 5 個視野,計數每視野下越過劃痕線的細胞數量,每培養孔遷移細胞數量=5個視野越過劃痕線的細胞數量之和。
1.2.5Transwell小室檢測兩組細胞侵襲能力兩組腫瘤細胞在0.2%牛血清白蛋白(bovine serum albumin,BSA)無血清培養基孵育(實驗組加DKK-1,100 ng/mL 20 μL)過夜。Transwell小室置入 24 孔板,將基質膠用 0.2% BSA的無血清培養基按1∶5稀釋后,吸取50 μL加入Transwell小室上室,37℃溫箱過夜使稀釋后的基質膠凝固。使用前再在小室上室加入無血清培養基100 μL,下室加入小鼠成纖維細胞NIH3T3的培養基600 μL[4],水化 30 min。制備細胞懸液,懸液濃主調整為5×105cells/mL,取200 μL懸液加入Transwell上室后放入細胞培養箱內進行細胞培養,培養條件為5%CO2、37℃,培養時間為24 h,然后將細胞鋪片于濾膜上,蘇木素染色,400倍顯微鏡觀察。每張鋪片隨機選取5個視野,每張鋪片侵襲細胞數=5個視野穿膜細胞數之和/5。
2 結果
2.1兩組細胞各蛋白表達水平比較與對照組相比,實驗組腫瘤細胞中β-catenin、Wnt、Vimentin蛋白平均表達水平明顯降低,E-cadherin蛋白表達水平明顯增高,差異有統計學意義(P<0.05)。詳見圖1、表2。

圖1 Western Blot檢測兩組細胞中各蛋白表達水平
2.2兩組細胞各基因表達情況比較與對照組相比,實驗組腫瘤細胞中β-catenin、Wnt、Vimentin mRNA表達水平均降低,E-cadherin mRNA表達水平增高,差異有統計學意義(P<0.05)。詳見表3。
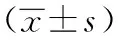
表2 兩組絨毛膜癌細胞中各蛋白的相對表達水平
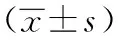
表3 兩組絨毛膜癌細胞中各基因 mRNA的表達
2.3兩組細胞遷移能力比較隨著時間的延續,兩組腫瘤細胞越過劃痕線的數目逐漸增高;與對照組相比,實驗組劃痕后12、24及48小時越過劃痕線的細胞數目均減少,組間比較差異有統計學意義(P<0.05)。詳見圖2、表4。
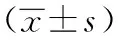
表4 兩組絨毛膜癌在不同時間內遷移細胞數目比較

圖2兩組絨毛膜癌細胞遷移情況(×400)
注:A為實驗組劃痕后0即刻;B為對照組劃痕后即刻;C為實驗組劃痕后48小時;D為對照組劃痕后48小時
2.4兩組細胞侵襲能力比較實驗組穿膜細胞數為(33.71±2.21)個,低于對照組的(78.21±4.14)個,差異有統計學意義(P<0.05)。詳見表5。
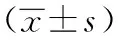
表5 兩組絨毛膜癌細胞穿膜細胞數目比較
3 討論
絨毛膜癌是滋養層細胞惡性腫瘤,生長迅速,轉移早,雖然化療可使近90%的絨毛膜癌患者病情得到控制,但部分患者仍會發生無控性的侵襲與轉移,這也導致患者病情惡化或死亡。因而,如何抑制絨毛膜癌的侵襲和轉移成為婦科臨床重要研究課題。
EMT是上皮細胞通過骨架重塑,在形態學上向間質細胞表型轉化。細胞發生EMT時,上皮性標志物E-cadherin表達量較成熟上皮表達減少,間質性標志物Vimentin 表達量較成熟上皮表達增多。王麗等[9]通過轉染GV144-SCUBE2質粒使 HCT116細胞過表達SCUBE,采用RT-PCR、Western blot法檢測EMT標志物E-cadherin、Vimentin等的表達發現,抑制Wnt /β-catenin信號通路后,可阻斷結腸癌細胞EMT發生。李琳等[10]用熊果酸體外培養腎臟足細胞,采用免疫熒光、Western blot、RT-PCR法檢測Wnt /β-catenin信號通路相關基因、EMT部分標志物的表達,發現熊果酸可通過調節Wnt /β-catenin信號通路抑制足細胞EMT。上述研究表明,EMT過程中經典Wnt信號通路(Wnt /β-catenin信號通路)起著重要作用。
本研究用Wnt 信號通路外源性阻滯劑DKK-1干擾人絨毛膜癌細胞株JEG-3細胞,采用Western blot、RT-PCR分別檢測腫瘤細胞中Wnt、β-catenin、E-cadherin、Vimentin蛋白及mRNA的表達,結果顯示,阻斷Wnt 信號通路后,通路關鍵基因Wnt、β-catenin蛋白及mRNA表達水平顯著低于對照組表達水平(P<0.05),同時間質細胞標志物Vimentin顯著降低、上皮細胞標志物E-cadherin顯著升高(P<0.05)。提愛軍等[11]通過抑制人膽管癌細胞株QBC939Wnt信號通路后,發現上皮細胞標志物E-cadherin表達升高而間質性標志物Vimentin表達減少,陳海滔等[12]用姜黃素抑制結腸癌細胞Wnt/β-catenin信號通路的實驗也得到與本研究類似的結果。這些都提示,經典Wnt信號通路在人絨毛膜癌細胞株JEG-3細胞的EMT過程中發揮著重要作用。
本研究在阻斷Wnt 信號通路后,采用Transwell侵襲實驗、劃痕實驗計數兩種腫瘤細胞越線數目及穿膜數目,以比較兩組腫瘤細胞侵襲、遷移能力改變。結果顯示,實驗組劃痕后12、24及48 h越過劃痕線的細胞數目均低于對照組(P<0.05);實驗組腫瘤細胞穿膜細胞數低于對照組(P<0.05)。提示阻斷Wnt 信號通路能降低人絨毛膜癌細胞株JEG-3細胞的遷移與侵襲能力。
結合Wnt 信號通路及EMT標志物檢測結果,阻斷Wnt 信號通路可能抑制了人絨毛膜癌細胞株JEG-3細胞EMT,進而導致腫瘤細胞遷移與侵襲能力降低。DKK-1作用于Wnt 信號通路后,β-catenin降解增加,在腫瘤細胞胞漿內逐漸堆積減少[13],并影響通路β-catenin、Snail等基因的轉錄,從而使得間質樣表型Vimentin表達減弱、上皮樣表型E-cadherin表達增強,導致腫瘤細胞出現上皮細胞樣的極性,細胞間的橋粒、細胞間橋、緊密連接等增多,侵襲、遷移能力自然降低。
綜上所述,阻斷Wnt 信號通路后,人絨毛膜癌細胞株JEG-3細胞EMT受抑,進而出現遷移與侵襲能力降低,但EMT過程受抑的具體作用位點、腫瘤細胞遷移與侵襲能力降低的具體機制等問題還有待于進一步研究。
[1]ACLOQUE H,ADAMS M S,FISHWICK K,et al.Epithelial-mesenchymal transitions:the importance of changing cel state in development and disease[J].J Clin Invest,2009,119(6):1438-1449.
[2]PRASAD C P,RATH G,MATHUR S,et al.Expression analysis of E-cadherin,Slug and GSK3 beta in invasive ductal carcinoma of breast[J].BMC Cancer,2009,9(1):325.
[3]KAUFHOLD S, BONAVIDA B.Central role of Snail1 in the regulation of EMT and resistance in cancer:a target for therapeutic intervention[J].J Exp Clin Cancer Res,2014,33(1):62.
[4]HUANG D,DU X.Crosstalk between tumor cells and microenvironment via Wnt pathway in colorectal cancer dissemination[J].World J Gastroenterol,2008,14(12):1823-1827.
[5]包秀麗,劉婷婷,王艷艷,等.Wnt3a誘導人晶狀體上皮細胞細胞外基質合成和膠原凝膠收縮的機制研究[J].中華實驗眼科雜志,2016,34 (7):597-601.
[6]張延新,趙紅軍,宋文剛,等. TWEAK 反義寡核苷酸對人結腸癌細胞系SW480增殖及侵襲能力的影響[J].解剖學報,2014,45 (1):74-79.
[7]郝淑玲,王衛平,李建東,等.腎上腺髓質素和轉化生長因子β1對肺成纖維細胞增殖及c-myc表達的影響[J].中華實用診斷與治療雜志,2015,29(4):333-335.
[8]王科峰,柴林燕.替米沙坦對AGEs誘導人內皮細胞表達VCAM-1及MCP-1的作用和機制[J].安徽醫學,2017,38(4):395-400.
[9]王麗,張寧,張龍江,等.SCUBE2 過表達通過 Wnt /β-catenin 抑制結直腸癌細胞上皮-間質轉化[J].中國病理生理學雜志,2016,32 (12):2245-2250.
[10]李琳,徐莉,范秋靈,等.熊果酸通過調節Wnt/β-catenin通路抑制高糖誘導的足細胞上皮間充質轉分化[J].中華腎臟病雜志,2016,32 (5):365-370.
[11]提愛軍,向丹,李磊華,等.9-順式視黃酸抑制人膽管癌細胞株QBC939Wnt信號通路和細胞遷移[J].中華實驗外科雜志,2015,32 (11):2632-2635.
[12]陳海滔,徐超,姚慶華.姜黃素通過調節Wnt/β-catenin信號通路抑制結腸癌細胞上皮間質轉化[J].腫瘤學雜志,2017,23(1):35-39.
[13]鄒慧娟,鄭航,李明君,等.Wnt信號通路在結腸癌中的表達及其作用機制[J].中國老年學雜志,2016,36 (14):3373-3374.

