腦出血患者腦脊液IL-1β TNF-α和CRP含量的變化及臨床意義
李 敬
安陽市中醫院檢驗科,河南 安陽 455000
腦出血(cerebral hemorrhage,CH)后繼發性腦損傷可嚴重影響患者的預后,不利于神經功能恢復。近年來研究發現,腦出血發生后,在腦組織局部出現炎癥細胞聚集,其分泌的多種細胞因子介導免疫和炎癥反應,在繼發性腦損傷的發生發展中發揮重要作用[1-3]。本文觀察了58例病程>28 d的急性腦出血患者腦脊液炎癥性細胞因子IL-1β、TNF-α和CRP含量的變化,分析其與臨床病程的相關性,現報告如下。
1 資料與方法
1.1研究對象選擇58例急性腦出血患者,均為2013-01—2015-12我院神經內科急診接收的患者,經CT和MRI確診,未合并腦室出血,出血量30~50 mL,女19例,男39例,年齡45~76(58.3±14.7)歲。全部患者于發病后12 h、24 h、48 h、96 h和4周行腰椎穿刺取腦脊液(CSF),ELISA法測定腦脊液IL-1β、TNF-α和CRP含量。正常對照組20例,男13例,女7例,年齡39~55(42.4±6.33)歲,均來自確診無器質性病變或免疫系統疾病的腰椎麻醉患者,收集腦脊液,檢測IL-1β、TNF-α和CRP含量。
1.2方法全部實驗參與者均簽署知情同意書,在腦出血發生12 h、24 h、48 h、96 h和4周取CSF 1 mL,對照組通過腰麻取CSF 1 mL。
1.3細胞因子測定采用雙抗體夾心ELISA方法檢測,由深圳晶美生物公司提供IL-1β、CRP、TNF-α檢測試劑盒;日本日立公司的7170型全自動生化分析儀;芬蘭雷勃公司的LabsystemsNK3酶標儀;美國Backman公司的低溫離心機Allgra;日本三洋公司的MSD700型超低溫冰箱;上海醫療設備廠生產的SE-1700型旋轉蒸干器;澳大利亞SGE公司的微量進樣器;美國Alaris公司的IVAC P6000型微量泵。全部操作按照試劑盒說明書進行,標準品稀釋成不同濃度,測繪標準曲線,將樣品與標準曲線對照,計算得出IL-1β、TNF-α和CRP含量。
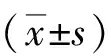
2 結果
2.1CSF細胞因子檢測結果與對照組比較,腦出血患者IL-1β、TNF-α水平明顯升高(P<0.05),CRP無明顯變化(P>0.05)。見表1。
2.2急性腦出血患者不同時間點細胞因子檢測結果急性腦出血患者隨時間推移CSF中IL-1β和TNF-α水平逐漸升高,48 h后緩慢下降,與對照組比較無顯著差異(P>0.05),CRP無明顯變化(P>0.05)。見表2。

表1 2組12 h后細胞因子表達量比較

表2 不同時間點急性腦出血患者CSF細胞因子檢測結果
3 討論
腦出血后血腫內及其周圍存在較明顯的炎癥反應,以巨噬細胞、活化的小膠質細胞、中性粒細胞滲出、聚集為特征[4-5]。炎癥反應可影響局部血液循環,誘導蛋白產物的生成和細胞因子的基因表達,誘使炎癥細胞向損傷區聚集,并釋放白細胞介素-6(IL-6)、白細胞介素-8(IL-8)、白細胞介素-1(IL-1)和腫瘤壞死因子-α(TNF-α)等多種生物活性物質[6-8]。同時,腦出血后血腫周圍可形成缺血半暗帶區,存在明顯的炎癥反應,腦血流明顯下降[9]。參與腦內炎癥反應的關鍵細胞為活化的小膠質細胞,正常時處于休眠狀態,一旦被激活可分泌或釋放炎癥因子和一些細胞毒性物質;另一方面,通過直接接觸神經細胞發揮腦內吞噬作用,進而嚴重損傷神經細胞。此外,研究發現,腦出血周圍亦可出現中性粒細胞浸潤,可釋放各種細胞因子,如IL-6、TNF-α等,可加重腦損傷,48~72 h達到高峰[6,9]。
IL-1β是一種由淋巴細胞和單核-巨噬細胞分泌的促炎癥細胞因子,具有炎癥調節和免疫反應等多種功能,在腦組織中主要由星形膠質細胞和小膠質細胞產生[10-11]。研究發現,IL-1β可增加血管內皮通透性,進一步加重腦水腫[12-15]。腦出血后被激活的鐵、凝血酶和亞鐵血紅素等血液成分可引起IL-1、IL-6、TNF-α等細胞因子的釋放[16-18]。在急性腦梗死患者中,IL-1β在血漿和腦脊液中均明顯增高,且與腦出血的神經損害程度和范圍有明顯相關性[17]。
在體內細胞因子網絡中起重要調節作用的TNF-α,是激活的單核巨噬細胞分泌的細胞因子,許多學者認為其是眾多細胞因子的始動因子,可直接促進中性粒細胞向病灶區聚集,誘導小膠質細胞和白細胞釋放IL-1、IL-6等炎癥因子[6-8]。腦出血后機體的應激反應可激活體內單核巨噬細胞系統,產生TNF-α[7-8];通過細胞因子級聯反映誘導IL-6等細胞因子產生,并通過與其他炎癥因子相互作用放大炎癥反應;此外,腦出血后血凝塊成分的刺激和血管內皮細胞受損均可促使TNF-α大量產生[18-19]。TNF-α可上調誘導型一氧化氮合酶,使炎癥反應加重[20];同時,其能破壞血腦屏障的完整性,并使血腦屏障的通透性增加;還可引起腦水腫,促使形成急性階段的應激反應,誘導細胞凋亡等[21];此外,還可促進激活的白細胞向缺血區遷移,釋放自由基,進一步加重腦損傷。
本研究表明,急性腦出血患者相較于恢復期和對照組腦脊液中的IL-1β和TNF-α含量均顯著升高。腦出血時,IL-1β和TNF-α含量即開始迅速上升,于48 h達到高峰,該現象與腦組織損傷的臨床癥狀具有一定相關性,隨后IL-1β和TNF-α緩慢下降。而CRP是由干細胞合成的急性相蛋白,在機體受到炎癥性刺激如微生物入侵或組織損傷時產生,在腦脊液中含量相對固定,本研究并未發現其與腦出血炎癥反應的相關性。
[1]EGASHIRA Y,HUA Y,KEEP R F,et al.Lipocalin 2 and Blood-Brain Barrier Disruption in White Matter after Experimental Subarachnoid Hemorrhage[J].Acta Neurochir Suppl,2016,121:131-134.
[2]沈佳,陳彬,鄭關榮.尼莫地平注射液聯合參附注射液治療創傷性蛛網膜下腔出血的臨床研究[J].中國臨床藥理學雜志,2017,33(19):1 865-1 867.
[3]呂超,秦龍,黃勝明.聯合應用甘露醇、單唾液酸神經節苷脂對腦出血致腦水腫的臨床療效及對神經功能的影響[J].中國生化藥物雜志,2017,37(1):172-175.
[4]ZENG Y J,LIU G F,LIU L P,et al.Anemia on admission increases the risk of mortality at 6 months and 1 year in hemorrhagic stroke patients in China[J].J Stroke Cerebrovasc Dis,2014,23(6):1 500-1 505.
[5]徐玢,張初吉,劉志忠,等.高滲鹽水對重癥腦出血患者單核細胞亞群及細胞因子表達的影響[J].中國臨床醫生雜志,2016,44(7):38-42.
[6]崔延昆,廉曉宇,李明軍,等.腦出血患者血清中IL-1β與周圍腦組織水腫的相關性研究[J].齊齊哈爾醫學院學報,2015,36(36):5 474-5 475.
[7]吳煜,鄒顯巍,程閏夏.阿托伐他汀對腦出血大鼠腦組織NF-κB、TNF-α和IL-1β表達的影響[J].成都醫學院學報,2017,12(4):444-448.
[8]張華新,張寶霞,李大軍,等.云南白藥膏對出血性腦卒中頭痛患者內皮素、腫瘤壞因子-α、白細胞介素-1β水平的影響[J].國際檢驗醫學雜志,2017,38(6):766-768.
[9]TANG W C,HSU Y C,WANG C C,et al.Early electroacupuncture treatment ameliorates neuroinflamma-tion in rats with traumatic brain injury[J].BMC Complement Altern Med,2016,16(1):470.
[10]MCDONALD S J,SUN M,AGOSTON D V,et al.The effect of concomitant peripheral injury on traumatic brain injury pathobiology and outcome[J].J Neuroinflammation,2016,13(1):90.
[11]司賢峰.醒腦靜注射液對急性腦出血患者血液細胞因子水平的影響[J].中國實用神經疾病雜志,2017,20(1):112-113.
[12]黃文輝.早期預警分級干預對高血壓腦出血患者代謝指標及炎性因子的影響[J].中國實用神經疾病雜志,2016,19(13):19-21.
[13]CHEN W,HU Y Q,JIANG L F,et al.Mechanism of action of Zhuyu Annao pill in mice with cerebral intrahemorrhage based on TLR4[J].Asian Pac J Trop Med,2016,9(11):1 095-1 100.
[14]KOOIJMAN E,NIJBOER C H,VAN VELTHOVEN C T,et al.Long-term functional consequences and ongoing cerebral inflammation after subarachnoid hemorrhage in the rat[J].PLoS One,2014,9(6):e90584.
[15]ZHANG Z Y,SUN B L,YANG M F,et al.Carnosine attenuates early brain injury through its antioxidative and anti-apoptotic effects in a rat experimental subarachnoid hemorrhage model[J].Cell Mol Neurobiol,2015,35(2):147-157.
[16]崔延昆,廉曉宇,李明軍,等.腦出血患者血清中IL-10與周圍腦組織水腫的相關性分析[J].牡丹江醫學院學報,2016,37(3):1-3.
[17]王校偉,馮春國.腦出血患者血清細胞因子的動態變化及其與周圍腦組織水腫的相關性[J].實用臨床醫藥雜志,2015,19(5):25-27.
[18]張永亮.人高血壓腦出血急性期外周血中IL-17的作用[D].溫州:溫州醫科大學,2014.
[19]ANDERSON G D,PETERSON T C,VONDER HAAR C,et al.Effect of Traumatic Brain Injury,Erythropoietin,and Anakinra on Hepatic Metabolizing Enzymes and Transporters in an Experimental Rat Model[J].AAPS J,2015,17(5):1 255-1 267.
[20]BIMPIS A,PAPALOIS A,VOUMVOURAKIS K,et al.Neuronal tumour necrosis factor-α and interleukin-1β expression in a porcine model of intracerebral haemorrhage:Modulation by U-74389G[J].Brain Res,2015,1 615:98-105.
[21]LIANG H,GUAN D,GAO A,et al.Human amniotic epithelial stem cells inhibit microglia activation through downregulation of tumor necrosis factor-α,interleukin-1β and matrix metalloproteinase-12 in vitro and in a rat model of intracerebral hemorrhage[J].Cytotherapy,2014,16(4):523-534.

