易誤診的腦淀粉樣血管病分析并文獻復習
王甜甜 王雪晶 丁雪冰 滕軍放
1)鄭州大學第一附屬醫院神經內科,河南 鄭州 450052 2)河南省高等學校臨床醫學重點學科開放實驗室,河南 鄭州 450052
腦淀粉樣血管病(Cerebral amyloid angiopathy,CAA),是一種由淀粉樣蛋白β(Aβ)沉積在軟腦膜血管、皮質動脈和毛細血管壁為特征的腦小血管病,由于Aβ與腦血管相互作用引起的腦血管壁完整性喪失導致CAA[1],其預后較差,目前CAA尚無特效治療,需早期診斷,給予腦出血治療、抗癲癇、抗氧化劑等對癥支持治療。現報道我科3例不同表現腦血管病易誤診的腦淀粉樣血管病病例,并復習相關文獻如下。
1 臨床資料
例1患者,男,85歲,以“進行性言語不利、右側肢體無力12 h ”為主訴入院。12 h前吃早飯時出現右下肢無力跪倒在地,攙扶下無法行走,言語不利,查頭CT示:左側額頂葉腦出血;癥狀逐漸加重,出現右上肢無力,無法抬起,偶有右下肢抽動,每次抽動1~2次,無意識喪失。體格檢查:發育正常,消瘦,心肺腹部未見異常,意識模糊,體格檢查欠合作,雙側瞳孔等大等圓,直徑約3 mm,左側對光反射稍遲鈍,右側對光反射靈敏,雙眼向左側凝視,雙側角膜反射存在,四肢肌張力增高,以左上肢為著,左側肢體肌力Ⅳ級,右上肢肌力Ⅳ級,右下肢肌力Ⅱ級,四肢腱反射(+),左下肢Babinski征(-),右下肢Babinski征(+),頸強直,頦下4橫指,余體格檢查不能配合。既往史:5 a前患“腦出血”未遺留后遺癥狀,有高血壓史,未監測具體不詳;輔助檢查:血常規、肝腎功能、血凝、血脂、ECG等未見明顯異常;心臟、肝膽胰脾彩超未見明顯異常。頭部CT:左額頂葉多發血腫,蛛網膜下腔出血,腦室積血。頭顱MRI示(見圖1A、B):雙側額葉、左側額頂葉多發占位性病變并部分合并出血,左側額部少量硬膜下血腫,左側額葉蛛網膜下腔出血;SWI示(見圖1C):多發額葉、顳葉、頂葉及雙側基底節區多發異常信號,考慮為含鐵血黃素沉積。
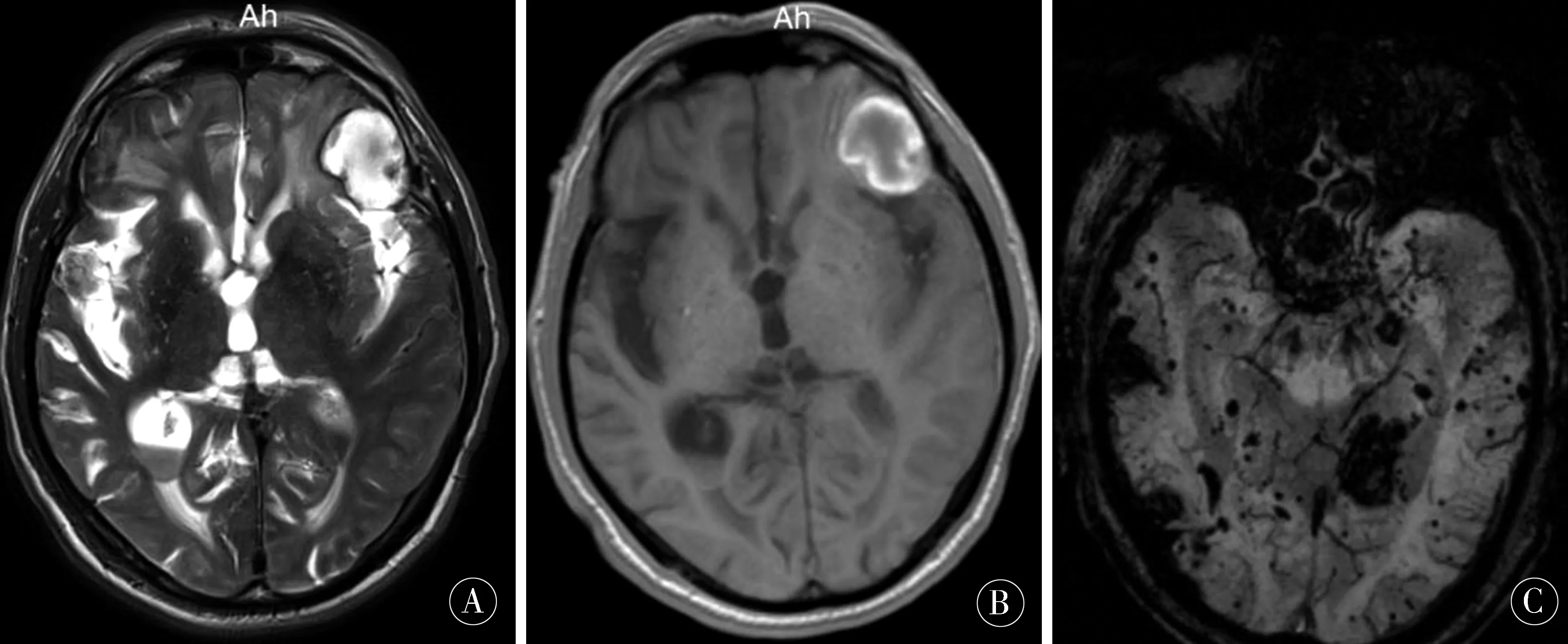
圖1 A、B:雙側額葉、左側額頂葉多發占位性病變并部分合并出血,左側額部少量硬膜下血腫,左側額葉蛛網膜下腔出血;C:SWI示:多發額葉、顳葉、頂葉及雙側基底節區多發異常信號
例2患者,男,68歲,以“認知功能障礙7月余”為主訴入院,7月余前家屬發現患者精神變差,伴記憶力下降,未治療,4月余前于當地縣醫院行頭顱MRI未見明顯異常,認知障礙逐漸加重,伴面部表情減少,表情呆滯,伴記憶力減退,來我院門診頭顱CT示:左側顳葉低密度影,腦白質脫髓鞘腦萎縮;頭顱MRI示(見圖2A、B):左側顳葉出血性病灶,雙側大腦半球及雙側小腦半球多發異常信號,考慮含鐵血黃素沉積或多發海綿狀血管瘤,請結合臨床及其他檢查以除外淀粉樣變性或毛細血管擴張癥。體格檢查:發育正常,心肺腹部未見異常;神志清、精神欠佳,高級智能活動基本正常,雙側瞳孔等大等圓,直徑約3 mm,對光反射靈敏,左側眼瞼稍下垂,右側鼻唇溝變淺,口角偏向左側,右側口角下垂,伸舌右偏,四肢肌張力檢查不配合,左側肢體及右上肢肌力V級,右下肢肌力IV級,四肢腱反射(+),雙側病理征陰性,頸軟,無抵抗,腦膜刺激征陰性。既往史:既往體健。輔助檢查:血常規、肝腎功、風濕免疫全套、甲功、傳染病均未見異常,ECG:竇性心動過緩,左心室高電壓,下外側壁ST段改變,性質待定。彩超:雙側頸總動脈內中膜增厚;肝彌漫性回聲改變,膽囊壁毛糙;左室舒張功能下降。腦脊液:壓力150 mmH2O,葡萄糖、蛋白及氯化物正常,細胞數正常;腦脊液Aβ42較正常值高,tau蛋白、磷酸化tau蛋白較正常高;簡易智能狀態檢查量表(MMSE)評分為18分,中度認知功能障礙。頭SWI示(見圖2C):大腦皮質下區顯示散在分布多發斑點狀極低信號;韋氏成人智力測定為46分,操作部分損傷嚴重,中度智能障礙。臨床癡呆評定量表(clinical dementia rating,CDR)顯示中重度癡呆。
例3患者,男,70歲,以“陣發性左側肢體抽搐1月”為主訴入院,1月前患者夜間睡眠中突發左手緊握,左下肢僵直,持續1~2 min,自行緩解,無牙關緊閉,雙眼上翻癥狀;后間隔2 d上述癥狀再發。20 d前上述癥狀又發作3次,至當地醫院,查頭部MRI示:頭部枕葉異常信號。胸部CT:慢性阻塞性肺疾病。為求進一步診治來我院,門診以“癥狀性癲癇”為診斷收入我科。體格檢查:發育正常,體型勻稱,意識清楚,精神差,語言清晰,高級皮層功能檢查基本正常,雙眼無上瞼下垂,眼球位置居中,各方向運動充分,無復視,無眼震,瞳孔等大等圓,直徑3 mm,對光反射靈敏,調節反射存在,余顱神經檢查未見明顯異常,四肢肌張力正常,左側肌力IV級,右側肢肌力V級,左下肢Babinski征(+),右下肢Babinski征(-),雙側指鼻試驗穩準,步態蹣跚,走一字不穩;閉目難立征陽性。既往史:十二指腸潰瘍病史20 a,慢性阻塞性肺疾病10 a,右眼青光眼手術4 a,鼻息肉切除術1 a;輔助檢查:血常規、肝腎功能、凝血功能、血脂、ECG、彩超等均未見明顯異常。腦脊液:壓力:140 mmH2O。無色、透明,細胞數正常,淋巴細胞74%,糖、氯化物、蛋白未見明顯異常,腫瘤標志物、病毒全套、腦脊液免疫球蛋白未見異常,ADA、結明三項、風濕免疫抗體、寄生蟲未見異常。胸椎+腰椎MRI平掃及增強:(1)胸椎退行性變;(2)胸7、10椎體內脂肪沉積;(3)胸腰椎MRI增強掃描未見明顯異常強化;頭頸聯合CTA:顱內血管多發輕度狹窄;頭部MRI(見圖3A、3B):1、右側頂葉異常信號,炎癥?缺血?雙側大腦半球、小腦半球、雙側基底節區、雙側丘腦、橋腦多發異常信號,考慮含鐵血黃素沉積或其他順磁性物質沉積;SWI(見圖3C):雙側額頂葉、雙側側腦室旁、雙側基底節區、雙側丘腦、雙側枕葉、雙側顳葉、橋腦、雙側小腦半球多發異常信號。
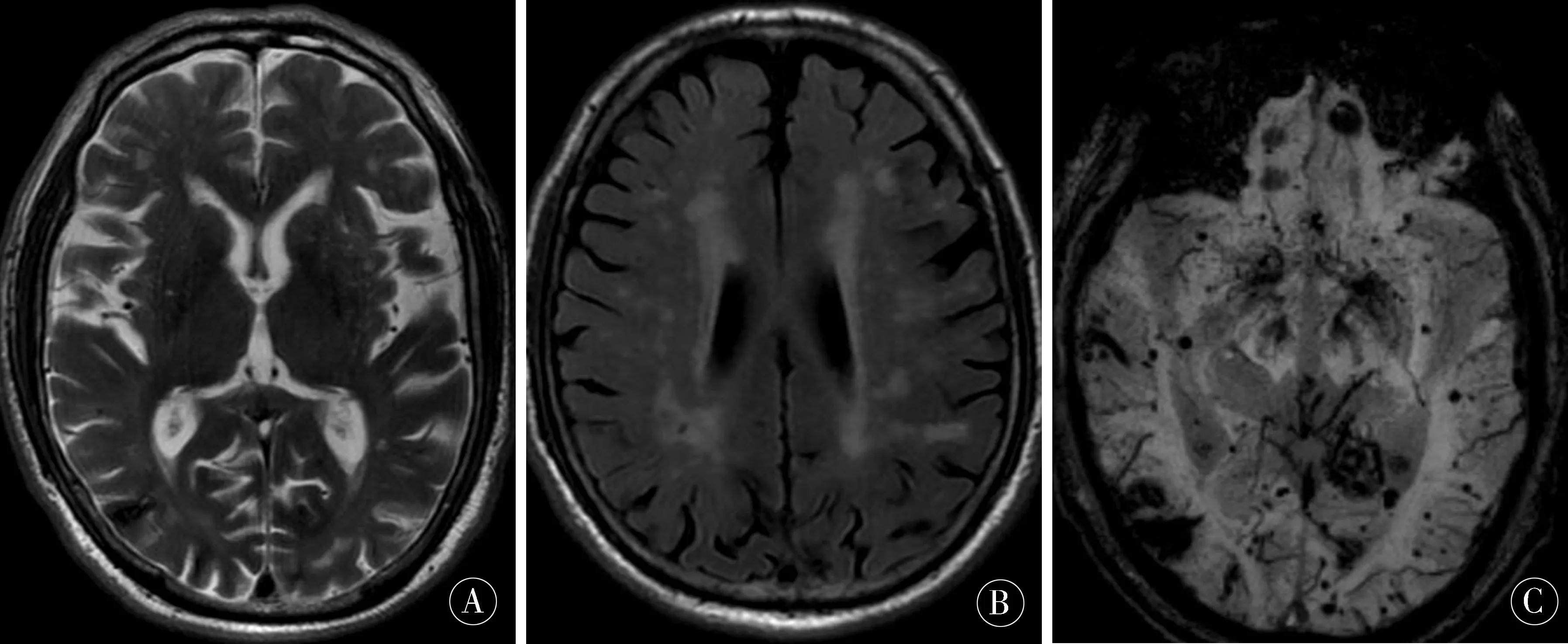
圖2 A、B:頭顱MRI示:左側顳葉出血性病灶,雙側大腦半球及雙側小腦半球多發異常信號;C:頭SWI示大腦皮質下顯示散在分布多發斑點狀極低信號,含鐵血黃素沉積
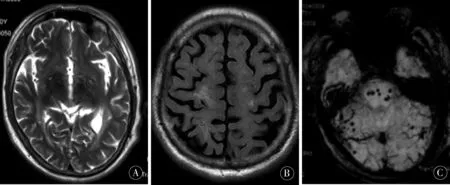
圖3 A、B:頭部MRI示右側頂葉異常信號,雙側大腦半球、小腦半球、雙側基底節區、雙側丘腦、橋腦多發異常信號,含鐵血黃素沉積或其他順磁性物質沉積;C:SWI示雙側額頂葉、雙側側腦室旁、雙側基底節區、雙側丘腦、雙側枕葉、雙側顳葉、橋腦、雙側小腦半球多發異常信號
2 討論
腦淀粉樣血管病(cerebral amyloid angiopathy,CAA)是一種常見的腦小血管病,CAA通常是散發性,發病率隨年齡增長而增高,65~74歲為2.3%,80歲以上為100%[2-3]。CAA可見于健康老年人,更常見于阿爾茨海默病(Alzheimer's disease,AD)[4],其特征性病變是Aβ淀粉樣物質在大腦皮質及覆蓋其上的軟腦膜血管管壁漸進性沉積,臨床主要表現為復發性和(或)多發性腦葉出血、癡呆、認知和神經功能減退、暫時性局灶性神經癥狀發作(transient focal neurologic symptoms,TFNE)等。淀粉樣物質多沉積于動脈壁的中層和外膜中,特別在鄰近外膜的外表面最明顯,嚴重時中層彈力層完全被淀粉樣所取代,以致中層薄弱,血管擴張,微動脈瘤形成或破裂多引起出血。
腦病理活檢是診斷CAA的金標準,由于臨床工作開展有限,目前主要依據波士頓診斷標準進行診斷[5],部分CAA患者因短暫性腦缺血發作或腦梗死(cerebral infarction,CI)起病,故可經過缺血性腦卒中疾病相關的影像學檢查發現CAA;CAA最常見神經影像學表現為腦內微出血(cerebral microbleeds,CMBs),目前磁敏感加權成像(susceptibility weighted imaging,SWI)是 CMBs 的常用檢查方法。近年來,隨著腦功能成像中磁敏感加權成像和高分辨磁共振成像技術的不斷推廣,其已經開始應用于CAA及缺血性腦卒中的診斷[6]。散發性腦淀粉樣血管病(CAA)和高血壓性動脈病(HA)老年人最常見的腦小血管疾病;CAA來自于β淀粉樣蛋白沉積小皮質動脈和腦膜下動脈,是自發性大腦性腦內出血(ICH)的常見原因,相比之下,HA(通過脂質血癥,動脈硬化或纖維蛋白壞死)主要影響小的穿通動脈、深部核團和深層白質,是深部腦ICH的常見病因。研究[7]表明,CAA和HA具有本質上不同的病理機制和臨床相關性。本文病例1以突發言語不利、肢體無力為表現的腦出血形成所致的局灶性神經功能障礙為體征,輔助檢查顯示雙側額葉多發異常信號及左側額頂葉腦出血,臨床表現為老年人、多發性、復發性腦出血(尤其是腦葉出血),無明顯或僅輕度高血壓及腦動脈硬化征象,所以必要時行SWI檢查排除高血壓等其他原因引起的腦出血,減少漏診和誤診至關重要。CAA引起的腦葉出血在CT上可顯示,一般常見出血部位是皮質或皮質下,其中以額、頂葉最多見,雖然高血壓腦出血也可以有斑點樣出血,但局限于皮質或皮質下區域的多發性出血不是其特征,且CAA腦出血的出血灶邊緣不整,可向皮質延伸,血腫周圍的低密度區較寬,這些與發生在腦深部的高血壓腦出血明顯不同[8]。病例2以認知功能障礙為主要表現,腦脊液細胞蛋白正常,Aβ42較正常值高,tau蛋白、磷酸化tau蛋白較正常高,表現為進展性癡呆,在數日或數周內迅速出現認知功能下降。這種快速進展很可能是由嚴重的血管淀粉樣變、皮質出血和梗死、白質破壞或神經炎樣斑塊堆積造成的。而CAA屬腦內微血管病變,以癡呆為主要表現的CAA多見于55歲以上的老年人,有30%的CAA患者出現老年性癡呆的癥狀,如嚴重的記憶障礙、注意力、定向力和計算力減退,或精神異常,隨年齡增高發病明顯增加。檢查磁共振磁敏感序列已有多發陳舊性出血的含鐵血黃素沉積方考慮為CAA,多次無癥狀微出血會導致患者進行性癡呆,而淀粉樣蛋白在皮層血管沉積,造成管腔狹窄,慢性腦部缺血,也是CAA患者進行性癡呆的原因[9]。病例3以陣發性左側肢體抽搐為主要表現,SWI示雙側額頂葉、雙側側腦室旁、雙側基底節區、雙側丘腦、雙側枕葉、雙側顳葉、橋腦、雙側小腦半球多發異常信號。由于皮質血管因淀粉樣物質沉積導致血流灌注減少,CAA可以出現缺血性梗死或出血性梗死,引起癲癇發作、認知障礙、白質腦病等。3例考慮CAA患者的早期臨床表現明顯不同,容易誤診為單純腦血管病、癲癇發作及癡呆,如果沒有進一步完善相關影像學檢查及深入分析病例,容易誤診。
腦淀粉樣血管病(CAA)是老年腦中常見的神經病理學發現。其發生率及嚴重程度隨年齡增加這一點已成定論,載脂蛋白ApoE4增加CAA的發病風險,而ApoE2降低腦實質內Aβ的沉積,反而增加CAA相關性腦出血的發病。 APOE的ε2和ε4基因型均報道與CAA的發病和嚴重程度有關[10-11]。此外,血清淀粉樣蛋白P組分(SAP)與組織淀粉樣蛋白沉積物共同沉積,并且作為淀粉樣變性病診斷和治療的靶點引起了越來越多的關注[12]。導致CAA的另一種機制可能是抗Aβ自身抗體所致的CAA相關炎癥反應(CAA-I),具有血管性水腫以及多皮層和皮層下微出血的特征。大多數CAA可以不表現出任何癥狀和體征,部分的臨床表現各不相同,如病例1中以腦出血最多見,無明顯或僅輕度高血壓及腦動脈硬化征象,并排除其他原因引起的腦出血。病例2以認知功能障礙、快速進展性癡呆為主要表現;病例3中暫時性局灶性神經癥狀發作(transient focal neurologic symptoms,TFNE)也是CAA的臨床表現之一,以反復、刻板發作為主,如局限性無力、麻木或者語言障礙,持續數分鐘自行緩解[13],此類癥狀需與短暫性腦缺血發作、偏頭痛先兆及局灶性癲癇發作等相鑒別。
CAA的診斷目前常采用Boston標準。近年來,隨著影像學技術的發展,LINN等[14]結合最新的影像學進展對Knudsen制定的CAA波士頓標準進行了修訂。具體如下:(1)高度懷疑的CAA:結合臨床癥狀和MRI、CT影像學檢查顯示:年齡≥55歲;局限于腦葉、皮質或皮質一皮質下出血(包括小腦出血)的多發性出血,或局限于腦葉、皮質和皮質一皮質下的單發性出血合并聚集性或彌散性表面鐵質沉著。(2)可能的CAA,結合I臨床癥狀和MRI、CT影像學檢查顯示:年齡≥55歲;單發性腦葉、皮質和皮質下出血,或發現聚集性或彌散性表面鐵質沉著。研究表明,對已經證實的CAA患者使用MRI的T2加權像進行分析,以腦出血為主要表現的CAA,波士頓的診斷標準有很高的靈敏度,皮質下微出血可增加其靈敏度,而深部白質、基底神經節、丘腦、腦干等出血降低波士頓標準的靈敏度[15]。
磁敏感加權成像(susceptibility weighted imaging,SWI)是一種新的MRI技術,可見皮層和皮層下多發斑點狀皮層出血和腦室旁白質變性支持診斷。一般的MRI 及高分辨MRI對于顱內微出血(CMBs)的檢測,不僅能夠發現 CMBs 的發生及分區,也能夠預測未來可能出現的卒中[16]。選用SWI 序列及 GRE 序列是目前檢查 CMBs 最常用的方法,研究發現大部分CMBs均<5 mm,國外學者使用不同厚度的掃描發現微小出血和稍大出血的分界數值為 5.7 mm,并且 SWI 序列對 CMBs 的檢出率較 GRE 序列有較好的一致性[17]。
目前對于CAA仍缺乏特殊治療方法。對于腦出血患者暫時同高血壓腦出血的治療,并輔以其他對癥支持治療。另外,注意避免使用抗凝劑,慎用抗血小板聚集藥物。對于可能與自身免疫反應相關的CAA-I,可以試用大劑量激素沖擊療法或環磷酰胺治療或其他免疫抑制療法;對于以“腦出血、癲癇發作、認知障礙、白質腦病”等起病的CAA,給予對癥支持治療,早期診斷并治療,提高患者生活質量。
(感謝滕軍放老師、王雪晶老師及丁雪冰老師的熱情關懷和悉心指導,在論文的選題、構思和資料的收集方面以及成文定稿方面,我都得到老師悉心細致的教誨和無私的幫助;在論文的寫作過程中,也得到了許多同學的寶貴建議、支持和幫助,在此一并致以誠摯的謝意。)
[1]INOUE Y,UEDA M,TASAKI M,et al.Sushi repeat-containing protein 1:a novel disease-associated molecule in cerebral amyloid angiopathy[J].Acta Neuropathol,2017,134(4):605-617.
[2]CHARIDIMOU A,GANG Q,WERRING D J.Sporadic cerebral amyloid angiopathy revisited:recent insights into pathophysiology and clinical spectrum[J].J Neurol Neurosurg Psychiatry,2012,83(2):124-137.
[3]ATTEMS J,JELLINGER K,THAL D R,et al.Review:sporadic cerebral amyloid angiopathy[J].Neuropathol Appl Neurobiol,2011,37(1):75-93.
[4]YAMADA M.Cerebral amyloid angiopathy:emerging concepts[J].J Stroke,2015,17(1):17-30.
[5]SMITH E E,GREENBERG S M.Clinical diagnosis of cerebral amyloid angiopathy:validation of the Boston criteria[J].Curr Atheroscler Rep,2003,5(4):260-266.
[6]CHARIDIMOU A,BOULOUIS G,PASI M,et al.MRI-visible perivascular spaces in cerebral amyloid angiopathy and hypertensive arteriopathy[J].Neurology,2017,88(12):1 157-1 164.
[7]XU W H,LI M L,NIU J W,et al.Intracranial artery atherosclerosis and lumen dilation in cerebral small-vessel diseases:a high-resolution MRI Study[J].CNS Neurosci Ther,2014,20(4):364-367.
[8]ATTEMS J,JELLINGER K,THAL D R,et al.Review:sporadic cerebral amyloid angiopathy[J].Neuropathol Appl Neurobiol,2011,37(1):75-93.
[9]張楚楚,孫永安,程欣欣,等.磁敏感成像對腦淀粉樣血管病導致腦出血的診斷價值探討[J].中華老年心腦血管病雜志,2013,15(12):1 253-1 256.
[10]CHARIDIMOU A,MARTINEZ-RAMIREZ S,SHOAMANESH A,et al.Cerebral amyloid angiopathy with and without hemorrhage:evidence for different disease phenotypes[J].Neurology,2015,84(12):1 206-1 212.
[11]BIFFI A,SONNI A,ANDERSON C D,et al.Variants at APOE influence risk of deep and lobar intracerebral hemorrhage[J].Ann Neurol,2010,68(6):934-943.
[12]RICHARDS D B,COOKSON L M,BERGES A C,et al.Therapeutic Clearance of Amyloid by Antibodies to Serum Amyloid P Component[J].N Engl J Med,2015,373(12):1 106-1 114.
[13]MARTINEZ-RAMIREZ S,GREENBERG S M,VIS-WANATHAN A.Cerebral microbleeds:overview and implications in cognitive impairment[J].Alzheimers Res Ther,2014,6(3):33.
[14]LINN J,HALPIN A,DEMAEREL P,et al.Prevalence of superficial siderosis in patients with cerebral amyloid angiopathy[J].Neurology,2010,74(17):1 346-1 350.
[15]VAN ROODEN S,VAN DER GROND J,van den Boom R,et al.Descriptive analysis of the Boston criteria applied to a Dutch-type cerebral amyloid angiopathy population[J].Stroke,2009,40(9):3 022-3 027.
[16]REVESZ T,HOLTON J L,LASHLEY T,et al.Sporadic and familial cerebral amyloid angiopathies[J].Brain Pathol,2002,12(3):343-357.
[17]MAAT-SCHIEMAN M L,VAN DUINEN S G,Bornebroek M,et al.Hereditary cerebral hemorrhage with amyloidosis-Dutch type (HCHWA-D):II—A review of histopathological aspects[J].Brain Pathol,1996,6(2):115-120.

