硫辛酸對大鼠腦缺血再灌注損傷的神經保護作用
劉慶杰 王 偉 白宏英
1)永城市人民醫院神經內科,河南 永城 476600 2)南陽醫學高等專科學校,河南 南陽 473061 3)鄭州大學第二附屬醫院神經內科,河南 鄭州 450014
缺血性卒中是目前危害人類健康的主要疾病,在缺血性疾病的搶救和治療期間,組織損傷已被證明不單由缺血本身引起的,而且包括血液供應恢復之后發生的進一步惡化,稱為“缺血/再灌注”(I/R)損傷。這種病理過程涉及多種因素,包括氧化應激,炎癥反應和細胞凋亡等多種病理生理過程。硫辛酸(LA)是一種硫醇類抗氧化劑,已被臨床批準和廣泛應用于糖尿病周圍神經病變的治療[1]。近年發現硫辛酸可作為心血管疾病,脂質異常的治療藥物選擇[2]。在動物實驗中其對組織的保護作用很大程度上歸因于它的抗氧化性,然而,硫辛酸在組織損傷和保護信號轉導過程中亦具有獨特的調節作用,這些信號通路的作用在硫辛酸誘導的腦缺血再灌注損傷的保護尚不清楚。本研究旨在探討硫辛酸是否具有保護大鼠腦缺血再灌注損傷的作用及其可能的機制。
1 材料與方法
1.1材料
1.1.1動物與分組:清潔級健康雄性SD大鼠 54只,體質量230~320 g,由鄭州大學動物中心提供。隨機分為假手術組、腦缺血再灌注組(對照組)、腦缺血再灌注+硫辛酸干預組(治療組),每組18只。
1.1.2主要儀器及試劑:RT-PCR圖像分析系統(大連Jim-X Scientific D140);PCR Gene Amp system(美國 Applied Biosystems 2700);電泳儀(北京市六一儀器廠 DYY-6C);圖像采集系統(德國Lecia 顯微照相系統);硫辛酸(亞寶藥業太原制藥有限公司,國藥準字號H20055869);TUNEL試劑盒(羅氏ZK-8005),PCR試劑盒(EasyTaq DNA Polymerase,北京全式金生物技術有限公司AP111-12),2.3.5-氯化三苯基四氮唑(TTC 鼎國生物科技公司),Rt試劑盒(Easy Script First-Strand cDNA Synthesis Super Mix,北京全式金生物技術有限公司AE301-02)。
1.2方法
1.2.1動物模型制作及處理:采用改良zea-Longa線栓法制作大鼠左側大腦中動脈局灶缺血模型。大腦中動脈局灶性缺血2 h后將線栓抽至頸外動脈處并固定再灌注24 h,成功完成缺血再灌注模型制作。假手術組只分離頸總動脈、頸內動脈-頸外動脈和迷走神經不結扎不插線栓。于缺血2 h后應用5分法進行神經功能評分。0分:無神經功能缺損;1分:提起尾部對側軀干或前肢彎曲,或者在垂直懸掛時不能延伸前爪;2分:爬行盤旋到對側,但休息時姿勢正常;3分:喪失正確的反射;4分:沒有自發的運動活動。1~3分為造模成功,0分、4分大鼠剔除。治療組于再灌注開始時給予硫辛酸20 mg/kg頸外靜脈注射;假手術組及對照組用相同劑量的溶媒替代。
1.2.2梗死體積檢測:腦缺血2 h再灌注24 h,各組隨機抽取6只大鼠采用過量水合氯醛深度麻醉實施安樂死。快速斷頭取腦,去除小腦,腦干等組織,冷生理鹽水清洗,-20 ℃冰箱冷凍20 min,額極后1 mm開始行冠狀切片,片厚2 mm,切片在含2% TTC PBS緩沖液中室溫下孕育1 h,然后轉移到4%多聚甲醛溶液中固定。同側半球腦損傷的面積和梗死的體積應用Adobe Photoshop軟件進行測量和計算。
1.2.3TNF-α表達的檢測:每組隨機抽取6只大鼠,于冰塊行快速斷頭取腦,液氮冷凍后保存于-80 ℃冰箱中備用,采用RT-PCR法檢測大鼠病變側腦組織TNF-α的表達。將大鼠缺血側腦組織常規研磨提取總RNA。TNF-α大小為:1 315 bp,上游引物為:5' CCACGCTCTTCTGTCTACTG 3',下游引物為:5' AGCCTGGTCACCAAATCA 3',內參照β-actin大小為:568 bp,上游引物為:CCCATCTATGAGGGTTAC,下游引物為:GGAAGGTGGACAGTGAG。嚴格按照北京全式金生物技術有限公司RT-PCR和TRIZOL試劑盒說明書提供方法進行標準檢測。擴增條件:94 ℃預變性2 min,1個循環;94 ℃變性30 s,反應35個循環;59 ℃退火35 s,72 ℃延伸2 min,共30個循環;72 ℃總延伸10 min。最后進行電泳測定,在紫外線投射儀下對跑好的電泳條帶進行觀察并照相,用圖像記錄儀和分析系統對所得條帶進行光密度(OD)掃描分析,TNF-α的水平用TNF-α和DNAβ-actin的DNA條帶灰度值比值來表示。
1.2.4凋亡細胞數的檢測:每組隨機抽取6只大鼠,4%多聚甲醛灌注定形后,冰塊上快速斷頭取腦,取病變側視交叉后2~4 mm腦組織固定,石蠟包埋、冠狀切片,制成厚2 μm的連續切片。嚴格依照TUNEL法凋亡檢測試劑盒操作步驟進行操作,胞核染成棕褐色即為陽性細胞。每只大鼠隨機選擇梗死周圍不連續切片5張,每張切片隨機選擇皮層5個不同的視野在400×鏡下進行觀察并計數、照相,隨后求其平均數。
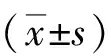
2 結果
2.1各組大鼠腦組織梗死體積的比較見表1與圖1。與假手術組相比 對照組和治療組大鼠腦組織梗死體積明顯擴大(P<0.05)。與對照組相比,治療組大鼠腦組織梗死體積明顯縮小,差異具有統計學意義(P<0.05)。
2.2各組大鼠腦組織TNF-α表達的比較見表1與圖2。與假手術組相比 對照組和治療組大鼠腦組織TNF-α的表達明顯升高(P<0.05)。與對照組相比,治療組大鼠腦組織TNF-α的表達明顯下降,差異具有統計學意義(P<0.05)。
2.3各組大鼠腦組織凋亡細胞數的比較見表1與圖3。與假手術組相比 對照組和治療組凋亡細胞數均明顯增加(均P<0.05)。與對照組相比,治療組大鼠腦組織凋亡細胞數均明顯減少,差異具有統計學意義(P<0.05)。

表1 各組大鼠腦組織梗死體積、TNF-α表達及凋亡細胞數的比較
注:與假手術組比較,*P<0.05;與對照組比較,△P<0.05

1.假手術組;2.缺血再灌注組;3.治療組圖1 各組梗死體積的比較 圖2 TNF-α mRN的表達

圖3 各組腦組織Tunel陽性凋亡細胞數(×400) A:假手術組;B:缺血再灌注組;C:治療組
3 討論
硫辛酸 (LA)是一種存在于西蘭花、菠菜和西紅柿等食物中的硫醇類抗氧化劑。硫辛酸被視為線粒體α-酮酸脫氫酶復合體的補充,因此其在代謝中起著基礎性作用[3]。硫辛酸及其還原型形式二氫硫辛酸(DHLA)由于具有較低的氧化還原電位被認為是理想的抗氧化劑,他們不但可以直接清除活性氧而且可以使內源性抗氧化劑谷胱甘肽、維生素E和維生素C再生。硫辛酸也有多樣的分布形式,具有水溶性和脂溶性的特征,廣泛分布于細胞膜、胞質和胞外空間。由于其具有安全,強大的抗氧化作用的性質,硫辛酸被廣泛應用于糖尿病性周圍神經病變的治療并表現出良好的效果。由于其抗氧化特性,硫辛酸在氧化損傷治療中具有潛在的意義[4]。然而,硫辛酸的有益作用似乎只是部分來源于它的抗氧化特性。最近有體外研究顯示硫辛酸可減輕心肌缺血再灌注損傷,在心臟缺血再灌注動物實驗中,硫辛酸預處理可以減少梗死面積,抑制細胞凋亡,更重要的是可以部分保存缺血再灌注衰竭心臟功能[5]。
腦缺血/再灌注損傷的病理和生理機制現在被認為與損傷級聯相關,包括幾種亞機制,如興奮性氨基酸毒性,炎癥,由氧化應激引起的脂質過氧化物反應和凋亡,這些過程之間的關系是相互影響的[6]。中樞神經系統受損后,神經遞質可激活交感神經系統和下丘腦-垂體-腎上腺軸,這激活了對全身損傷的應激反應,釋放炎癥介質和趨化因子以加速炎癥。黏附分子的釋放產生炎癥介質,導致局部缺血后繼發性腦損傷。越來越多的研究表明,腦缺血/再灌注損傷的主要原因是炎癥,其可以被認為是初次缺血后的繼發性損傷[7]。各種細胞的激活和聚集在接收和傳遞炎癥信號中起著不可或缺的作用。內源性介質(細胞因子和趨化因子)和循環中的白細胞均參與炎癥反應。細胞因子在吸引白細胞作為趨化因子的有效誘導劑時發揮關鍵作用。因此,在炎癥狀態下細胞因子作為主要介質,趨化因子作為輔助介質吸引白細胞。此外,活化的星形膠質細胞和小膠質細胞產生細胞因子和趨化因子。這些分子似乎負責炎癥細胞在損傷的腦組織中的聚集。TNF-α,IL-1β和IL-6是潛在的細胞因子,其引發炎癥介質和炎癥反應并誘導缺血再灌注損傷后其他細胞因子的表達[8]。通過對缺血側腦組織TNF-α、IL-6和IL-1β水平升高的觀察,被認為是缺血和再灌注損傷中組織損傷反應的一部分。因此,缺血性損傷后抑制炎癥可能是治療缺血性卒中的新策略。目前的研究結果表明,硫辛酸預處理可大大降低缺血側腦組織TNF-α生產和中性粒細胞聚集,這是缺血再灌注后炎癥反應的兩個關鍵要素。因此,我們假設硫辛酸抑制缺血再灌注引起的炎癥反應,從而有助于防止缺血再灌注損傷。在本研究中,我們的研究結果表明,硫辛酸通過降低TNF-α水平發揮抗炎作用,從而具有神經保護作用。
已有證據表明,凋亡對局灶性腦缺血后缺血半暗帶的神經元死亡起關鍵作用[9-11],神經元是否以凋亡或壞死的形式存在取決于損傷的嚴重程度。眾所周知,凋亡可以由氧化應激和線粒體功能障礙等因素觸發。Caspase-3激活被認為是多重凋亡級聯的最后一步和共同途徑。腦缺血可能會增加其中一些觸發因素,從而導致凋亡增加[12-13]。許多研究已經證明使用TUNEL測定法檢測凋亡神經元的存在已被作為各種組織中缺氧或缺血性神經元死亡的指征。本研究中,我們檢測到對照組大鼠缺血2 h再灌注24 h后TUNEL陽性細胞數量的增加。重要的是,硫辛酸治療組TUNEL陽性細胞數量明顯減少,此表明硫辛酸對凋亡存在抑制作用。
總之,硫辛酸對大鼠腦缺血再灌注具有保護作用,其可能機制為減輕炎癥反應及抑制凋亡。
[1]KALOGERIS T,BAINES C P,KRENZ M,et al.Cell Biology of Ischemia/Reperfusion Injury[J].Int Rev cell Mol Biol,2012,298:229-317.
[2]RICHARD M J,CONNELL B J,KHAN B V,et al.Cellular mechanisms by which lipoic acid confers protection during the early stages of cerebral ischemia:a possible role for calcium[J].Neurosci Res,2011,69(4):299-307.
[3]GHIBU S,RICHARD C,VERGELY C,et al.Antioxi-dant properties of an endogenous thiol:Alpha-lipoic acid,useful in the prevention of cardiovascular diseases[J].J Cardiovasc Pharmacol,2009,54(5):391-398.
[4]GOMES M B,NEGRATO C A.Alpha-lipoic acid as a pleiotro-pic compound with potential therapeutic use in diabetes and other chronic diseases[J].Diabetol Metab Syndr,2014,6(1):80-97.
[5]DENG C,SUN Z,TONG G,et al.α-Lipoic Acid Reduces Infarct Size and Preserves Cardiac Function in Rat Myocardial Ischemia/Reperfusion Injury through Activation of PI3K/Akt/Nrf2 Pathway[J].PLoS One,2013,8(3):e58371.
[6]LEWERENZ J,MAHER P.Chronic glutamate toxicity in neurodegenerative diseases—what is the evidence? [J].Front Neurosci,2015,9(12):469.
[7]XU D S,MIN H M,BAO C F,et al.Effect of procyanidins on TNF-α and HSP70 in cerebral tissue of rats with focal cerebral ischemia injury [J].Zhongfeng yu Shenj-ing Jibing Zazhi,2016,33(8):699-702.
[8]YASUDA Y,SHIMODA T,UNO K,et al.Temporal and sequential changes of glial cells and cytokine expression during neuronal degeneration after transient global ischemia in rats[J].J Neuroinflammation,2011,8(6):70-80.
[9]YUAN J.Neuroprotective strategies targeting apoptotic and necrotic cell death for stroke[J].Apoptosis,2009,14(4):469-477.
[10]MIZUMA A,YENARI M A.Anti-Inflammatory Tar-gets for the Treatment of Reperfusion Injury in Stroke[J].Frontiers in Neurology,2017,8(8):467.
[11]UYAR I S,AKPINAR M B,SAHIN V,et al.Alpha lipoic acid attenuates inflammatory response during extracorporeal circulation[J].Cardiovascular Journal of Africa,2013,24(8):322-326.
[12]NIIZUMA K,YOSHIOKA H,CHEN H,et al.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia.[J].Biochim Biophys Acta,2010,1 802(1):92-99.
[13]TANAKA H,YOKOTA H,JOVER T,et al.Ischemic preconditioning:neuronal survival in the face of caspase-3 activation[J].Neurosci,2004,24(11):2 750-2 759.

