DFT泛函在自由環合反應的選擇性方面的可靠性研究
尹 龍,劉 鯤
1 簡介
自由基由于具有高活性、高選擇性和反應條件溫和并且對反應物質的功能團沒有影響等特點,受到化學研究者廣泛的關注。它們有廣泛的應用,特別是在有機合成領域中[1]。并且在近年來也逐步應用到一些天然產物的合成中。現今,自由基反應被認為是合成雜環化合物的有效手段。在各類雜原子自由基中,以氮為中心的自由基反應在有機合成領域有著越來越重要的作用[2-3]。它的優點在于能夠在環化過程中引入氮原子,可以用于有機轉化反應,由于其高反應活性和富電子性可以在碳碳不飽和鍵上加成從而直接形成C-N鍵,為含氮雜環化合物例如β-內酰胺類抗生素和環狀胺的生成提供了方法和策略。這些含氮的分子不僅引起了學術界的廣泛興趣,而且在工業方面也占有突出的地位。在氧化作用中能夠直接引入N-H酰胺與過渡態物質作用,使得這種合成方式更具有應用價值。
我們試圖找到一種合適的DFT泛函去解決自由基環化反應問題。該課題選取了對計算精度比較敏感有代表性的伯氮自由基(見圖1)為研究對象,通過控制R基的不同來控制反應的選擇性,并以文獻中的實驗數據為參考,系統地評價DFT泛函的可靠性。
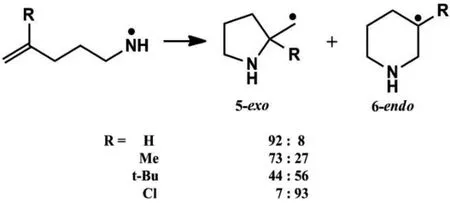
圖1 伯氨氮自由基環化反應方程式
2 計算細節
本研究的氮自由基環化反應所涉及的各個反應物以及產物相應的過渡態的結構都是在6-31+g*分裂基組水平上,運用過渡態理論,運用一系列的DFT泛函來完成的。依據實驗合成將溫度定為80 ℃來計算某一產物的產率比值,并且和實驗數據相比較。所有的幾何結構優化都是應用Berny分析梯度法來完成的。一旦達到收斂,緊著就在該點上進行諧波頻率分析來檢驗達到的結構是一個最小值(鞍點)還是一階鞍點(駐點)。
為了確定合適的基組,我們選用計算上一步準確度較高的Cam-B3lyp,PBE0和BhandHlyp 3種泛函,研究DFT泛函在不同基組下的計算精度和振動分析的時間。為了研究在苯溶劑下對產率的影響,所有的幾何結構都是在大量溶劑存在下同等機組水平上采用連續介質模型進行重優化的。并分別加以不同的關鍵字SMD和PCM來研究了溶劑化作用對計算結果的影響。所有的計算均采用G09完成[4-6]。
在前面的論文中,我們已經系統地報道了這些環化反應的細節。但是為了評估目前使用的密度泛函DFT對于描述環化反應的情況,我們計算了在溫度80 ℃時產率5-exo產物和6-endo產物的產率。并與實驗數據相比較。
通過假定氮自由基的反應是動力學控制的,其發生環化反應時的區域選擇性可以用過渡態理論來處理。根據Eyring公式(公式2),產物的產率比值P[%]可以用活化自由能(ΔG≠) 計算得到公式1。
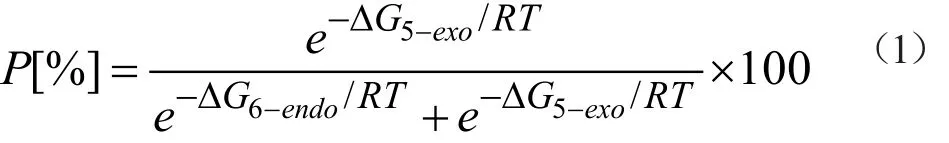
公式1中P[%]指的是5-exo產物的產率比值,R是理想氣體常數(R=8.314 J·K-1·mol-1, T是反應溫度(T=353.15 K)。
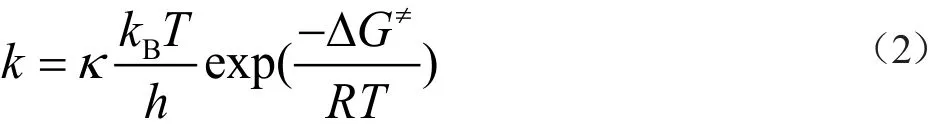
k代表反應的常數,公式2中所有涉及過渡態的物理量都用上角標“≠”標注,h是普朗克常量(h=6.626×10-34 J·s),к是傳輸系數。
3 結果討論
在我們之前的研究中,該環化反應在B3LYP/6-31g*水平上在實驗與理論上已經被研究過,之前獲得的實驗數據作為參考,氮含有孤對電子碳碳雙鍵,是富電子的,從學術上來講,該反應可認為是發生了碳碳雙鍵上的親電加成從而形成含氮的自由基,并且通過比較5-exo產物和6-endo產物的軌道能量和反應能壘,發現該自由基發生環合反應的時候是C=C的π軌道提供電子,流向氮自由基的單占的pN軌道,從而引發了C=C雙鍵的斷裂和C-N鍵的生成。這樣,氮自由基上的電子密度越小越有利于反應的發生,C=C的π軌道上電子能量愈高,愈有利于這一過程進行。
在計算過程中穩定的中間結構,即船式構象和椅式構象,都在Cam-B3lyp/6-31+g*水平上優化,并比較各個結構下的反應活化能以及5-exo產物的產率比(見表1)。在整個的計算過程中,椅式構象作為過渡態的初始結構進行優化。
實驗中計算了不同取代基取代的時候該自由基發生環化反應在353.15 K時,5-exo產物的產率比值(見表1)并與實驗數據相比較,來評價各DFT泛函的可靠性。

表1 DFT泛函的計算結果(5-exo和6-endo產物的比值)
從表1數據可以發現,當取代基R=Ph和Cl的時候,5-exo和6-endo的產物比值分別為<1和7,此時的反應具有較好的選擇性。各DFT泛函的計算結果跟實驗參考值幾乎一樣,即對于選擇性較好的反應而言,各個系列的DFT泛函無論是pure還是雜化泛函等,對于該類反應都能給出合理的描述并且可以取得較好的定性結果,這與我們的預期是相一致的。因此可以說,如果對某類自由基反應的定量描述要求不十分嚴格,那么幾乎所有的DFT泛函都是可以勝任的。
下面我們將重點討論,對于定量描述要求較高,反應選擇性差并且非常敏感的體系,如:當取代基R=H,Me,iPr,nBu和tBu時,這才是對DFT方法可靠性的真正挑戰。
由表1數據可知,當R為上述取代基的時候,5-exo和6-endo產物的比值相差不大,即反應不具有較好的化學選擇性,由前面提到的自由反應的特點和DFT泛函本身的缺點可知,這類反應是對DFT泛函計算準確度的最大考驗,也是我們做這項研究的目的所在。計算結果表明,現階段的DFT泛函是足以應對這個挑戰的,GGA系列泛函中的BP86和Meta-GGA系列中的M06的計算結果總體相差不大,而metahybrid一類泛函相比較而言則是誤差最大的一類,Hybrid一類泛函是最為準確的,尤其是cam-b3lyp,BhandHlyp 和PBE0泛函。
4 結語
(1)大多數的DFT泛函能夠與實驗數據保持一致,尤其是Cam-B3lyp,BhandHlyp和PBE0泛函。然而,計算化學中最為常用的B3lyp泛函與上述3種泛函相比,則計算精度較差。通過比較B3lyp和Cam-B3lyp兩種泛函的數據可知,長程力矯正可以有效地提高計算準確度。
(2)極化和彌散波函數對于計算氮自由基環合反應是必須的,即2-ζ劈裂基組(6-31+g*)對于包含C,H,O,N的自由基體系是足夠的。
(3)對于不包含離子的自由基體系,在計算過程中無需考慮溶劑化作用。
因此,對于具有區域選擇性的自由基環合反應體系,我們強烈推薦Cam-B3lyp泛函6-31+g*基組。
[參考文獻]
[1] MCCARROLL A J,WALTON J C.Programming organic molecules: design and management of organic syntheses through free-radical cascade processes[J].Cheminform,2001,40(12):2224-2228.
[2] BAR G,PARSONS A F.Stereoselective radical reactions[J].Tetrahedron Asymmetry,2003,32(5):251-263.
[3] LIU L Q,CHEN Y D,WU C Z,et al.8-endo versus 7-exo cyclization of alpha-carbamoyl radicals. a combination of experimental and theoretical studies[J].Journal of Organic Chemistry,2005,70(5):1539-1544.
[4] GIESE B.Radicals in organic synthesis: formation of carbon -carbon bonds[M].Oxford:Pergamon Press,1986.
[5] CURRAN D P,RAKIEWICZ D M.Radical-initiated polyolefinic cyclizations in linear triquinane synthesis. model studies and total synthesis of (±)-hirsutene[J].Tetrahedron,1985,41(19):3943-3958.
[6] GUINDON Y,PRéVOST M,MOCHIRIAN P,et al.Synthesis of 2,3-anti-3,4-anti and 2,3-anti-3,4-syn propionate motifs: a diastereoselective tandem sequence of Mukaiyama and freeradical-based hydrogen[J].Cheminoform,2002,4(6):1019-1022.

