TET1在肝癌組織中的表達及對HepG2細胞生物學行為的影響
王傳旭,劉傳亮,史光軍
(1濰坊醫學院,山東濰坊 261053;2青島大學醫學院;3青島市立醫院)
肝癌是世界范圍內第五大最常見惡性腫瘤,也是癌癥相關性死亡的第二大原因,并且其發病率持續升高。雖然在過去十幾年中,其治療水平有相當大提高,但是肝癌患者的總生存期卻沒有明顯提高[1]。因此,探究肝癌發生發展的分子基礎,尋找建立有效的監控和治療靶點是現今最重要的研究方向。腫瘤生長和癌癥侵襲普遍受表觀遺傳學方式的調控,包括DNA甲基化、組蛋白修飾、非編碼RNA以及染色體結構改變。異常的DNA甲基化被證實參與腫瘤的發生發展以及化療藥物的抵抗[2]。TET家族是一種甲基胞嘧啶加雙氧酶,其中包含TET1、TET2、TET3。TETs可以催化DNA的脫甲基化,主要通過催化5-甲基胞嘧啶(5-mC)轉變成5-羥甲基胞嘧啶(5-hmC)。其中,在癌癥進展中TET1是最主要和研究最多的[3]。有研究發現,TET1促進基因重排相關的惡性腫瘤發生,如MLL型白血病[4];在胃癌、肺癌中則發揮抑制腫瘤的作用[5]。2017年6月~2018年2月,本研究探討了TET1在肝癌中的表達變化以及在肝癌發病過程中發揮的生物學作用。
1 材料與方法
1.1 材料 組織:肝癌組織及癌旁組織(距離癌組織2 cm)標本切片38例份由濰坊醫學院病理科提供。其中,患者男33例、女5例,年齡44~59歲、平均49.2歲,術前均未行放化療及靶向藥物治療。細胞:人肝癌HepG2細胞株由青島市立醫院肝膽胰細胞實驗室惠贈;試劑及儀器:DMEM培養基、胎牛血清、胰酶、PBS購自Gibico公司;TET1抗體、GAPDH抗體、HRP二抗購自Sigma公司;SDS-凝膠配制試劑盒、RIPA裂解液、蛋白酶抑制劑和PVDF膜購自上海碧云天生物技術有限公司;CCK-8試劑盒購自日本DoJINDO公司;TET1過表達質粒和過表達空載質粒購自南通思特康生物科技有限公司。
1.2 肝癌組織及癌旁組織中TET1蛋白表達的檢測 ①采用免疫組化SP法。組織脫蠟后遞減濃度乙醇復水,PBS洗片,30%過氧化氫溶液孵片10 min,蒸餾水洗3次,然后進行抗原修復,PBS洗片,羊血清室溫封閉30 min,TET1抗體(1∶2 000稀釋)4 ℃孵育過夜。PBS洗片后加入二抗,20 ℃、20 min,PBS洗片,DAB顯色,蘇木精復燃,脫水,中性樹膠封片,鏡檢。TET1蛋白在組織中主要表達在細胞核中,呈棕黃色顆粒。使用Remmele等提出的免疫反應積分評分法對染色后的切片進行評分。根據陽性細胞數和著色深度計分,每例隨機觀察計數5個高倍視野(×400),計算每個視野的陽性率,取平均數,并按下列計分:陽性細胞≤5%為0分,>5%~25%為1分,>25%~50%為2分,>50%~75%為3分,>75%為4分。著色深度:陰性結果0分,淡黃色染色1分,淡棕色染色2分,棕色染色3分。取兩者乘積作為總分進行分析,≥1為陽性,<1為陰性。②采用蛋白質印跡法:取低溫保存的肝癌及癌旁組織30 mg,用含有蛋白酶抑制劑的裂解液提取總蛋白,BCA法測蛋白濃度。取等量蛋白樣品(40 μg)進行電泳,并轉移至PVDF膜上。用含有5%脫脂奶粉室溫封閉2 h,棄去封閉液,分別加入用5% BSA的PBS稀釋的一抗(TET1 1∶200;β-actin 1∶2 000),4 ℃搖床過夜。一抗孵育結束后,TBST洗滌,用HRP標記的山羊抗鼠IgG(1∶2 000)室溫孵2 h,TBST充分洗滌后,電化學發光顯影。采用Image-Pro Plus 6.0軟件分析條帶灰度值,將TET1條帶與作為內參的β-actin條帶灰度值的比值作為蛋白相對表達量。
1.3 肝癌及癌旁組織中TET1 mRNA表達的檢測 采用RT-PCR法。取低溫保存的肝癌及癌旁組織100 mg置于1.5 mL的去RNA酶EP管中,加入檢測TRIzol 1 mL。按照TRIzol試劑盒的說明書提取總RNA,用紫外分光光度儀對提取的總RNA計算純度和濃度后,將提取的RNA按照逆轉錄試劑盒(日本TAKARA公司)的說明書進行逆轉錄處理,反應體系為:總RNA 400 ng、 PrimeScript RT Master Mix 2 μL及RNase Free dH2O共10 μL,37 ℃、15 min,85 ℃、5 s;PCR引物由北京賽百勝基因技術有限公司合成,以GAPDH為內參照,定量PCR擴增在羅氏定量PCR儀上進行。反應完成后計算機自動輸出cDNA模板的擴增曲線及循環閾值(Ct值),采用2-ΔΔCt法處理數據。TET1 mRNA的表達水平檢測均采用GAPDH作為內參基因,來校正被測樣品中mRNA水平,用TET1 mRNA與各自的GAPDH的差值來表明樣本中目的基因mRNA的表達水平。
1.4 細胞培養與轉染 HepG2細胞系用DMEM培養基(含10%胎牛血清,1%青-鏈霉素)培養,于含5% CO2培養箱中37 ℃恒溫培養,1%胰酶消化傳代。轉染前接種于6孔板預先培養24 h,分別加入TET1基因過表達重組慢病毒顆粒和空載體對照慢病毒顆粒進行轉染,轉染5 h后更換完全培養液,24 h后換液,轉染后72 h開始添加2 μg/mL嘌呤毒素,通過梯度實驗篩選穩定轉染細胞,篩選1周。成功構建的TET1過表達(過表達組)及空載體HepG2細胞(對照組)凍存于液氮中,進行實驗時復蘇細胞后對TET1表達情況進行重新鑒定。
1.5 HepG2細胞增殖能力檢測 采用CCK-8法。取兩組細胞,以0.25%胰酶消化,分別制成1.5×104/mL的細胞懸液,接種于96孔板中,每組設6個復孔,每孔細胞懸液100 μL,鋪六孔板。培養0、24、48、72、96、120 h后,每孔加CCK-8溶液10 μL置于37 ℃、5% CO2的培養箱繼續培養2 h,用酶標儀測波長450 nm處各孔的OD值,每組去掉最大值和最小值,取平均值。
1.6 HepG2細胞遷移能力檢測 采用劃痕試驗。在六孔板底面預先繪制數條參考線,用于定位劃痕位置。將兩組細胞(5×105/孔)分別接種在6孔板,每組設3個平行孔,培養24 h后,使用200 μL槍頭進行劃痕處理,PBS洗滌2次,將細胞在無血清培養基中培養。使用裝有數碼相機(德國Zeiss公司)的倒置顯微鏡,觀察并拍攝0 h及24 h劃痕照片,使用Image Pro Plus6.0軟件讀取劃痕面積,平均相對遷移距離=0 h劃痕面積/高度-24 h劃痕面積/高度,劃痕愈合率=(0 h劃痕面積-24 h劃痕面積)/0 h劃痕面積×100%。實驗重復3次,取平均值。
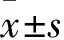
2 結果
2.1 肝癌組織及癌旁組織中TET1的表達比較 38例肝癌組織中TET1陽性表達9例(23.7%),癌旁組織中TET1陽性表達27例(71.1%),兩者TET1陽性表達率比較,χ2=17.100,P<0.01。肝癌組織和癌旁組織中TET1蛋白相對表達量分別為0.46±0.09、1.15±0.13,兩者比較,P<0.05。RT-PCR結果顯示,以TET1 mRNA在癌旁組織中表達量平均值為1,肝癌組織為0.43±0.07,兩者比較,P<0.05。
2.2 兩組增殖能力比較 培養0、24、48、72、96、120 h,過表達組OD值分別為0.212±0.004、0.228±0.005、0.301±0.007、0.393±0.006、0.432±0.007、0.582±0.012;對照組分別為0.211±0.002、0.246±0.003、0.347±0.006、0.541±0.008、0.685±0.007、0.897±0.009。在培養24、48、72、96、120 h時過表達組的OD值均低于對照組(P均<0.05)。
2.3 兩組遷移能力比較 過表達組相對遷移距離為(0.47±0.007)μm,劃痕愈合率為(14.38±1.67)%;對照組相對遷移距離為(0.94±0.08)μm,劃痕愈合率為(28.15±2.61)%。與對照組比較,過表達組的相對遷移距離短和劃痕愈合率低(P均<0.05)。
3 討論
越來越多的證據顯示,DNA甲基化狀態的異常與腫瘤的進展和癌癥患者的預后有密切關系。已有研究證實,DNA甲基化廣泛參與肝癌的發病過程[6]。胞嘧啶甲基化會導致腫瘤抑制基因的沉默從而導致癌癥形成。而DNA脫甲基化酶又會抵消這種致癌基因的作用。TET家族蛋白可以通過催化DNA的5-mC轉化成5-hmC而促進DNA的脫甲基化[7]。根據一個對887例腺癌的Meta分析得出TET1 mRNA水平在腫瘤的第一階段會下調[8]。另外,有研究證實TET1蛋白在前列腺癌和乳腺癌組織中的表達也會下調[9],因此在本研究中,我們首先通過免疫組化法、蛋白質印跡法和實時定量PCR檢驗了肝癌組織和癌旁正常組織中TET1蛋白及mRNA表達的差異,結果顯示TET1在肝癌組織中的表達降低,說明TET1可能參與了抑制肝癌的發生。
細胞侵襲是原發腫瘤生長和轉移啟動的關鍵步驟,因此腫瘤細胞的增殖及遷移能力直接代表了癌癥的惡性程度。已有研究顯示,TET1在胃癌、卵巢癌和乳腺癌發揮抑制腫瘤生長和侵襲的作用[7]。因此,我們采用構建過表達質粒并轉染人肝癌細胞中,驗證TET1的過表達對肝癌細胞的增殖和遷移能力的影響,結果提示TET1過表達可抑制肝癌細胞的惡性生物學行為。
金屬蛋白酶組織抑制劑(TIMPs)是一種基質金屬蛋白酶(MMP)家族蛋白及其內生性的調控因子,它在細胞侵襲和上皮間質轉化過程中發揮重要的調控作用[10,11]。例如,MMP2和MMP9會通過損壞細胞基底膜和降解Ⅳ型膠原蛋白和層黏連蛋白而促進細胞侵襲。雖然機制不清,但TIMP蛋白可通過結合MMPs的活性位點或降低MMPs活酶而抑制MMPs的活性[12]。TIMP基因已被證實受DNA甲基化的調控,且已有研究證實在某些腫瘤細胞中,TIMP正是TET1發揮抑制腫瘤作用的下游調控因子[13]。因此,TIMPs可以作為我們進一步研究TET1抑制肝癌發生發展的相關信號通路的一個較好目標。
綜上所述,TET1蛋白在肝癌組織中的表達發生了下調,并且其基因的過表達會抑制肝癌細胞的增殖活性和遷移能力。說明TET1密切參與肝癌的發生發展過程中,因此,TET1可作為治療肝癌的一個靶向基因。
參考文獻:
[1] Trinchet JC. Hepatocellular carcinoma in 2014: current situation and future prospects[J]. Diagn Interv Imaging, 2014,95(7-8):705-708.
[2] Kelly AD, Issa JJ. The promise of epigenetic therapy: reprogramming the cancer epigenome[J]. Curr Opin Genet Dev, 2017,42:68-77.
[3] Ito S, Shen L, Dai Q, et al. Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine[J]. Science, 2011,333(6047):1300-1303.
[4] Huang H, Jiang X, Li Z, et al. TET1 plays an essential oncogenic role in MLL-rearranged leukemia[J]. Proc Natl Acad Sci U S A, 2013,110(29):11994-11999.
[5] Pei YF, Tao R, Li JF, et al. TET1 inhibits gastric cancer growth and metastasis by PTEN demethylation and re-expression[J]. Oncotarget, 2016,7(21):31322-31335.
[6] Tian YP, Zhu YM, Sun XH, et al. Multiple functions of ten-eleven translocation 1 during tumorigenesis[J]. Chin Med J (Engl), 2016,129(14):1744-1751.
[7] Hsu CH, Peng KL, Kang ML, et al. TET1 suppresses cancer invasion by activating the tissue inhibitors of metalloproteinases[J]. Cell Rep, 2012,2(3):568-579.
[8] Yang H, Liu Y, Bai F, et al. Tumor development is associated with decrease of TET gene expression and 5-methylcytosine hydroxylation[J]. Oncogene, 2013,32(5):663-669.
[9] Neri F, Dettori D, Incarnato D, et al. TET1 is a tumour suppressor that inhibits colon cancer growth by derepressing inhibitors of the WNT pathway[J]. Oncogene, 2015,34(32):4168-4176.
[10] Bourboulia D, Stetler-Stevenson WG. Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs): positive and negative regulators in tumor cell adhesion[J]. Semin Cancer Biol, 2010,20(3):161-168.
[11] Friedl P, Alexander S. Cancer invasion and the microenvironment: plasticity and reciprocity[J]. Cell, 2011,147(5):992-1009.
[12] Zeng ZS, Cohen AM, Guillem JG. Loss of basement membrane type Ⅳ collagen is associated with increased expression of metalloproteinases 2 and 9 (MMP-2 and MMP-9) during human colorectal tumorigenesis[J]. Carcinogenesis, 1999,20(5):749-755.
[13] Chernov AV, Sounni NE, Remacle AG, et al. Epigenetic control of the invasion-promoting MT1-MMP/MMP-2/TIMP-2 axis in cancer cells[J]. J Biol Chem, 2009,284(19):12727-12734.

