UBE2C對肺癌PC9細胞增殖及遷移能力的影響
武艷,周寧,郭紀偉,楊麗娟,代娟娟,陳微微
(濱州醫學院附屬醫院,山東濱州256600)
泛素結合酶E2C(UBE2C)又稱為UbcH10或dJ447F3.2,屬于E2家族成員,其基因位于染色體20q12.13,在人類中UBE2C有6種同源異構體,最常見的同源異構體含197個氨基酸,相對分子質量為19 652 Da,在不同種屬之間高度同源[1]。細胞周期后期促進復合物(APC/C)是目前惟一被發現可以介導UBE2C向靶蛋白傳遞泛素分子的E3酶,通過泛素化促進細胞周期蛋白A、細胞周期蛋白B、p21等細胞周期相關蛋白的降解,從而促進細胞周期M期的進程。UBE2C通過中和USP44的去泛素化作用,并促進APC/C上紡錘體檢查點組分的解離,參與細胞周期紡錘體裝配檢查點的調控,因此,UBE2C在細胞整倍體的維持中起重要作用。UBE2C在正常組織中表達較低,在肺癌、乳腺癌、卵巢癌、肝癌等多種腫瘤中表達水平較高。已有研究表明,UBE2C的過表達能夠促進細胞增殖,增強腫瘤細胞的遷移及侵襲能力。本課題組在2017年1~6月通過構建UBE2C的真核表達載體,并驗證其對人肺癌細胞系(PC9)增殖、遷移能力的影響,為進一步研究UBE2C在肺癌中的作用機制奠定基礎。
1 材料與方法
1.1 材料 PC9細胞系購于美國ATCC細胞庫;pcDNA3.1載體購于Gromega公司;胎牛血清、RPMI1640培養基、胰酶購自美國Gibco公司;Lipofectamine 2000購于Invitrogen公司;限制性內切酶Kpn I、Xba I和T4 DNA連接酶購自NEB公司;TRIzol試劑,PCR所需引物購于上海生物工程有限公司;逆轉錄試劑購于Thermo公司;PCR Mix,T-載體試劑盒購于Transgen公司;質粒提取試劑盒購于Axygen公司;Flag單克隆抗體購自Santa Cruz公司,Tubulin抗體、辣根過氧化物酶標記的羊抗兔IgG抗體購于Proteintech公司;CCK-8試劑購于碧云天公司。
1.2 真核表達載體pcDNA3.1-Flag-UBE2C的構建 根據Genbank提供的UBE2C基因信息,設計合成上下游引物,并在上游引物中引入Flag標簽的堿基序列和Kpn I 酶切位點,下游引物中引入Xba I酶切位點,上下游引物序列分別為: P1:5-′GGGTACCCCATGGATTACAAGGATGACGACGATAAGGCTTC-CCAAAACCGCGACCCAG-3′;P2:5-′GCTCTAGAGC-TTAATATCTAGGGCTCCTGGCTGGTGAC-3′。以PC9細胞的cDNA為模板,配制反應體系,通過PCR反應獲得UBE2C的全長DNA序列,反應條件:95 ℃ 5 min、95 ℃ 10 s、56 ℃ 30 s、72 ℃ 60 s,30個循環,72 ℃ 10 min,置于4 ℃備用。將PCR產物回收后,先與T-載體、反應緩沖液混合,25 ℃反應10 min,轉化入大腸桿菌DH5α中,涂到含有氨芐青霉素的LB平板中,培養過夜,挑取菌落,振蕩培養,提取T-UBE2C質粒,并通過Kpn I和Xba I進行酶切鑒定,并將鑒定為陽性的質粒送至上海生物工程有限公司進行序列測定,通過DNAMAN軟件對測序結果與UBE2C的CDS序列進行比對。將序列比對完全一致的T-Flag-UBE2C質粒、pcDNA3.1載體酶切后分別進行切膠回收,通過T4 DNA連接酶進行連接,轉化入DH5α中,涂到含有氨芐青霉素的LB平板中,37 ℃培養過夜,次日挑取菌落,振蕩培養,提取重組質粒,并進行酶切鑒定。結果成功擴增出UBE2C基因片段,產物大小為591 bp,將其成功連入T載體中,經酶切鑒定,并且重組T-載體中序列完全正確的UBE2C基因片段成功連入線性化的pcDNA3.1中,提示UBE2C的真核過表達載體已構建成功。將鑒定正確的重組質粒pcDNA3.1-Flag-UBE2C,通過Nanodrop測定濃度,置于-20 ℃備用。
1.3 分組及處理 將PC9細胞系分為重組質粒組(pcDNA3.1-Flag-UBE2C)和空質粒組(pcDNA3.1),將1.5 μg質粒與Lipofectamine 2000 4 μL混合后,加入培養基100 μL,室溫孵育25 min,加入到細胞生長密度為60%~80%的培養板中,繼續培養24~48 h,以便進行后續實驗。
1.4 細胞UBE2C mRNA的檢測 采用RT-PCR法。細胞轉染48 h后,收集細胞,TRIzol法提取細胞總RNA,將提取的RNA逆轉錄成cDNA,應用Transgen公司的2×EasyTaq PCR SuperMix進行PCR驗證,并進行3次重復實驗,通過Image J軟件分析灰度值,并以GAPDH作為內參,計算目的基因的表達量。PCR鑒定引物:UBE2C:上游引物: 5′-GGATTTCTGCCTTCCCTGAA-3′,下游引物:5′-GATAGCAGGGCGTGAGGAAC-3′, GAPDH 上游引物:5′-CTCCTCCTGTTCGACAGTCAGC-3′,下游引物:5′-CCCAATACGACCAAATCCGTT-3′。
1.5 細胞UBE2C蛋白的檢測 采用Western blotting法。轉染48 h后,收集細胞沉淀,NP-40裂解液裂解細胞,BCA法測定蛋白濃度。取蛋白上樣30 μg,進行SDS-PAGE電泳;轉膜,封閉后分別孵育抗-UBE2C(1∶1 000)、抗-Tubulin(1∶1 000)抗體過夜,次日孵育HRP標記的羊抗兔IgG抗體(1∶1 000),加入ECL顯色底物,應用成像系統進行成像拍照,實驗重復3次,以目的蛋白灰度值比內參蛋白灰度值作為目的蛋白相對表達量。
1.6 細胞增殖能力的檢測 采用CCK-8法。將細胞以5×103/孔接種于96孔板,培養過夜后進行轉染,每組設置3個平行孔,每過12 h加入CCK-8繼續培養3 h,采用酶標儀測定各孔在450 nm波長處的吸光度值,共測定至60 h,繪制不同組隨時間變化的增殖曲線。
1.7 細胞遷移能力的檢測 采用細胞劃痕試驗。細胞轉染48 h后,用200 μL槍頭進行劃痕,PBS洗滌后,加入新鮮無血清培養基后繼續培養,分別在0、24、48 h進行拍照。分別進行3次重復試驗,應用Image J軟件對劃痕距離進行統計分析。
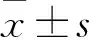
2 結果
2.1 UBE2C在PC9細胞中的表達 細胞轉染48 h后,空質粒組、重組質粒組UBE2C的mRNA相對表達量分別為0.679±0.024、2.349±0.154,二者比較,P<0.01;UBE2C蛋白相對表達量分別為0.581±0.018、2.284±0.017,二者比較,P<0.01。
2.2 過表達UBE2C對PC9細胞增殖、遷移能力的影響 細胞轉染60 h后,空質粒組、重組質粒組的OD450值分別為1.201±0.123、1.627±0.01,重組質粒組的增殖能力高于空質粒組(P<0.05);重組質粒組和空質粒組在劃痕后培養24 h時的傷口愈合率分別為46.322%±3.388%、29.576%±3.229%,48 h的愈合率分別為76.995%±3.338%、38.362%±3.358%,重組質粒組遷移能力高于空質粒組(P<0.01)。
3 討論
肺癌是世界范圍內最普遍的惡性腫瘤。據統計,在2012年新增病例180萬,死亡病例160萬[2,3]。在中國,肺癌是最常見癌癥,被確診時患者多處于肺癌晚期,已經失去了手術治療機會。近年來,由于診斷方法、外科技術的提高,很大程度上延長了患者的壽命,但是由于缺少有效的靶向治療,五年內多數患者均會出現復發的現象,因此尋求有效、特異性治療非小細胞肺癌的靶點至關重要。
UBE2C已被證明是腫瘤發展中的重要功能性基因之一。其表達水平與腫瘤的惡性程度及病理分級密切相關。有研究表明,降低UBE2C的表達水平后,腫瘤細胞的增殖和克隆形成能力明顯被抑制,腫瘤細胞的衰老加速[4,5]。在乳腺癌細胞中,降低UBE2C表達能明顯增強表柔比星耐藥細胞對表柔比星的敏感性[6]。有研究者檢測了結直腸癌患者中UBE2C的表達,結果顯示,腫瘤組織中UBE2C的mRNA及蛋白表達均明顯高于正常組織,并且其表達水平與患者對化療或靶向藥物的臨床反應密切相關,是潛在的生物標志物[7]。有文獻報道,在神經膠質瘤中,下調UBE2C的表達能夠通過抑制PI3K-Akt-mTOR信號通路,促進細胞自噬,進而降低細胞的生存能力[8];但是UBE2C在肺癌發生發展中的功能知之甚少,其作用機制還需進一步深入探討。我們前期研究發現,UBE2C在肺癌組織中過表達;RNA干擾實驗顯示,下調UBE2C的表達可以抑制肺癌細胞的惡性生物學行為。鑒于前期的研究成果,尚需通過過表達UBE2C進一步鑒定其在肺癌細胞中的功能及作用。因此,本研究通過PCR方法擴增獲得帶有Flag標簽的UBE2C基因全序列,限制性內切酶作用后將其克隆到真核細胞表達載體上,獲得能夠在真核細胞中表達的重組載體,為研究UBE2C的作用機制奠定基礎;并且通過該重組載體上調UBE2C的表達后,能顯著增加肺癌PC9細胞的增殖及遷移能力。本研究為進一步探討UBE2C基因在肺癌發生發展及遷移浸潤中的作用機制奠定了基礎。

