晨尿miRNA-21對急性心功能不全患者繼發急性腎損傷的預測價值
張寧,鄭金秀
(河北醫科大學第四醫院,石家莊050011)
伴隨著社會老齡化的加劇,急慢性心、腎疾病發病率逐年增加。急性腎損傷(AKI)是心血管疾病和心衰常見的進展和死亡的獨立危險因素[1]。心臟與腎臟疾病之間以雙向的、相互依賴的方式發生相互作用,進而導致的心腎功能急劇惡化,即心腎綜合征。目前研究發現,一些細胞因子及分子水平的變化可以較好地反映心腎綜合征的臨床進展及判定預后。microRNA-21(miRNA-21)在腎臟組織及尿液中穩定表達,廣泛參與細胞增殖、凋亡、免疫炎性反應、信號轉導等多種機體生物學過程的調控,并在心臟和腎臟疾病的發病中起著至關重要的作用[2, 3]。因此,本研究分析了miRNA-21對急性心功能不全患者繼發AKI的預測效果,旨在為早期發現急性心功能不全患者繼發AKI提供參考依據。
1 資料與方法
1.1 臨床資料 選取2014年1月~2016年12月我院收治的急性心功能不全患者80例,其中男37例、女43 例,年齡(68.1±13.4)歲。根據患者住院期間是否發生AKI,將入選的80例患者分成AKI組和non-AKI組,AKI組28例,男16例、女12例,年齡(68.3±12.1)歲;non-AKI組52例,男21例、女31例,年齡(67.9±14.2)歲,兩組患者年齡、性別差異無統計學意義(P均>0.05)。參照2010年歐洲心臟病學會修訂的心衰診斷標準[4]。AKI確診參照2012年《KDIGO急性腎損傷臨床實踐指南》,即48 h內血清肌酐水平升高≥0.3 mg/dL(26.5 μmol /L)或超過基礎值的1.5倍及以上且明確或經推斷上述情況發生在7 d之內,或持續6 h尿量<0.5 mL/( kg·h)。排除標準:年齡<18周歲、入院時已發生AKI、合并終末期腎病、惡性腫瘤、惡液質、自身免疫性疾病、病史資料不全及中途自動出院的患者。
1.2 資料采集 收集兩組患者的入院后并發癥、發病時有無低血壓及用藥情況,入院前的基礎腦鈉肽、血肌酐以及尿蛋白。低血壓診斷標準:收縮壓降至90 mmHg (1 mmHg=0.133 kPa)以下或收縮壓下降≥60 mmHg,且持續30 min以上[5]。
1.3 miRNA-21的檢測 采用qRT-PCR法。患者于入院后第2天清晨留取晨尿100 mL,離心30 min,棄上清液,將0.25 mL的尿沉渣裝在1.5 mL EP管中,常溫靜置5 min后,再放入-80 ℃冰箱冷凍待檢測。每個EP管加0.7 mL的Trizol,劇烈震蕩使其裂解,Trizol法提取總RNA,再將RNA轉錄為cDNA,構建miRNA-21反應體系,50 ℃ 2 min,95 ℃ 10 min,隨后95 ℃ 15 s,60 ℃ 1 min,共40個循環。以cel-miRNA-39為內參[6],定義ΔCt=目的基因Ct-內參基因Ct;ΔΔCt=待測樣本中目的基因ΔCt-參照樣本中目的基因ΔCt,相對樣本模板量RQ=2-ΔΔCt。
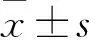
2 結果
2.1 兩組患者并發癥、藥物史及基礎情況比較 在并發癥方面,AKI組糖尿病19例,高血壓17例,慢性腎臟病15例,合并感染14例,發生低血壓15例;non-AKI組糖尿病20例,高血壓33例,慢性腎臟病21例,合并感染14例,發生低血壓11例,兩組患者糖尿病、感染、低血壓發生率存在明顯差異(P均<0.05)。藥物史方面,AKI組20例應用ACEI/ARB類藥物,4例應用過造影劑,13例應用利尿劑;non-AKI組25例應用ACEI/ARB類藥物,18例應用過造影劑,26例應用利尿劑,兩組患者無明顯差異(P均>0.05)。基礎情況比較,AKI組基礎腦鈉肽為123.2(53.0~325.2) pg/mL,基礎血肌酐94.8(42~167)μmol/L,基礎尿蛋白19.0(6.0~51.0) mg/dL;non-AKI組基礎腦鈉肽為106.2(19.4~256.2) pg/mL,基礎血肌酐56.1(45.4~123.5) μmol/L,基礎尿蛋白9.3(1.3~22.3) mg/dL,兩組患者無明顯差異(P均>0.05)。
2.2 兩組患者晨尿miRNA-21水平比較 AKI組患者晨尿miRNA-21水平顯著高于non-AKI組(0.92±0.12 vs 0.73±0.09,P<0.05)。
2.3 急性心功能不全患者繼發AKI的危險因素分析 單因素分析顯示,糖尿病、低血壓、miRNA-21相對表達量較高是發生AKI 的相關危險因素,其OR分別為3.378(95%CI為1.280~8.911)、4.301(95%CI為1.586~11.658)、5.497(95%CI為3.223~12.607)(P均<0.05);進一步多因素Logistic回歸分析顯示,低血壓、miRNA-21相對表達量是發生AKI 的獨立危險因素,其OR分別為4.631(95%CI為1.639~6.772)、5.736(95%CI為1.207~7.208)(P均<0.05)。
2.4 miRNA-21對急性心功能不全患者繼發急性腎損傷的預測價值 以入組患者的晨尿miRNA-21相對水平對患者是否存在AKI做ROC曲線,可見晨尿miRNA-21的ROC曲線下面積=0.874(95%CI為0.824~0.924)。
3 討論
有研究顯示,腎功能不全普遍存在于急性心力衰竭患者[7],且血肌酐升高、腎功能持續進展可明顯增加急性心功能不全患者的住院天數及病死率[8]。因此,尋找新的、更為敏感的急性心功能不全繼發AKI的早期診斷標志物,將有助于減少急性心功能不全患者的住院率及病死率。近年來的研究表明,miRNA在腎臟組織及尿液中均穩定表達,其在生理或病理狀態下的變化早于其他生物標志物,這就為尿miRNA作為生物標記物進行檢測提供了理論依據[9]。miRNA-21廣泛表達于哺乳動物多個器官[10],它定位于17q23.2,與蛋白編碼基因VMP1存在部分重疊。Saikumar等[11]研究發現,miRNA-21、miRNA-115、miRNA-18a在缺血-再灌注腎損傷大鼠模型腎小管上皮細胞中表達上調,臨床驗證結果證實AKI患者的尿液中僅miRNA-21相對表達量較健康人升高1.2倍。除此之外,研究發現miRNA-21對AKI進展的預測價值遠高于蛋白肌酐比、血尿中性粒細胞明膠酶相關脂質運載蛋白以及尿白介素-18。Du等對120名心臟術后的患者研究發現,血漿和尿液中的miRNA-21的相對表達量與心臟術后AKI的損傷程度及患者預后存在一定的相關性,但尿液中的miRNA-21相對表達量較血漿更能準確預測AKI的發生及預后。這提示檢測晨尿miRNA-21相對表達量,可能對診斷急性心功能不全繼發AKI具有重要價值。
本研究對80例急性心功能不全患者進行了尿液miRNA-21的監測,發現急性心功能不全患者繼發AKI的發生率為35.0%,且AKI發生與患者本身糖尿病、低血壓、miRNA-21相對表達量較高密切相關。進一步多因素分析發現,低血壓、miRNA-21相對表達量增高可使急性心功能不全患者發生AKI的風險增加5.736倍,而低血壓僅能使這種風險增加4.631倍,晨尿miRNA-21的預測價值高于低血壓的預測價值。因此對于miRNA-21高表達的急性心功能不全患者應當注意其腎功能及尿量情況,一旦發生腎功能不全,應當更為積極地治療,預防AKI的發生。既往研究已經證實miRNA-21表達于腎臟組織中,并在多種腎臟相關疾病存在差異性表達。但尿miRNA-21是否可以作為預示急性心功能不全繼發AKI的重要生物學標記物,目前仍未見報道。本研究結果中ROC曲線顯示晨尿miRNA-21的相對表達量對判斷急性心功能不全患者是否繼發AKI具有重要價值。Liu等研究發現,外源性增加腎小管上皮細胞中miRNA-21的表達可加速腎小管上皮細胞凋亡,抑制黏蛋白E-cadherin蛋白表達。同時Lin等也證實了,miRNA-21可以靶向抑制腎小管上皮細胞SMAD7的表達進而抑制細胞增殖。由此,我們推測外源性刺激因素使得腎小管上皮細胞miRNA-21的表達,使細胞間粘附減低,細胞凋亡增加,從而引發急性腎損傷的發生,同時miRNA-21也可以抑制細胞增生從而抑制腎小管損傷修復,加重腎損傷。因此,及時檢測晨尿miRNA-21的相對表達量,有可能對急性心功能不全患者病情的判斷、治療方案的選擇及調整提供重要的線索。
[1] Schefold JC, Filippatos G, Hasenfuss G, et al. Heart failure and kidney dysfunction: epidemiology, mechanisms and management[J]. Nat Rev Nephrol, 2016,12(10):610-623.
[2] Wang Q, Liu S, Tang Y, et al. MPT64 protein from Mycobacterium tuberculosis inhibits apoptosis of macrophages through NF-kB-miRNA21-Bcl-2 pathway[J]. PLoS One, 2014,9(7):e100949.
[3] 喬平,馬建林,林勁,等.慢性心力衰竭患者血miRNA-21的變化及意義[J].實用醫學雜志,2016,32(15):2471-2474.
[4] Silber S. Evidence-based management of ST-segment elevation myocardial infarction (STEMI). Latest guidelines of the European Society of Cardiology (ESC) 2010[J]. Herz, 2010,35(8):558-564.
[5] 中華醫學會心血管病學分會,中華心血管病雜志編輯委員會.中國心力衰竭診斷和治療指南2014[J].中華心血管病雜志,2014,42(2):98-122.
[6] Du J, Cao X, Zou L, et al. MicroRNA-21 and risk of severe acute kidney injury and poor outcomes after adult cardiac surgery[J]. PLoS One, 2013,8(5):e63390.
[7] Dubin RF, Deo R, Bansal N, et al. Associations of conventional echocardiographic measures with incident heart failure and mortality: the chronic renal insufficiency cohort[J]. Clin J Am Soc Nephrol, 2017,12(1):60-68.
[8] Hillege HL, Girbes AR, de Kam PJ, et al. Renal function, neurohormonal activation, and survival in patients with chronic heart failure[J]. Circulation, 2000,102(2):203-210.
[9] 寧晉靈,高穎.小鼠糖尿病腎病足細胞NOD2 mRNA表達變化及其意義[J].山東醫藥,2017,57(3):45-47.
[10] Lagos-Quintana M, Rauhut R, Yalcin A, et al. Identification of tissue-specific microRNAs from mouse[J]. Curr Biol, 2002,12(9):735-739.
[11] Saikumar J, Hoffmann D, Kim TM, et al. Expression, circulation, and excretion profile of microRNA-21, -155, and -18a following acute kidney injury[J]. Toxicol Sci, 2012,129(2):256-267.

