多發性骨髓瘤患者外周血循環DNA水平變化及其意義
劉憲凱,吳隼,呂國慶,楊滿,張媛,王艷閣,陶貞,任毅飛
(新鄉醫學院第一附屬醫院,河南衛輝 453100)
循環DNA(cf-DNA )指的是存在于血液、腦脊液、尿液等體液并游離于細胞外的DNA。腫瘤患者血液游離DNA水平明顯升高[1]。隨著近年來DNA提取、檢測、測序等分子生物學技術的迅猛發展,cf-DNA與各種疾病之間的關系逐漸被揭示出來,cf-DNA在乳腺癌[2]、卵巢癌[3]等腫瘤篩查、診斷、療效預測、預后評估、復發診斷等方面顯現出重要的臨床價值,但是多發性骨髓瘤(MM)患者外周血cf-DNA水平的變化及其臨床意義尚不明確。本研究觀察了初治、復發MM患者外周血cf-DNA水平的變化,并探討初治MM患者外周血cf-DNA水平與患者年齡、性別、ISS分期、髓外浸潤、白細胞計數、血沉、血清乳酸脫氫酶水平的關系以及化療后外周血cf-DNA水平與化療效果的關系,旨在明確外周血cf-DNA水平在MM診斷、病情判斷、化療效果預測中的臨床價值。
1 資料與方法
1.1 臨床資料 選擇2016年3月~2017年8月新鄉醫學院第一附屬醫院血液科收治的21例初治MM患者為MM組,其中男12例、女9例,年齡48~68歲,中位年齡53.7歲。ISS分期Ⅰ期11例、Ⅱ期7例、Ⅲ期3例。有髓外浸潤11例、無髓外浸潤10例。MM的診斷標準參照2015年中國MM診治指南[4]。排除標準[5]:不能配合研究者,并發結締組織病者。另選20例健康體檢者對照組,其中男11例,女9例;年齡36~67歲,中位年齡51.1歲。三組患者性別、年齡相比,P均>0.05。本研究已獲醫院醫學倫理委員會批準,患者均簽署知情同意書。
1.2 外周血cf-DNA檢測 初治組MM患者每周期化療前留取外周血3 mL,復發組患者入院時抽取外周血3 mL,對照組體檢時采集外周血3 mL,將標本分別注入EDTA抗凝管中,3 h后按cf-DNA提取試劑盒說明書操作提取外周血cf-DNA,-20 ℃保存備用。采用熒光定量PCR法檢測cf-DNA水平。cf-DNA上游引物5′-AGCCGTGTTCTTTGCACTTT-3′,下游引物5′-CAGAGGCGTACAGGGATAGC-3′。按Tap MasterMix說明書操作進行擴增。讀取樣品的吸光度值。以人類基因組DNA為標準品,10倍連續梯度稀釋,以標準品的濃度和吸光度的讀數值繪制標準曲線,根據標準曲線和樣品的吸光度值計算樣品cf-DNA水平。
1.3 初治組化療及結果判定方法 均采用VAD方案化療。化療3療程后采用國際骨髓瘤工作組(IM-WG) 的標準的評價療效[6],分為完全緩解(CR)、非常好的部分緩解(VGPR)、部分緩解(PR) 、輕微反應(MR)、疾病穩定(SD)和疾病進展(PD)。其中CR+VGPR為預后良好,PR+MR+SD+PD為預后不良。
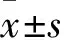
2 結果
2.1 兩組外周血cf-DNA水平比較 MM組、對照組外周血cf-DNA水平分別為(177.59±40.31)、(14.77±3.12)ng/mL。兩組患者外周血cf-DNA水平相比,P<0.05。
2.2 MM組患者外周血cf-DNA與性別、年齡、ISS分期、髓外浸潤、白細胞計數、血沉、血清乳酸脫氫酶水平的關系 初治組男、女性患者外周血cf-DNA分別為(187.59±40.31)、(176.59±40.31)ng/mL,P>0.05。有、無髓外浸潤患者外周血cf-DNA分別為(223.59±40.31)、(143.59±40.31)ng/mL,P<0.05。ISS分期Ⅰ期、Ⅱ期、Ⅲ期患者外周血cf-DNA分別為(108.23±20.31)、(164.29±33.51)、(207.15±47.82)ng/mL,MM患者外周血cf-DNA水平隨ISS分期升高而升高(P<0.05)。經Spearman相關性分析結果顯示,MM組患者外周血cf-DNA水平與患者白細胞計數(r=0.318)、血沉(r=0.628)、乳酸脫氫酶(r=0.916)均呈正相關(P均<0.05),與年齡無相關性(P>0.05)。
2.3 MM組患者化療效果及不同化療效果患者化后外周血cf-DNA水平比較 MM組患者采用VAD方案化療3周期后預后良好8例、預后不良13例。預后良好、預后不良患者化療后外周血cf-DNA水平分別為(79.36±19.30)、(183.73±49.22)ng/mL,預后良好、預后不良患者化療后外周血cf-DNA水平相比,P<0.05。
3 討論
cf-DNA亦稱游離DNA, 源自于釋放到血液、腦脊液、滑膜液、尿液等體液中的降解DNA片段,來自于壞死、凋亡的細胞[6,7]。近年來cf-DNA在腫瘤診治中的應用逐步成為臨床研究的焦點,cf-DNA在腫瘤的早期診斷、病情評估、藥物反應監測、復發轉移及預后的預測等方面均有著重要的應用價值[2,8~10],但以往研究多針對實體腫瘤,在惡性血液系統疾病中的相關研究少見。
隨著基于 PCR 技術的迅速發展及廣泛應用,應用于早期研究中的放射免疫分析、酶聯免疫吸附試驗、斑點雜交等方法已經逐漸被 PCR 所取代。本研究采用實時熒光定量PCR法定量檢測外周血cf-DNA水平,結果顯示健康體檢者外周血cf-DNA水平均值為14.77 ng/mL。文獻報道健康人外周血cf-DNA平均水平約為30.0 ng/mL,與本研究結果不盡相同,考慮與標本采集流程、檢測方法、試驗器材精準度等缺乏統一標準相關,因此各實驗室之間的結果可比性差,但本實驗各標本基于同一平臺檢測,各組之間存在可比性。多項研究[1,12,13]表明,腫瘤患者與健康個體相比有較高的外周血cf-DNA水平,這些升高的cfDNA主要來自癌細胞。本研究結果顯示MM組患者外周血cf-DNA水平高于對照組。相關性分析提示MM組外周血cf-DNA水平與白細胞計數呈正相關性,,進一步證實外周血cf-DNA水平來源于腫瘤細胞,并提示檢測外周血cf-DNA水平有助于診斷MM。
Olsson 等[14]報道外周血cf-DNA水平與乳腺癌患者預后呈正相關性,ISS分期可以反映MM患者的預后情況,本研究結果顯示ISS分期越高,外周血cf-DNA水平越高。髓外浸潤、血沉、乳酸脫氫酶等指標與MM患者預后相關。本研究結果顯示MM患者外周血cf-DNA水平與髓外浸潤、血沉、血清乳酸脫氫酶水平有關,提示外周血cf-DNA水平可以作為評判MM患者病情和預測預后的指標。
本研究顯示外周血cf-DNA可以反映MM患者腫瘤負荷,隨著規律化療方案的進行,MM患者腫瘤負荷逐步減少,因此理論上外周血cf-DNA亦呈下降趨勢,研究中動態監測初治組患者外周血cf-DNA水平的變化,不同緩解程度患者化療前外周血cf-DNA含量無明顯差異,而化療前后外周血cf-DNA水平的下降程度與緩解深度呈正相關性,有研究[15]顯示在淋巴瘤中同樣存在這種現象,有可能通過對比化療前后外周血cf-DNA水平的下降程度進一步評估治療效果,為臨床工作提供了另一種思路。
本研究結果顯示,MM組化療效果好的患者化療后外周血cf-DNA水平較低,與文獻[15]對淋巴瘤的相關報道類似,提示臨床工作者可以通過外周血cf-DNA水平判斷MM患者化療效果。
參考文獻:
[1] Leon SA, Shapiro B, Sklaroff DM, et al. Free DNA in the serum of cancer patients and the effect of therapy[ J] . Cancer Res, 1977,37(3):646-650.
[2] Madhavan D, Wallwiener M, Bents K, et al. Plasma DNA integrity as a biomarker for primary and metastatic breast cancer and potential marker for early diagnosis[ J] . Breast Cancer Res Treat, 2014,146(1):163-174.
[3] Cohen PA, Flowers N, Tong S, et al. Abnormal plasma DNA profiles in early ovarian cancer using a non-invasive prenatal testing platform: implications for cancer screening[J]. BMC Med, 2016,14(1):126-131.
[4] 中國醫師協會血液科醫師分會. 中國多發性骨髓瘤診治指南(2015年修訂)[J]. 中華內科雜志, 2015, 54(12):1066-1070.
[5] Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma[J]. Lancet Oncol, 2014,15(12):538-548.
[6] Thierry AR, Messaoudi SE, Gahan PB, et al. Origins, structures, and functions of circulating DNA in oncology[J]. Cancer Metast Rev, 2016,35(3):347-376.
[7] Melo SA, Luecke LB, Kahlert C, et al. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer[J]. Nature, 2015,523(7559):177-182.
[8] Cheng F, Li S, Cheng Q. Circulating tumor DNA: a promising biomarker in the liquid biopsy of cancer[J]. Oncotarget, 2016,7(30):48832-48841.
[9] Tie J, Wang Y, Tomasetti C, et al. Circulating tumor DNA analysis detects minimal residual disease and predicts recurrence in patients with stage II colon cancer.[J]. Colon Rectum, 2017,11(2):117-118.
[10] Karachaliou N, Mayo-Del CC, Queralt C, et al. Association of EGFR L858R Mutation in Circulating Free DNA With Survival in the EURTAC Trial[J]. JAMA Oncol, 2015,1(2):149-157.
[11] Schwarzenbach H, Hoon D S, Pantel K. Cell-free nucleic acids as biomarkers in cancer patients.[J]. Nature Reviews Cancer, 2011,11(6):426-437.
[12] Newman AM, Bratman SV, To J, et al. An ultrasensitive method for quantitating circulating tumor DNA with broad patient coverage[J]. Nature Med, 2014,20(5):548-554.
[13] Sikora K, Bedin C, Vicentini C, et al. Evaluation of cell-free DNA as a biomarker for pancreatic malignancies.[J]. Int J Biol Markers, 2015,30(1):136-141.
[14] Olsson E, Winter C, George A, et al. Serial monitoring of circulating tumor DNA in patients with primary breast cancer for detection of occult metastatic disease[J]. EMBO Mo Med, 2015,7(8):1034-1047.
[15] 陳園園,郭素青,李英華,等.血循環DNA在淋巴瘤中的定量檢測及其臨床意義[J]. 中國實驗血液學雜志,2016,24(5):1390-1396.
[16] Reinert T, Scholer L V, Thomsen R, et al. Analysis of circulating tumour DNA to monitor disease burden following colorectal cancer surgery[J]. Gut, 2016,65(4):625-634.

