薏苡仁油對喉癌細胞侵襲遷移能力的影響
熊美華,諶建平,操潤琴,萬金華,操 建
(1.南昌市中西醫結合醫院耳鼻喉科,江西 南昌 330000;2.南昌市洪都中醫院,江西 南昌 330008)
喉癌是頭頸部腫瘤中最常見的惡性腫瘤之一,以鱗狀細胞癌為主,約占95%,其發生發展是一個復雜的多步驟過程[1]。近年來其發病率呈逐步上升趨勢,常造成患者發音及吞咽困難。常用的治療手段包括:外科手術方法、化療藥物、放射治療和生物治療[2]。一般認為,喉癌具有侵襲力強、易復發和轉移以及預后差的特點。因此提高患者生存率需要增加對喉鱗癌發病及侵襲轉移機制的研究。
薏苡仁為禾本科植物薏苡的干燥成熟種仁,俗稱米仁,又名薏米、苡仁等。現代研究表明,薏苡仁含有多種活性成分,如脂類、多糖類、木脂素類、酚類和腺苷等化合物。薏苡
仁在中醫被用作利水滲濕藥,現代研究發現其具有鎮痛、抗炎、免疫調節、抗潰瘍、降血糖和抗腫瘤等藥理作用。目前對薏苡仁油的研究主要集中在其對腫瘤細胞的增殖與凋亡作用[3-4],然而薏苡仁油對腫瘤細胞的侵襲與遷移的作用報告較少,尤其對喉鱗癌細胞的侵襲與遷移作用尚未見報道。因此,本研究通過探討薏苡仁油對喉癌細胞株Hep-2侵襲和遷移能力的影響,為薏苡仁油調控喉鱗癌的侵襲遷移機制提供研究基礎。
1 材料與方法
1.1 細胞與試劑 喉癌細胞株Hep-2購自中國科學院上海細胞研究所,DMEM/F12、胰蛋白酶培養基購自美國Gibco公司,胎牛血清(FBS)購自美國Hyclone公司,CCK8試劑盒購自日本同仁化學研究所,Transwell小室(8.0μm孔徑PC膜)購自美國Corning公司,Transwell Kit購自美國BD Biosciences公司,E-cad、Vimentin、Slug、pERK1/2、ERK1/2、GAPDH抗體購自美國Cell Signaling Technology公司,薏苡仁油購自浙江豪森藥物股份有限公司。
1.2 細胞培養 選用喉癌細胞株Hep-2,用含10%FBS的DMEM/F12培養基培養,置于37℃恒溫、5%CO2的飽和濕度培養箱中培養。所有細胞株從液氮中取出后進行復蘇,置入培養箱中進行培養,待細胞鋪滿培養瓶約80%時進行傳代,所有細胞常規傳代2次,取生長狀態良好無污染的細胞株進行后續實驗。
1.3 CCK8實驗 取狀態良好的Hep-2細胞,胰酶消化后,離心,重懸,細胞計數板計數,調整細胞濃度至1×103個細胞/ml,在96孔板中按100 μl/孔加入細胞懸液,混合均勻,所有組均設3個復孔,另設無細胞組的空白孔。置于細胞培養箱中培養8 h。去除原培養基,加入含有不同濃度薏苡仁油(0、25、50、100、200、400、800、1 600 μM)的新鮮培養基,分別培養24、48、72、96 h,去除原培養基,PBS清洗3遍,每孔分別加入10 μl的CCK-8溶液,于細胞培養箱中培養2 h,取出96孔板,酶標儀檢測各孔的吸光度值(波長設置為450 nm)。數據處理:根據吸光度值計算各組細胞的吸光值均數和標準差。使用Graphpad Prism軟件繪圖。抑制率=[1-(Atreated-Ablank)/(Acontrol-Ablank)]×100%。
1.4 劃痕實驗 細胞長至80%左右,加入不同濃度薏苡仁油處理24 h后,用1 ml槍頭在6孔板各孔中央位置,劃1道劃痕,盡量使各孔的細胞劃痕寬度一致。PBS漂洗3次,去除劃下的細胞碎片。每孔加入1%血清的DMEM/F12培養基2 ml,放于細胞培養箱中繼續培養。觀察24 h后細胞遷移情況并拍照記錄,遷移距離測量采用Image J軟件。
1.5 Transwell侵襲實驗 取經過不同濃度薏苡仁油處理24小時后細胞,消化離心后用無血清的 DMEM/F12培養基重懸細胞,調整細胞的密度為5×105個細胞/ml,小室上部加入200 μl細胞懸液,小室下部加入750 μl含10%FBS的DMEM/F12培養基。培養24 h后,去除上下室培養基,PBS清洗小室,將小室置入4%多聚甲醛中固定細胞10 min,室溫下晾干小室,用棉簽輕輕擦去小室內未遷移的細胞,避光,DAPI染色10 min,去離子水洗滌后風干,置于倒置熒光顯微鏡下觀察,隨機取五個視野計數穿過小室的細胞數,每組細胞重復3次實驗。
1.6 Western blot實驗 取經過不同濃度薏苡仁油處理24 h后細胞,加入細胞裂解液,低溫高速離心后收集上清液,BCA法測蛋白濃度。將已配制好的蛋白樣品與上樣緩沖液充分混合,每個孔上樣體積為20 μl,兩側加入Marker,在Bio-Rad凝膠電泳槽中進行電泳,將蛋白轉移到PVDF膜上;室溫下脫脂奶粉封閉1 h后,加入一抗孵育過夜,二抗室溫孵育2 h,ECL免疫印跡底物進行發光顯影、掃描。
1.7 統計學方法 采用SPSS 17.0統計軟件分析結果,所有數據采用“x±s”表示。采用單因素方差分析(One-Way ANOVA);兩組數據采用兩獨立樣本的t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 薏苡仁油抑制喉癌細胞株Hep-2的增殖 從圖1可以看出,薏苡仁油抑制喉癌細胞株Hep-2的增殖,其抑制效應呈劑量-時間依賴性。薏苡仁油作用于同一時間點,與對照組相比(0 μM),隨著薏苡仁油濃度的升高(25~1 600 μM),Hep-2生長抑制率顯著增加,差異具有統計學意義(P<0.05);薏苡仁油對喉癌細胞株Hep-2的半數抑制濃度(IC50)為:165.2~650.2 μM,見表1。基于以上的結果,我們選擇作用24 h的100,200 μM薏苡仁油濃度作為后續實驗濃度。
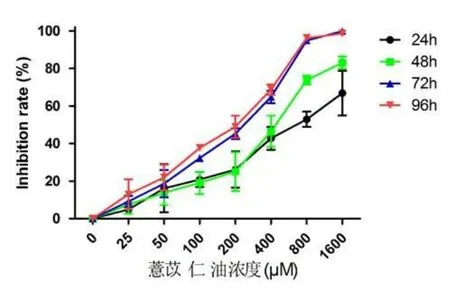
圖1 薏苡仁油抑制喉癌細胞株Hep-2的增殖Figure1 Coix seed oil inhibited the proliferation of Hep-2 cells

表1 薏苡仁油作用后Hep-2的IC50值Table1 The IC50 values of Hep-2 after added the Coix seed oil
2.2 薏苡仁油抑制喉癌細胞株Hep-2的侵襲和遷移 我們采用劃痕實驗檢測薏苡仁油對喉癌細胞株Hep-2遷移能力的影響,從圖2A-B可以看出,采用不同濃度薏苡仁油(100,200μM)處理細胞24 h后,薏苡仁油組劃痕區變窄,對照組組劃痕依然明顯,差異具有統計學意義(P<0.05)。
采用含基質膠的Transwell小室檢測薏苡仁油對喉癌細胞株Hep-2侵襲能力的影響,采用不同濃度薏苡仁油(100,200 μM)處理細胞24 h后,薏苡仁油組穿膜細胞數目顯著下降,即其侵襲能力明顯受抑制(圖2C-D),差異均具有統計學意義(P<0.05)。
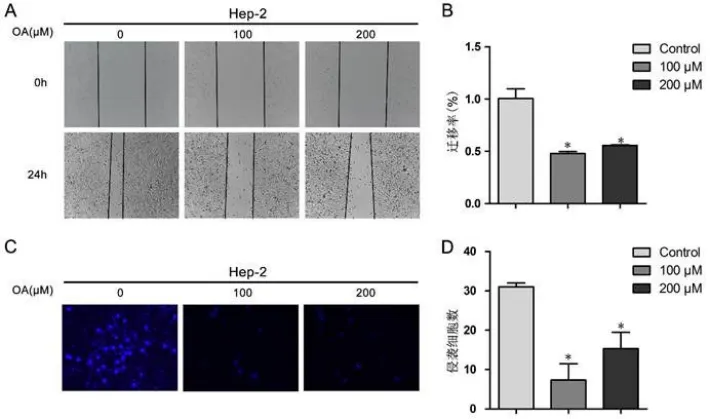
圖2 薏苡仁油抑制喉癌細胞株Hep-2的侵襲和遷移Figure2 Coix seed oil inhibited the invasive and migrative ability on Hep-2 cells
2.3 薏苡仁油對喉癌細胞株Hep-2侵襲、轉移相關因子的表達 Western bolt免疫印跡檢測結果顯示:采用不同濃度薏苡仁油(100,200 μM)處理細胞 24 h后,Vimentin、Slug、pERK1/2表達下調;E-cad表達升高;ERK1/2表達不變,見圖3。
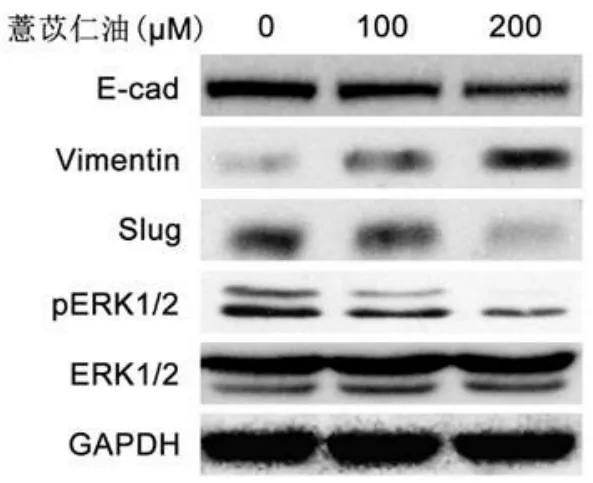
圖3 薏苡仁油對喉癌細胞株Hep-2侵襲、轉移相關因子的表達Figure3 The protein levels of EMT related genes after added the different concentrations of Coix seed oil
3 討論
喉癌是喉部最常見的惡性腫瘤,我國(2003~2007年)喉癌發病率為2.04/10萬,占全部惡性腫瘤新發病例的0.77%[5]。雖然喉癌的治療主要以手術及放療為主,但是近年來,術后化療或者術前誘導化療可以減低喉癌局部復發或遠處轉移的風險,尤其是術前誘導化療可以改善患者的生活質量[5-6]。
薏苡仁含有多種活性成分,如脂類、多糖類、木脂素類、酚類和腺苷等化合物。薏苡仁在中醫被用作利水滲濕藥,現代研究發現其具有鎮痛、抗炎、免疫調節、抗潰瘍、降血糖和抗腫瘤等藥理作用。目前對薏苡仁油的研究主要集中在增殖和凋亡方面。車曉玲等[4]研究發現,薏苡仁油可協同奧沙利鉑抑制人結直腸癌SW480細胞的增殖,并促進其凋亡。有學者研究表明薏苡仁注射液抗腫瘤的可能機制有:抑制細胞周期,使細胞周期阻滯于G2+M期,減少進入G0、G1時相細胞,使DNA合成期(S期)比例減少,從而減少有絲分裂,抑制腫瘤細胞增殖[7];谷滿倉等[8]在胰腺癌細胞系BXPC3中發現薏苡仁脂可能通過逆轉吉西他濱誘導的抗凋亡蛋白Bcl-2、Survivin表達上調,并增加Bax/Bcl-2比值,從而進一步激活Caspase-3蛋白介導的細胞凋亡,增強吉西他濱對胰腺癌細胞株BXPC3的生長抑制作用和誘導凋亡作用。沈飛瓊等[9]通過對抑瘤率及 MVD、VEGF、KDR蛋白及mRNA的檢測,發現并證實康萊特(薏苡仁油)及吉非替尼單藥均能產生一定的抗腫瘤作用,而康萊特聯合吉非替尼具有協同增效作用,且能夠顯著降低腫瘤組織血管生成數目。國內對與薏苡仁油的研究較多,而國外的研究較少,Liu等[10]采用不同濃度康萊特注射液對小鼠皮下胰腺癌細胞成瘤實驗表明:薏苡仁油能夠抑制腫瘤的生長,誘導腫瘤的凋亡,并且可以下調p-AKT及p-mTOR的表達來影響PI3K/Akt/mTOR信號通路。Zhan等[11]通過對胃癌化療患者分組對比研究顯示,采用薏苡仁油聯合化療藥物組患者的療效,生活質量,毒副作用,胃腸道反應和骨髓抑制作用明顯比只采用化療藥物組低。
在本研究中,我們發現,薏苡仁油抑制喉癌細胞株Hep-2的增殖,其抑制效應呈劑量-時間依賴性;薏苡仁油對喉癌細胞株Hep-2的半數抑制濃度(IC50)為:165.2~650.2 μM;經薏苡仁油作用后Hep-2細胞的侵襲和遷移能力降低,差異具有統計學意義(P<0.05);薏苡仁油(100,200 μM)作用后,與對照組相比,Vimentin、Slug、pERK1/2的表達下調;E-cad的表達升高;ERK1/2的表達不變。
綜上所述,薏苡仁油可以抑制喉鱗癌的侵襲和遷移,并初步闡明了可以通過調控上皮-間充質轉化(EMT)來抑制喉鱗癌的侵襲遷移,上述研究為薏苡仁油抑制喉鱗癌的侵襲轉移提供了可靠的實驗依據。
[1] 王蓓蕾,徐立紅,袁暉,等.喉癌相關基因的研究進展[J].中國細胞生物學學報,2014(9):1323-1330.
[2] 劉家鋒.不同手術方式治療喉癌的預后研究[J].當代醫學,2017,23(28):59-60.
[3] 胡靜,馬力天,閆平,等.康萊特聯合順鉑對宮頸癌SiHa細胞增殖和凋亡的影響[J].現代生物醫學進展,2014,14(10):1865-1870.
[4] 車曉玲,李進,何敬東,等.康萊特注射液聯合奧沙利鉑對SW480細胞株增殖和凋亡的影響[J].腫瘤,2011,31(4):321-325.
[5] 張樹榮,房居高.誘導化療在局部晚期喉癌治療中的應用進展[J].中華臨床醫師雜志(電子版),2015,9(4):655-659.
[6] 趙舒薇.喉癌治療進展[J].腫瘤學雜志,2012,18(9):644-647.
[7] 李大鵬.康萊特注射液抗癌作用機理研究進展[J].中藥新藥與臨床藥理,2001,12(2):122-124.
[8] 谷滿倉,錢亞芳,孫悅,等.薏苡仁脂調控凋亡相關蛋白Bax、Bcl-2及Survivin增強胰腺癌細胞對吉西他濱敏感性的研究[J].中國藥理學通報,2013,29(4):491-495.
[9] 沈飛瓊,魏素菊,洪雷,等.康萊特聯合吉非替尼對Lewis肺癌小鼠血管生成的影響[J].腫瘤,2013,33(12):1047-1053.
[10]Liu Y,Zhang W,Wang XJ,et al.Antitumor effect of Kanglaite(R)injectioninhumanpancreatic cancer xenografts[J].BMC Complement Altern Med,2014,14:228.
[11]Zhan YP,Huang XE,Cao J,et al.Clinical safety and efficacy of Kanglaite(R)(Coix Seed Oil)injection combined with chemotherapy in treating patients with gastric cancer[J].Asian Pac J Cancer Prev,2012,13(10):5319-5321.

