干熱處理對葫蘆科種子質量的影響及對黃瓜綠斑駁花葉病毒的防治效果
宋順華 宮國義 耿麗華* 吳 萍 孟淑春 徐 茂 焦玉英
〔1北京市農林科學院蔬菜研究中心,農業部華北地區園藝作物生物學與種質創制重點實驗室,農業部都市農業(北方)重點實驗室,北京 100097;2北京市順義區種植中心,北京 101300;3北京市延慶區農業技術推廣站,北京 102100〕
黃瓜綠斑駁花葉病毒(Cucumber green mottle mosaic virus,CGMMV)是葫蘆科植物上的重要檢疫性病害,病毒主要通過帶毒種子進行遠距離傳播,也可通過病株汁液隨著農事操作進行機械傳播導致病害的擴展流行。我國遼寧省首次報道了田間西瓜大面積發生CGMMV,發病面積達333 hm2,其中有13 hm2絕收(陳紅運 等,2006)。目前,CGMMV在我國很多地區已有分布,生產上以感染瓠瓜(葫蘆)、西瓜、黃瓜和南瓜種子較為常見,尤其是葫蘆種子帶毒更加普遍。在西瓜生產中,CGMMV主要通過砧木種子帶毒傳播,自然條件下西瓜種子很少帶毒,甚至不帶毒(蔡明 等,2011)。
為了控制病害的發生,迫切需要有效滅活病毒的帶毒種子處理技術和無毒種子生產技術。已有研究表明,熱水處理和干熱處理是滅活種子中病毒最有效的方法(Ullman et al.,1991;Kim & Lee,2000)。筆者的前期試驗研究也表明,72 ℃、72 h干熱處理葫蘆種子能有效鈍化CGMMV(宋順華等,2015)。西瓜、甜瓜和油菜種子經干熱處理后在常溫下保存1 a,其活力與處理前沒有明顯的變化(宋順華 等,2011)。80 ℃以下的溫度處理黃瓜、南瓜和葫蘆種子1~7 d,不會影響種子的發芽率,葫蘆種子的發芽率還高于未處理的種子(Kubota et al.,2012)。但是不適宜的處理方法會縮短種子的貯藏時間,降低種子活力(孟姍姍 等,2014),而且不同作物種類,甚至不同品種對溫度的敏感性也不一樣。為了探索葫蘆科作物不同種類、同一種類不同品種有效的種子干熱處理條件及貯藏對種子活力的影響,本試驗以西瓜生產上最常使用的砧木葫蘆和南瓜為材料,通過測定種子發芽能力來分析不同的干熱處理條件和種子保存溫度對不同品種種子活力的影響,以界定不同品種適宜的干熱處理溫度參數范圍和種子保存溫度,為實際生產應用提供參考依據;進一步以不同的葫蘆砧木種子為材料進行干熱處理,通過不同季節和不同生育期的田間種植試驗來評價干熱處理對CGMMV的防治效果和效果的持續性,為生產上防治CGMMV提供實際依據。
1 材料與方法
1.1 材料
砧木分2種類型,一是葫蘆(Lagenaria siceraria)類型,品種為葫蘆京欣砧1、葫蘆京欣砧2、葫蘆京欣砧3、葫蘆京欣砧4、葫蘆京欣砧5;二是南瓜(Cucurbita moschata)類型,品種為南瓜京欣砧2與南瓜京欣砧8。田間種植試驗中,西瓜(Citrullus lanatus)接穗品種分別為超越夢想、京穎-6、墨童2號。試驗種子均由京研益農(北京)種業科技有限公司提供。
試劑:CGMMV特異抗體(美國Agdia公司),其他試劑均為國產分析純試劑。
儀器:MK3酶標儀,芬蘭Thermo Labsysterms Multiskan(雷勃)公司產品;恒溫干燥箱,上海一恒科技有限公司產品。
1.2 試驗方法
1.2.1 變溫干熱處理 不同處理的種子平鋪在單層紗布上,置于恒溫干燥箱中,先在35 ℃處理24 h,然后55 ℃處理24 h,接著高溫處理72 h,設4個處理溫度:68、72、75、80 ℃。高溫處理后關掉電源,種子在恒溫干燥箱中放置24 h。以不做任何處理的種子為對照(CK)。干熱處理完成后,每個處理取400粒種子進行發芽試驗。另外,每個處理的種子分成2份,分別裝入種子袋,1份放置在室溫保存,另1份放置在6 ℃的種子保存箱中保存,葫蘆品種保存15個月,南瓜品種保存12個月,之后進行發芽試驗。
1.2.2 發芽試驗 種子發芽勢和發芽率采用GB/T 3543.4—1995《農作物種子檢驗規程 發芽試驗》的方法進行評價,發芽基質為蛭石。播種后放置在溫度為25 ℃的恒溫培養箱中,16 h光照、8 h黑暗,每處理100粒種子,4次重復。
1.2.3 田間栽培試驗 根據筆者前期試驗(宋順華 等,2015),72 ℃、72 h干熱處理對葫蘆種子CGMMV的滅活效果較好,于是對葫蘆京欣砧2、葫蘆京欣砧3、葫蘆京欣砧4、葫蘆京欣砧5的種子進行CGMMV帶毒檢測和72 ℃、72 h干熱處理,處理后的種子進行田間栽培試驗。
春季栽培試驗:砧木為葫蘆京欣砧3,接穗為京穎-6。夏季栽培試驗:砧木為葫蘆京欣砧3,接穗為超越夢想;砧木分別為葫蘆京欣砧2和葫蘆京欣砧4,接穗均為京穎-6。春季和夏季栽培試驗,每個砧木品種種植1個大棚,600株嫁接苗。長季節栽培試驗:砧木分別為葫蘆京欣砧5、葫蘆京欣砧4、葫蘆京欣砧2,接穗均為墨童2號。每個砧木品種種植1個大棚,900株嫁接苗。2015年的春季栽培試驗和2014~2016年的夏季栽培試驗均在北京順義區大棚內進行,2015年和2016年的長季節栽培試驗在北京延慶區大棚內進行。嫁接苗移栽后,監測整個大田生長期瓜苗的生長情況,如果發現疑似病毒病的植株,采集葉片樣本進行DASELISA檢測。待西瓜成熟采收后,不同的砧木嫁接植株分別采樣,因為不是吊蔓而是爬地栽培,后期植株與植株之間不好區分,因此隔一定的距離采摘1片葉片,采集中上部的葉片,將10片葉片混合成1個樣品,進行DAS-ELISA檢測。
1.2.4 DAS-ELISA方法檢測CGMMV 種子和葉片樣本的CGMMV帶毒情況采用DAS-ELISA方法(Koenraadt & Remeeus,2014)進行檢測。用酶標儀讀取OD405,當(樣品OD405-空白OD405)/(陰性對照OD405-空白OD405)≥2.0時,判定樣品為陽性,否則為陰性。
1.3 數據分析
利用SPSS 13.0單向方差分析模型(one-way ANOVA model)分析數據,利用SNK(Student-Newman-Keuls,P= 0.05)檢驗平均數差異的顯著性。
2 結果與分析
2.1 變溫干熱處理對不同葫蘆科種子活力的影響
試驗結果表明(表1),經過68~80 ℃高溫處理后,3個葫蘆品種種子的發芽勢和發芽率與對照沒有顯著差異,但2個南瓜品種種子的發芽勢和發芽率均顯著降低,其中,80 ℃高溫處理后的種子活力最低。
2.2 不同保存條件對不同葫蘆科種子活力的影響
變溫干熱處理后的葫蘆種子分別放置在常溫和6 ℃下保存15個月后,種子活力的變化情況見表2。結果表明,3個品種未經變溫干熱處理的對照種子,不管是在常溫還是在6 ℃下保存,其發芽率與保存前都沒有顯著變化,但發芽勢均顯著降低。
經過68~80 ℃高溫干熱處理的葫蘆種子,不管是在常溫還是在6 ℃下保存,3個品種的發芽勢均顯著低于對照;在發芽率方面,葫蘆京欣砧1以及在常溫下保存的葫蘆京欣砧2也顯著低于對照,葫蘆京欣砧3與對照差異不顯著(表2)。試驗結果表明,變溫干熱處理能顯著降低葫蘆種子的發芽勢。

表1 變溫干熱處理對葫蘆科種子活力的影響

表2 干熱處理后不同保存條件對葫蘆種子活力的影響
變溫干熱處理后的南瓜種子分別放置在常溫和6 ℃下保存12個月后,種子活力的變化情況見表3。可以看出,2個南瓜品種未經變溫干熱處理的對照種子,在常溫下保存12個月后,種子的發芽勢均顯著下降,南瓜京欣砧2和南瓜京欣砧8的發芽勢分別從保存前的75%和41%下降到58%和36%;在6 ℃下保存12個月后,2個品種的種子活力沒有明顯的降低,發芽勢和發芽率與保存前沒有顯著差異。
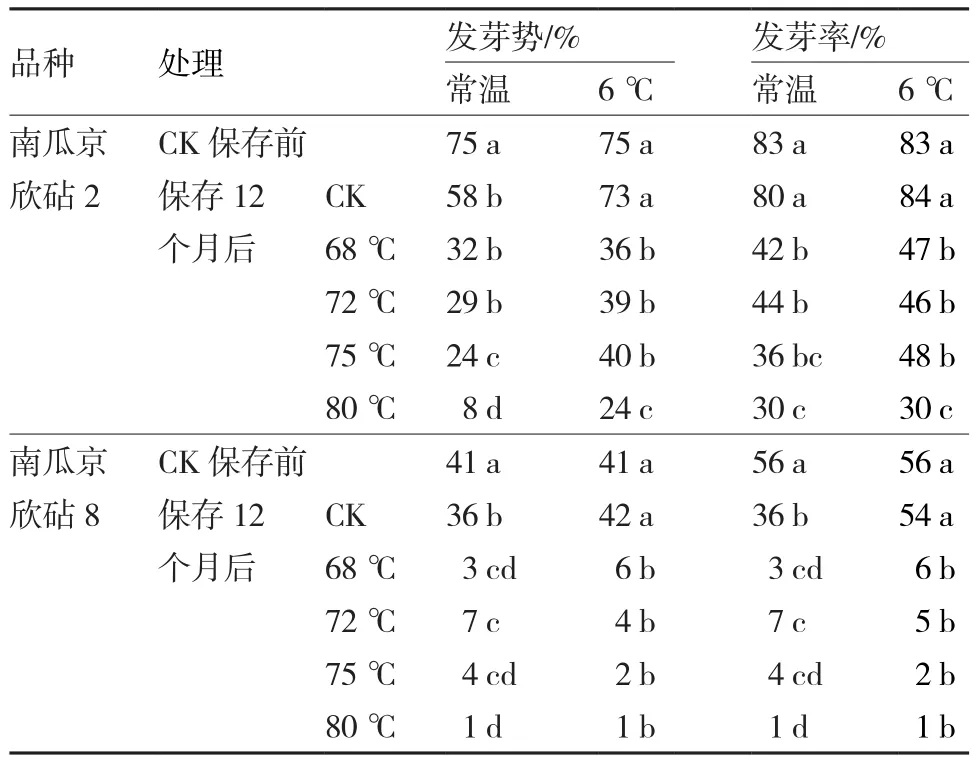
表3 干熱處理后不同保存條件對南瓜種子活力的影響
2個南瓜品種種子經變溫干熱處理后,不管是在6 ℃還是在常溫下保存,與未經變溫干熱處理的對照和保存前相比,種子活力均有所降低,且隨著處理溫度的增加,其發芽勢和發芽率的降低幅度加大。保存前活力較低的種子對高溫更加敏感。南瓜京欣砧2和南瓜京欣砧8保存前發芽勢分別為75%和41%,發芽率分別為83%和56%,在6 ℃下保存12個月后,南瓜京欣砧2和南瓜京欣砧8種子的發芽勢分別下降到24%~36%和 1%~6%,發芽率分別下降到30%~47%和 1%~6%,與對照都具有顯著差異。在常溫下保存12個月后的種子與6℃保存相似,2個品種種子的發芽勢和發芽率在保存后都有不同程度的下降,除68 ℃和72 ℃處理的南瓜京欣砧2種子的發芽勢以外,其他所有處理種子的發芽勢和發芽率都與對照存在顯著差異。
2.3 種子變溫干熱處理對CGMMV的防治效果
嫁接苗移栽后,對大田生長植株進行病情監測,無論是春大棚、夏大棚還是長季節栽培,田間植株都沒有發生CGMMV的可疑癥狀。
西瓜采收后對田間植株進行葉片采樣,室內ELISA檢測結果表明(表4),無論是春大棚、夏大棚還是長季節栽培,都沒有檢測到CGMMV帶毒植株。說明種子干熱處理用于防治CGMMV是可行的。

表4 不同栽培模式的田間試驗結果
3 結論與討論
CGMMV屬于煙草花葉病毒組,是一類非常穩定的病毒,在種子上存活時間長,以種子表面帶毒為主(吳會杰 等,2011;宋順華 等,2015),通過化學藥劑(次氯酸鈉和磷酸三鈉等)和物理方法(熱水處理和干熱處理)處理比較容易使種子外部的病毒失去活性(Stace-Smith & Hamilton,1988;Hull,2002),但化學處理很難有效地對大粒葫蘆科作物種子胚胎中的病原物產生滅菌作用;干熱處理時較高的溫度能更有效地滅活種子內外的病毒,但過高的溫度會傷害種子,較低的水分含量能提高干熱處理對種子的安全性,因此,在干熱處理前對種子進行預熱處理可以保護種子免遭傷害(Shiomi et al.,1991;Imada & Dan,2002;Shirakawa,2002)。本試驗采用階梯式逐步提高處理溫度,降低了高溫處理時種子的含水量,避免了種子傷害。
高溫干熱處理后種子的活力還與處理的溫度和處理后種子的保存時間有關(Kubota et al.,2012)。從本試驗結果來看,68~80 ℃的溫度處理種子72 h,不會影響葫蘆種子的發芽勢和發芽率,但顯著降低了南瓜種子的發芽勢和發芽率。種子在不同條件下保存一定時間后,種子質量產生不同的變化:與保存前相比,未經干熱處理的葫蘆種子在不同條件下保存15個月后,發芽率沒有降低,但發芽勢顯著下降;未經干熱處理的南瓜種子在低溫下保存其發芽勢和發芽率要高于常溫保存,與保存前沒有顯著差異。經不同溫度的干熱處理后,不管是常溫還是低溫下保存,與未處理種子相比,3個葫蘆品種種子的發芽勢及葫蘆京欣砧1的發芽率顯著下降;2個南瓜品種種子的發芽勢和發芽率均顯著下降(68、72 ℃處理的南瓜京欣砧2常溫保存的種子發芽勢除外),這可能與試驗種子的活力不高有關。本試驗結果也說明,干熱處理的種子經過一段時間貯存后,大粒的南瓜和葫蘆種子的發芽率受到影響,因此,干熱處理后的葫蘆和南瓜種子宜直接播種,不宜長期貯藏,這也與孟姍姍等(2014)的報道一致。
已有研究表明,不同溫度和處理時間的熱水和干熱處理是目前滅活種子和植株中病毒最有效的方法(Ullman et al.,1991;Kim & Lee,2000)。CGMMV為檢疫性病害,對帶毒種子和材料有非常嚴格的控制,應該種植在防蟲溫室中。筆者之前在防蟲溫室的實生苗試驗結果表明(宋順華等,2015),72 ℃處理葫蘆種子72 h能有效鈍化CGMMV。本試驗以不同帶毒率的葫蘆砧木作為試驗材料,3種不同栽培模式的田間試驗結果表明,種子經過72 ℃干熱處理72 h后,在田間栽培均沒有發生CGMMV。其中長季節栽培的時間達250 d左右,說明病毒已經被完全鈍化而失活。
干熱處理作為防治種傳病害一種有效的種子處理方法,使用時還應注意以下問題:首先,處理種子的最高溫度因作物種類和種子來源不同而稍有差別,溫度過高可能會影響種子的質量,因此應針對作物種類和品種摸索不同的干熱處理條件;其次,干熱處理前要先降低種子的含水量,但在商業種子的處理上不容易操作,費時費力,成本高。一方面需要專門的處理機械,性能好的進口干熱處理機械非常昂貴,且商業種子量大,每次處理的種子量太多會影響機器內部通風,難以保證各部位溫度均勻一致,影響處理效果;另一方面,每次處理至少費時6 d,處理效率低。
蔡明,江冬,張麗英,李眷,張昆.2011.黃瓜綠斑駁花葉病毒種子處理試驗研究.植物檢疫,25(1):62-63.
陳紅運,趙文軍,程毅,李明福,朱水芳.2006.遼中地區花葉病病原的分子鑒定.植物病理學報,36(4):306-309.
孟姍姍,韓之琪,謝學文,柴阿麗,石延霞,李寶聚.2014.貯藏時間對干熱處理后帶菌黃瓜種子和病原菌的影響.華北農學報,29(s):71-76.
宋順華、吳萍,鄭曉鷹,丁海鳳.2011.干熱處理對蔬菜種子質量的影響及其殺菌效果研究.河南農業科學,40(4):117-119.
宋順華,吳萍,宮國義,孟淑春,耿麗華.2015.黃瓜綠斑駁花葉病毒在葫蘆上的種傳規律及熱處理效果評價.植物保護學報,42(5):841-847.
吳會杰,秦碧霞,陳紅運,彭斌,蔡建和,古勤生.2011.黃瓜綠斑駁花葉病毒西瓜、甜瓜種子的帶毒率和傳毒率.中國農業科學,44(7):1527-1532.
Hull R.2002.Matthews’ Plant Virology.Fourth ed.San Diego:Academic Press.
Imada S,Dan K.2002.Development of techniques for avoidance anddecrease of stresses on seeds by disinfection treatments//Ministry of Agriculture,Forest and Fisheries.Development of Methodsto Control Bacterial Fruit Blotch in Watermelons.Tokyo:Ministry of Agriculture,Forest and Fisheries:51-58.
Kim D H,Lee J M.2000.Seed treatment forCucumber green mottle mosaic virus(CGMMV)in gourd(Lagenaria siceraria)seeds and its detection.J Korea Soc Hort Sci,41:1-6.
Koenraadt H M S,Remeeus P M.2014.Detection of squash mosaic virus,Cucumber green mottle mosaic virusandMelon necrotic spot virusin cucurbits//International Seed Testing Association.International Rules for Seeding Testing.Annexe to Chapter 7:Seed Health Testing Methods.Switzerland:International Seed Testing Association.
Kubota M,Hagiwara N,Shirakawa T.2012.Disinfection of seeds of cucurbit crops infested withAcidovorax citrulliwith dry heat treatment.Journal of Phytopathology,160(7/8):364-368.
Shiomi T,Takeuchi S,Tezuka N.1991.Disinfection of cabbage seeds infested with the pathogen of black rot,Xanthomonas campestrispv.campestris,by hot air treatment.Bull Veg Orn Crop Res St,4:9-14.
Shirakawa T.2002.Development of treatment for seed disinfection//Ministry of Agriculture,Forest and Fisheries.Development of Methods to Control Bacterial Fruit Blotch in Watermelons.Tokyo:Ministry of Agriculture,Forest and Fisheries:35-51.
Stace-Smith R,Hamilton R I.1988.Inoculum thresholds of seedborne pathogens-viruses.Phytopathology,78:875-880.
Ullman D E,German T L,McIntosh C E,Williams D D F.1991.Effect of heat treatment on a closterovirus like particle associated with mealybug wilt of pineapple.Plant Dis,75:859-861.

