葉用萵苣磷轉(zhuǎn)運(yùn)蛋白LsPHT1基因的克隆及其在納米材料處理下的表達(dá)
汪玉潔 陳日遠(yuǎn) 劉厚誠(chéng) 宋世威 蘇 蔚 孫光聞
(華南農(nóng)業(yè)大學(xué)園藝學(xué)院,廣東廣州 510642)
磷是植物生長(zhǎng)發(fā)育所必需的大量營(yíng)養(yǎng)元素之一,在能量代謝、糖分代謝、酶促反應(yīng)和光合作用等過(guò)程中起著至關(guān)重要的作用,且是核酸、植素和卵磷脂的重要組成成分,在很大程度上決定了作物的產(chǎn)量和品質(zhì)(Lynch & Beebe,1995)。目前已報(bào)道的高等植物中的磷轉(zhuǎn)運(yùn)蛋白基因主要有4個(gè)家族:PHT1、PHT2、PHT3和 PHT4(Poirier &Bucher,2002;Guo et al.,2008),每個(gè)家族分別含有不同數(shù)量的成員。磷轉(zhuǎn)運(yùn)蛋白根據(jù)Km值可以分為低親和磷轉(zhuǎn)運(yùn)系統(tǒng)(low affinity)和高親和磷轉(zhuǎn)運(yùn)系統(tǒng)(high affinity)兩大類(Raghothama,1999;Gordonweeks et al.,2003)。近年來(lái)通過(guò)基因組測(cè)序和同源基因克隆等技術(shù)手段,從苜蓿、水稻、擬南芥、小麥、大麥、玉米、番茄、馬鈴薯、煙草、辣椒、茄子、百脈根、矮牽牛等的基因組中鑒定到多個(gè)編碼高親和磷轉(zhuǎn)運(yùn)蛋白基因(張曉,2014)。這些基因大多數(shù)屬于共轉(zhuǎn)運(yùn)體的PHT1家族,可能具有吸收土壤溶液中低濃度可溶性磷和在植物體內(nèi)運(yùn)輸?shù)墓δ埽↙in et al.,2009)。通過(guò)不同的生物信息學(xué)軟件預(yù)測(cè),PHT1家族的磷轉(zhuǎn)運(yùn)蛋白在結(jié)構(gòu)上具有高度的相似性(李立芹,2011)。大多數(shù)植物的高親和磷轉(zhuǎn)運(yùn)蛋白主要在根部表達(dá),有的磷酸鹽轉(zhuǎn)運(yùn)蛋白受缺磷誘導(dǎo),有的則受菌根誘導(dǎo),并且具有很高的特異性(Bucher,2007;Jain et al.,2007),這充分說(shuō)明了根系對(duì)植物磷素吸收和利用的重要性。
納米技術(shù)是20世紀(jì)80年代末誕生并崛起的高科技,對(duì)世界經(jīng)濟(jì)、工業(yè)和人們的生活產(chǎn)生了非常重要的影響。隨著納米材料研究的深入,其在植物上的應(yīng)用也越來(lái)越廣泛。越來(lái)越多的研究表明,納米材料能在一定程度上改善植株的生長(zhǎng)發(fā)育及其對(duì)營(yíng)養(yǎng)元素的吸收。噴施相同含硅量的納米硅藻土、納米二氧化硅后,莧菜干物質(zhì)量分別比對(duì)照提高43.4%和14.9%,氮磷鉀吸收總量分別提高36%和20%(裴福云 等,2015)。納米碳的加入還能提高土壤中堿解氮、速效磷、速效鉀的含量,并促進(jìn)玉米對(duì)N、P、K等養(yǎng)分的積累(王佳奇,2013)。劉秀梅(2005)研究表明,納米—亞微米級(jí)復(fù)合材料能提高作物對(duì)褐潮土、紅壤和風(fēng)沙土中氮、磷、鉀的吸收和利用,植株干質(zhì)量及氮、磷、鉀含量均顯著高于對(duì)照。
南方蔬菜生理與設(shè)施研究中心在前期關(guān)于納米材料對(duì)葉用萵苣生長(zhǎng)發(fā)育的生理研究中,發(fā)現(xiàn)納米材料可以顯著增加根系對(duì)N、P、K、Zn及地上部對(duì)N、P、K、Ca的吸收(李貴蓮 等,2015;蘇蔚等,2015),并在此基礎(chǔ)上進(jìn)行了轉(zhuǎn)錄組測(cè)序(Wang et al.,2017)。在分析轉(zhuǎn)錄組數(shù)據(jù)的過(guò)程中,發(fā)現(xiàn)與磷轉(zhuǎn)運(yùn)蛋白相關(guān)的unigenes在處理中上調(diào)表達(dá),因此本試驗(yàn)首先從葉用萵苣中克隆LsPHT1基因全長(zhǎng),對(duì)基因序列及其翻譯的氨基酸序列進(jìn)行分析;并對(duì)葉用萵苣進(jìn)行納米材料處理,結(jié)合半定量PCR和實(shí)時(shí)熒光定量PCR技術(shù)檢測(cè)納米材料處理下LsPHT1基因表達(dá)量,探討LsPHT1參與葉用萵苣響應(yīng)納米材料的作用特性,以期為進(jìn)一步研究納米材料影響葉用萵苣生長(zhǎng)發(fā)育的分子機(jī)理奠定基礎(chǔ)。
1 材料與方法
1.1 試驗(yàn)方法
供試葉用萵苣(Lactuca sativaL.)品種為耐抽薹意大利生菜,由廣東省農(nóng)業(yè)科學(xué)院蔬菜研究所提供,2015年10月13日在華南農(nóng)業(yè)大學(xué)園藝學(xué)院714培養(yǎng)箱內(nèi)催芽;種子萌芽后播于裝有珍珠巖的穴盤中,三葉一心時(shí)選擇均勻一致的幼苗移栽至裝有30 L 1/2 Hoagland全營(yíng)養(yǎng)液的水培箱中。供試納米材料為廣州市富陽(yáng)環(huán)保科技有限公司和華南農(nóng)業(yè)大學(xué)新肥料研究資源中心研制生產(chǎn)的納米膠片,主要成份是TiO2和ZnO,涂布于塑料片上,面積為14 cm×12 cm。
試驗(yàn)按每升營(yíng)養(yǎng)液中使用納米膠片的面積設(shè)置2個(gè)處理:CK,無(wú)納米膠片(0 cm2·L-1);T,1/2片納米膠片(2.80 cm2·L-1)。每處理18株,3次重復(fù),隨機(jī)排列。移栽后第25天,隨機(jī)采集3株未經(jīng)納米處理的葉用萵苣植株,分別將葉片和根系用液氮處理(樣品速凍t≥1 min)后-80 ℃冰箱保存,用于RNA提取和基因克隆;納米材料處理后第2、5、10、16、22、28、31、34天,分別于上午9:00隨機(jī)選取3株葉用萵苣植株,分別將葉片、根系用液氮速凍后保存于-80 ℃冰箱,用于目標(biāo)基因的表達(dá)分析。
1.2 試驗(yàn)試劑
Trizol試劑、所有引物合成及測(cè)序工作均由Invitrogen公司完成;反轉(zhuǎn)錄試劑盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real-time)、RACE試劑盒3′-Full RACE Core Set with PrimeScript RTase、DNA marker、PMD18-T 載體、SYBR Premix ExTaqMix購(gòu)自TaKaRa公司;瓊脂糖凝膠回收試劑盒購(gòu)自天根生化科技(北京)有限公司;用于DNA擴(kuò)增的2×SuperStar PCR Mix購(gòu)自Genestar公司;其他試劑均為國(guó)產(chǎn)分析純。
1.3 總RNA提取及cDNA第一鏈合成
采用Trizol法提取總RNA,利用核酸蛋白儀Nanodrop 2000測(cè)定OD260和OD280,根據(jù)OD260/OD280比值判斷RNA的質(zhì)量,采用瓊脂糖凝膠電泳檢測(cè)RNA的完整性。以樣品中的1 μg總RNA為模板,利用反轉(zhuǎn)錄試劑盒去除基因組DNA并反轉(zhuǎn)錄合成cDNA,作為半定量PCR和實(shí)時(shí)熒光定量PCR(q-PCR)的模板。
1.4 LsPHT1基因克隆及序列拼接
采用RACE(rapid amplification of cDNA ends)法克隆LsPHT1基因全長(zhǎng)cDNA。通過(guò)轉(zhuǎn)錄組測(cè)序獲得葉用萵苣磷轉(zhuǎn)運(yùn)蛋白基因的片段,根據(jù)此片段序列設(shè)計(jì)用于3′RACE的片段特異性引物(表1),其余操作完全按照RACE試劑盒的操作手冊(cè)進(jìn)行。利用DNASTAR軟件將擴(kuò)增得到的目的基因片段進(jìn)行拼接,獲得全長(zhǎng)cDNA。根據(jù)ORF兩端序列設(shè)計(jì)特異引物PHT1-F和PHT1-R,擴(kuò)增該基因的編碼區(qū)序列(coding sequences,CDs),PCR擴(kuò)增產(chǎn)物經(jīng)回收、純化,與PMD18-T Vector連接,轉(zhuǎn)化DH5α感受態(tài)細(xì)胞,藍(lán)白斑篩選后選取陽(yáng)性克隆,送賽默飛世爾科技(中國(guó))有限公司測(cè)序。擴(kuò)增結(jié)果測(cè)序后與拼接序列進(jìn)行比對(duì),最終證實(shí)獲得葉用萵苣磷轉(zhuǎn)運(yùn)蛋白LsPHT1基因全長(zhǎng)。

表1 試驗(yàn)所需引物序列
1.5 基因表達(dá)分析
納米材料處理后的葉用萵苣葉片和根系的總RNA提取方法同上。以葉用萵苣CAB作為內(nèi)參基因,半定量RT-PCR反應(yīng)體系為:cDNA 2.0 μL,10×buffer(含 Mg2+)2.0 μL,dNTPs Mixture(10 mmol·L-1)0.4 μL,TaqDNA polymerase(2 U·μL-1)0.2 μL,Primer-F 和 Primer-R(10 μmol·L-1)各1 μL,ddH2O補(bǔ)足至20 μL。反應(yīng)程序?yàn)椋?4 ℃預(yù)變性3 min;94 ℃變性30 s,53 ℃退火30 s,72℃延伸1 min,35個(gè)循環(huán);72 ℃延伸7 min,4 ℃保存。PCR產(chǎn)物用1.5%瓊脂糖凝膠電泳檢測(cè)。qRTPCR反應(yīng)在CFX96 Real-Time PCR Detection System(BioRad公司)擴(kuò)增儀上進(jìn)行,每個(gè)樣品重復(fù)3次。反應(yīng)體系為(10 μL):SYBR Premix ExTaqMix 5 μL,cDNA(30~35 ng·μL-1)4 μL,正向引物和反向引物的混合物(10 μmol·L-1)1 μL。反應(yīng)程序?yàn)椋?5 ℃預(yù)變性30 s;95 ℃變性5 s,60℃退火15 s,72 ℃延伸15 s,39個(gè)循環(huán);65 ℃加熱至 95 ℃,5 s。
1.6 序列分析
核苷酸序列和推導(dǎo)的氨基酸序列分別在NCBI網(wǎng)站(http://www.ncbi.nim.nih.gov/)進(jìn)行核苷酸序列比對(duì)(BLASTn)、氨基酸序列比對(duì)(BLASTp)和保守域預(yù)測(cè);利用ProtParam程序(http://au.expasy.org/tools/protparam.html)預(yù)測(cè)該氨基酸序列的分子量和理論等電點(diǎn)(pI);利用 SignaIP(http://www.cbs.dtu.dk/services/SignalP/)在線分析蛋白質(zhì)的信號(hào)肽;利用 Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)在線分析基因亞細(xì)胞定位;利用TMHMM Server v2.0(http://www.cbs.dtu.dk/services/TMHMM/)對(duì)蛋白質(zhì)進(jìn)行跨膜分析;利用DNAMAN軟件進(jìn)行氨基酸序列比對(duì);利用MEGA 5.0軟件構(gòu)建系統(tǒng)發(fā)育樹。
2 結(jié)果與分析
2.1 LsPHT1的cDNA克隆
采用Trizol法提取總RNA,OD260/OD280比值在1.8~2.0之間;采用1.2%瓊脂糖凝膠電泳檢測(cè)RNA質(zhì)量,18 S和28 S兩條核糖體清晰,質(zhì)量較好,可以用于后續(xù)試驗(yàn)。
根據(jù)已獲得的葉用萵苣轉(zhuǎn)錄組數(shù)據(jù),以葉用萵苣cDNA為模板,利用特異性引物GSP1和GSP2進(jìn)行半巢式3′RACE擴(kuò)增,獲得1條大小為703 bp的cDNA片段(圖1-a)。根據(jù)所得序列拼接后的序列設(shè)計(jì)引物擴(kuò)增全長(zhǎng),得到大小為1 605 bp的基因片段(圖1-b)。

圖1 LsPHT1的PCR擴(kuò)增圖譜
2.2 LsPHT1序列分析
通過(guò)DNASTAR軟件分析得到1個(gè)cDNA的全長(zhǎng)為1 884 bp,具有1個(gè)完整的開放閱讀框,共1 605 bp,編碼534個(gè)氨基酸(圖2)。核苷酸序列比對(duì)結(jié)果表明,該基因的核苷酸序列與菊花(登錄號(hào):KC812501.1)同源性為81%,與煙草(登錄號(hào):XM_009766934.1)同源性為75%,推測(cè)克隆獲得的基因?yàn)槿~用萵苣磷轉(zhuǎn)運(yùn)蛋白基因,命名為L(zhǎng)sPHT1,序列已提交NCBI,登陸號(hào)為KY305670。
利用ProtParam程序預(yù)測(cè)該氨基酸序列分子量為58.5 kD,理論pI值8.68。推測(cè)該蛋白分子式為。推導(dǎo)的蛋白不穩(wěn)定系數(shù)為38.35,屬于穩(wěn)定蛋白;親水性/疏水性分析顯示,疏水區(qū)域明顯大于親水區(qū)域,說(shuō)明疏水性較強(qiáng),為疏水性蛋白。利用SignaIP檢測(cè)該蛋白不含信號(hào)肽序列,無(wú)分泌蛋白;存在11個(gè)跨膜區(qū),屬于跨膜蛋白。亞細(xì)胞定位分析表明主要定位在細(xì)胞膜上。通過(guò)NPS程序?qū)Φ鞍仔蛄羞M(jìn)行二級(jí)結(jié)構(gòu)分析,LsPHT1蛋白由α螺旋、無(wú)規(guī)則卷曲和延伸鏈等結(jié)構(gòu)元件組成,其中α螺旋所占比例最高,為53.00%;其次為無(wú)規(guī)則卷曲和延伸鏈,分別為35.96%和11.05%。對(duì)推測(cè)的LsPHT1氨基酸序列進(jìn)行保守域分析,顯示該序列包含1個(gè)從第25位氨基酸到504位氨基酸的保守域MFS superfamily和PHT1家族的保守特征序列:GGDYPLSATIxSE。
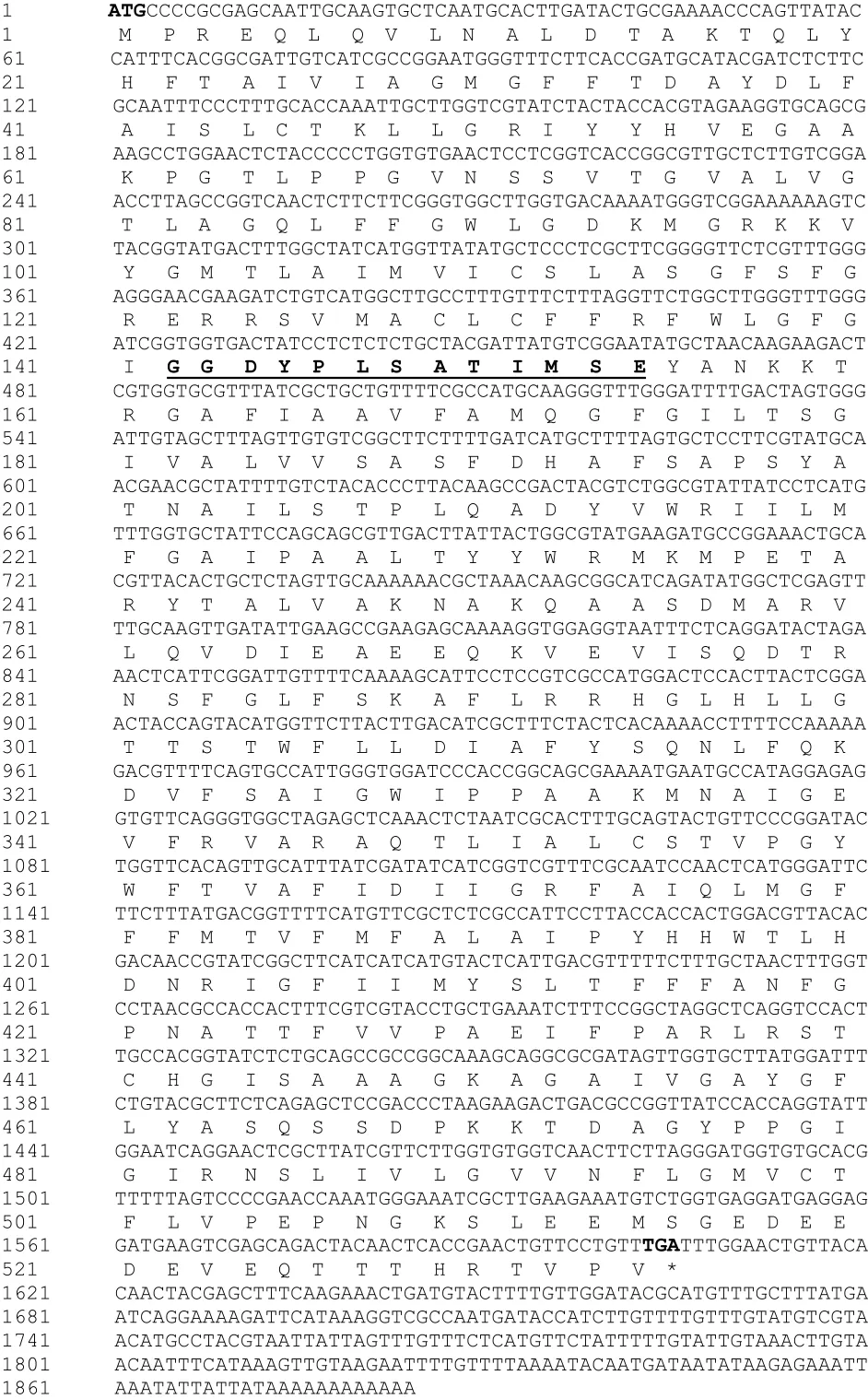
圖2 LsPHT1 cDNA序列及其推測(cè)的氨基酸序列
利用DNAMAN軟件與其他植物的PHT氨基酸序列進(jìn)行比對(duì),表明該基因與擬南芥、番茄、菊花、葡萄等多種植物的PHT高度同源(圖3),其中與菊花氨基酸序列(登錄號(hào):AGK29560.1)同源性高達(dá)88%,與葡萄氨基酸序列(登錄號(hào):XP_010650086.1)同源性高達(dá)80%,充分說(shuō)明植物體內(nèi)PHT的高度保守性。
為進(jìn)一步了解葉用萵苣PHT和其他植物之間的親緣關(guān)系,利用軟件MEGA 5.0,通過(guò)NCBI Blast比對(duì),將LsPHT1序列推測(cè)的氨基酸序列與數(shù)據(jù)庫(kù)中已登錄的9種PHT氨基酸序列構(gòu)建(bootstrap)系統(tǒng)進(jìn)化樹。從氨基酸序列系統(tǒng)進(jìn)化樹可以看出(圖4),該基因與菊花PHT親緣關(guān)系最近,二者同屬于菊科植物;與番茄的同源關(guān)系較近。

圖3 LsPHT1氨基酸序列比對(duì)結(jié)果
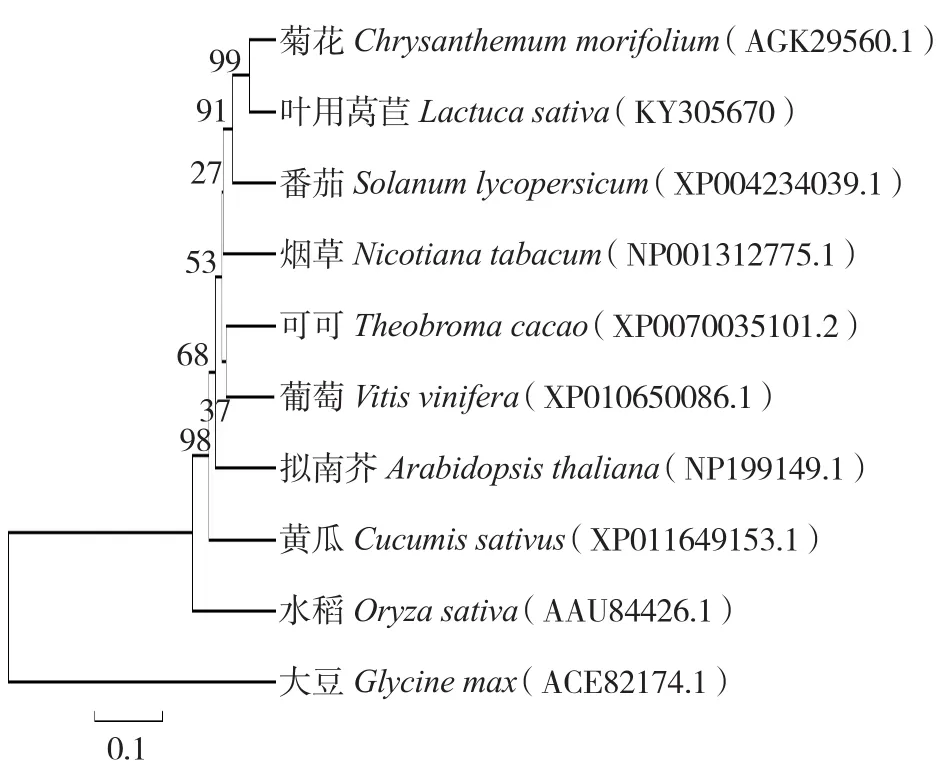
圖4 LsPHT1氨基酸序列系統(tǒng)進(jìn)化樹
2.3 LsPHT1基因表達(dá)特性分析
以葉用萵苣根系和葉片第一鏈cDNA為模板,以LsCAB為內(nèi)參基因,進(jìn)行半定量RT-PCR擴(kuò)增。結(jié)果表明,LsPHT1僅在根部表達(dá),在葉片中表達(dá)微弱(圖5)。
實(shí)時(shí)熒光定量PCR檢測(cè)結(jié)果與RT-PCR檢測(cè)結(jié)果相似,LsPHT1同樣只在葉用萵苣根部有較高的表達(dá),而在葉片中的表達(dá)量極低(圖6)。
從圖7可以看出,在葉用萵苣全生長(zhǎng)期內(nèi),LsPHT1基因的表達(dá)量呈先上升后下降的變化趨勢(shì);在納米材料處理第22天(即11月23日),該基因的表達(dá)量達(dá)到最大值。在生長(zhǎng)中后期,納米材料處理的葉用萵苣根部LsPHT1的表達(dá)量顯著高于對(duì)照,說(shuō)明該基因的表達(dá)受納米材料的誘導(dǎo)上調(diào)。
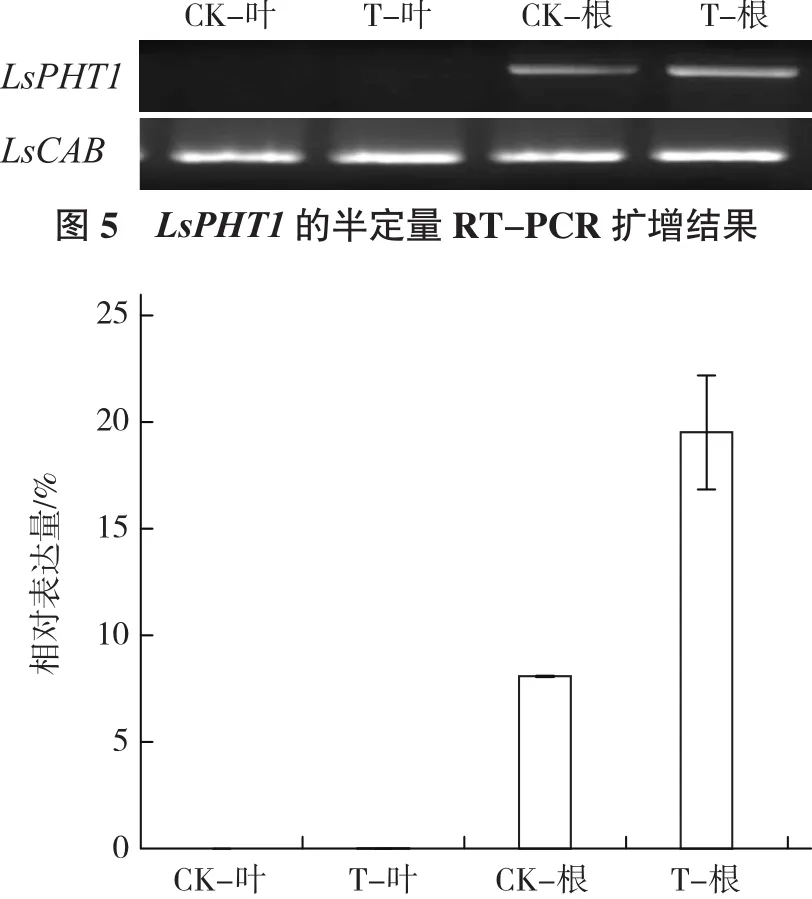
圖6 LsPHT1的實(shí)時(shí)熒光定量PCR檢測(cè)結(jié)果
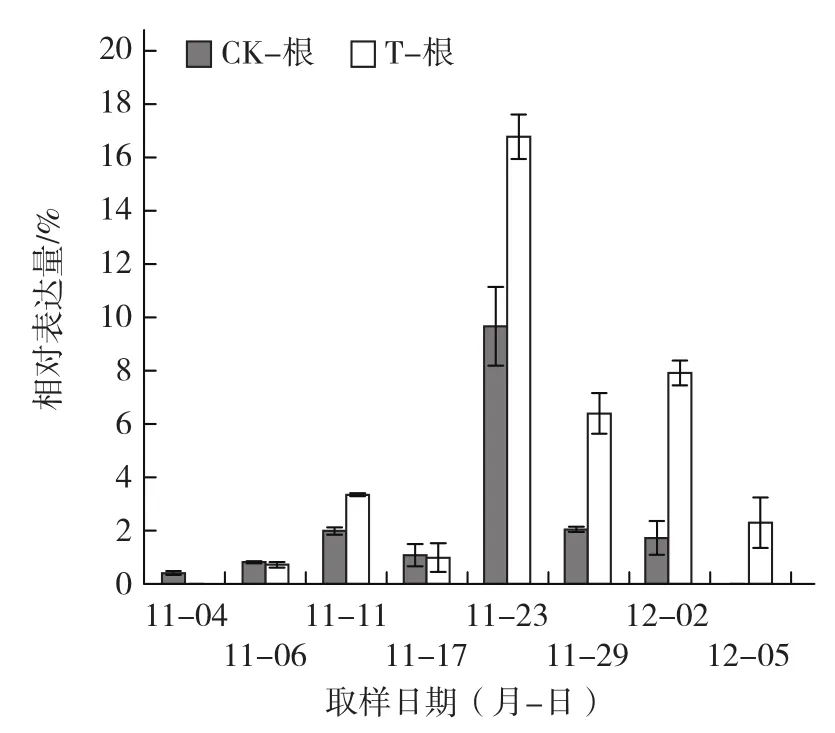
圖7 葉用萵苣不同生長(zhǎng)時(shí)期根部LsPHT1的表達(dá)
3 結(jié)論與討論
磷是植物體內(nèi)核酸、磷脂和ATP的重要組成成分,并且作為植物體內(nèi)能量轉(zhuǎn)移物質(zhì),能夠活化體內(nèi)蛋白質(zhì),調(diào)控植物體內(nèi)的整個(gè)代謝過(guò)程(Marschner,1995)。植物中的磷轉(zhuǎn)運(yùn)蛋白基因是一個(gè)小基因家族,具有高度的保守性(王萍 等,2006)。根據(jù)動(dòng)力學(xué)參數(shù)Km,高親和力磷轉(zhuǎn)運(yùn)系統(tǒng)Km值在7 μmol·L-1左右,而低親和力磷轉(zhuǎn)運(yùn)系統(tǒng)Km值在50~330 μmol·L-1之間(Schachtman et al.,1998)。絕大部分已經(jīng)克隆出來(lái)的植物磷轉(zhuǎn)運(yùn)蛋白基因?qū)儆贖+/H2PO4-共轉(zhuǎn)運(yùn)體的PHT1家族,都屬于高親和力的磷轉(zhuǎn)運(yùn)蛋白基因,即利用質(zhì)膜上的氫離子濃度梯度來(lái)驅(qū)動(dòng)植株對(duì)磷素的吸收,后者又歸屬于一個(gè)更大的溶質(zhì)轉(zhuǎn)運(yùn)蛋白家族MFS(Raghothama,2000),這一家族的基因負(fù)責(zé)磷吸收和體內(nèi)轉(zhuǎn)運(yùn)的基本過(guò)程。它們?cè)诮Y(jié)構(gòu)上有著關(guān)鍵的相似性,都是膜整合蛋白,由12個(gè)疏水的跨膜區(qū)域組成(Robards & Lucas,1988)。本試驗(yàn)成功克隆了葉用萵苣的磷轉(zhuǎn)運(yùn)蛋白基因,命名為L(zhǎng)sPHT1。對(duì)其氨基酸序列進(jìn)行保守域分析顯示,該序列包含MFS超家族的保守結(jié)構(gòu)域和PHT1家族的保守特征序列:GGDYPLSATIxSE(李立芹,2011)。對(duì)其進(jìn)行跨膜分析顯示,葉用萵苣磷轉(zhuǎn)運(yùn)蛋白基因在跨膜數(shù)上與其他植物略有不同,據(jù)研究,玉米(Zea mays)磷轉(zhuǎn)運(yùn)蛋白ZmPT1~ZmPT9(ZmPT5除外)的跨膜區(qū)域數(shù)量在4~6個(gè)之間(張立軍,2011),小麥(Triticum aestivum)磷轉(zhuǎn)運(yùn)蛋白TaPT1~TaPT11的跨膜區(qū)域數(shù)量在3~15個(gè)之間(鄭飛,2009),而LsPHT1蛋白的跨膜區(qū)域預(yù)測(cè)有11個(gè),這說(shuō)明在植物演化過(guò)程中跨膜區(qū)域的數(shù)量出現(xiàn)了變化(曹慶芹 等,2013)。綜合氨基酸序列同源性分析和系統(tǒng)進(jìn)化樹分析結(jié)果,LsPHT1均與菊花PHT基因同源性最高,因此推測(cè)該基因?qū)儆谥参颬HT基因家族成員。LsPHT1基因的獲得,將有助于進(jìn)一步研究葉用萵苣響應(yīng)納米材料的作用機(jī)制,深入了解納米材料處理下葉用萵苣對(duì)磷素吸收的機(jī)理。
納米材料發(fā)射出遠(yuǎn)紅外射線(周延懷和馮玉英,2000),使水由大分子團(tuán)變?yōu)樾》肿訄F(tuán),其溶解力、pH等性質(zhì)發(fā)生變化,經(jīng)納米材料處理的水具有較高的溶解力,磷溶解力的提高對(duì)于作物磷營(yíng)養(yǎng)有明顯的影響(曹玉江 等,2006)。納米材料處理對(duì)植物的磷素吸收有促進(jìn)作用這一結(jié)論在本試驗(yàn)前期工作(Wang et al.,2015)以及許多植物的生理試驗(yàn)上已經(jīng)得到驗(yàn)證。本試驗(yàn)中,納米材料處理的葉用萵苣全生長(zhǎng)期內(nèi),LsPHT1基因的表達(dá)量呈先上升后下降的變化趨勢(shì);在處理后第22天,該基因的表達(dá)量達(dá)到最大值,這可能是由于隨著時(shí)間的變化,水培箱中的磷素逐漸被消耗,在缺磷條件下植物主要通過(guò)活化介質(zhì)中的磷并提高介質(zhì)中有效磷的吸收能力來(lái)適應(yīng)低磷脅迫(張斌和秦嶺,2010),即植株需通過(guò)上調(diào)磷轉(zhuǎn)運(yùn)蛋白基因的表達(dá)來(lái)獲得生長(zhǎng)所需的磷素。在葉用萵苣生長(zhǎng)中后期,納米材料處理的植株根部LsPHT1的表達(dá)量顯著高于對(duì)照,表明納米材料能夠誘導(dǎo)LsPHT1的表達(dá)。
曹慶芹,鄧杰,朱麗靜,白雋帆,趙天,朱旭文,姜奕晨,邢宇,秦嶺.2013.‘紅顏’草莓菌根磷轉(zhuǎn)運(yùn)蛋白基因的克隆及熒光定量表達(dá)分析.園藝學(xué)報(bào),40(4):641-650.
曹玉江,劉安勛,廖宗文,黎永洪.2006.納米材料對(duì)玉米磷營(yíng)養(yǎng)的影響初探.生態(tài)環(huán)境,15(5):1072-1074.
李貴蓮,陳日遠(yuǎn),劉厚誠(chéng),宋世威,孫光聞.2015.納米膠片處理對(duì)生菜生長(zhǎng)及元素吸收的影響.江蘇農(nóng)業(yè)科學(xué),43(11):237-238.
李立芹.2011.農(nóng)作物Pht1家族磷轉(zhuǎn)運(yùn)體蛋白的生物信息學(xué)分析.作物雜志,(3):20-24.
劉秀梅.2005.納米—亞微米級(jí)復(fù)合材料性能及土壤植物營(yíng)養(yǎng)效應(yīng)〔博士論文〕.北京:中國(guó)農(nóng)業(yè)科學(xué)院.
裴福云,董超文,陳文哲,楊勇,房欽飛,段繼賢,黃培釗,王德漢.2015.納米硅肥的制備及對(duì)莧菜生長(zhǎng)的影響.園藝與種苗,(6):12-17.
蘇蔚,李貴蓮,陳日遠(yuǎn),劉厚誠(chéng),宋世威,孫光聞.2015.納米膠片對(duì)水培生菜不同生長(zhǎng)期NPK吸收轉(zhuǎn)運(yùn)的影響.貴州農(nóng)業(yè)科學(xué),43(8):138-140.
王佳奇.2013.納米碳對(duì)玉米生長(zhǎng)及養(yǎng)分吸收的影響〔碩士論文〕.哈爾濱:東北農(nóng)業(yè)大學(xué).
王萍,陳愛群,余玲,徐國(guó)華.2006.植物磷轉(zhuǎn)運(yùn)蛋白基因及其表達(dá)調(diào)控的研究進(jìn)展.植物營(yíng)養(yǎng)與肥料學(xué)報(bào),12(4):584-591.張斌,秦嶺.2010.植物對(duì)低磷脅迫的適應(yīng)及其分子基礎(chǔ).分子植物育種,8(4):776-783.
張立軍.2011.小麥磷轉(zhuǎn)運(yùn)蛋白基因的分子特征和生物學(xué)功能研究〔碩士論文〕.保定:河北農(nóng)業(yè)大學(xué).
張曉.2014.磷酸鹽轉(zhuǎn)運(yùn)蛋白OsPT5/OsPT7與質(zhì)子焦磷酸酶AVP1D影響植物磷素吸收轉(zhuǎn)運(yùn)和生長(zhǎng)發(fā)育的機(jī)制研究〔博士論文〕.南京:南京農(nóng)業(yè)大學(xué).
鄭飛.2009.玉米磷轉(zhuǎn)運(yùn)蛋白基因同源序列克隆與分析〔碩士論文〕.雅安:四川農(nóng)業(yè)大學(xué).
周延懷,馮玉英.2000.GeO2—SiO2納米復(fù)合材料的合成及其光學(xué)特性研究.光譜學(xué)與光譜分析,20(1):23-24.
Bucher M.2007.Functional biology of plant phosphate uptake at root and mycorrhiza interfaces.New Phytologist,173(1):11-26.
Gordonweeks R,Tong Y,Davies T G E,Leggewie G.2003.Restricted spatial expression of a high-affinity phosphate transporter in potato roots.Journal of Cell Science,116(15):3135-3144.
Guo B,Jin Y,Wussler C,Blancaflor E B,Motes C M,Versaw W K.2008.Functional analysis of theArabidopsisPHT4 family of intracellular phosphate transporters.New Phytologist,177(4):889-898.
Jain A,Vasconcelos M J,Raghothama K G,Sahi S V.2007.Molecular mechanisms of plant adaptation to phosphate deficiency.Plant Breeding Reviews,29:359-419.
Lin W Y,Lin S I,Chiou T J.2009.Molecular regulators of phosphate homeostasis in plants.Journal of Experimental Botany,60(5):1427-1438.
Lynch J P,Beebe S E.1995.Adaptation of beans(Phaseolus VulgarisL.)to low phosphorus availability.Hortscience a Publication of the American Society for Horticultural Science,30(6):1165-1171.
Marschner H.1995.Mineral nutrition of higher plants.Journal of Ecology,76(4):1250.
Poirier Y,Bucher M.2002.Phosphate transport and homeostasis inArabidopsis.Arabidopsis Book,1(e0024):1-35.
Raghothama K G.1999.Phosphate acquisition.Plant Biology,274(50):37-49.
Raghothama K G.2000.Phosphate transport and signaling.Current Opinion in Plant Biology,3(3):182-187.
Robards A W,Lucas W J.1988.Annual review of plant physiology and plant molecular biology.Annual Reviews Inc,154(5):643-668.
Schachtman D P,Reid R J,Ayling S M.1998.Phosphorus uptake by plants:from soil to cell.Plant Physiology,116(2):447-453.
Wang Y J,Chen R Y,Liu H C,Song S W,Su W,Sun G W.2015.Effects of nano-devices on growth and major elements absorption of hydroponic lettuce.Guangzhou:Internation Conference on Energy,Environment and Materials Science.
Wang Y J,Chen R Y,Hao Y W,Liu H C,Song S W,Sun G W.2017.Transcriptome analysis reveals differentially expressed genes(DEGs)related to lettuce(Lactuca sativa)treated by TiO2/ZnO nanoparticles.Plant Growth Regulation,83(1):13-25.

