NEFA BHBA對體外培養牛肝細胞的HP和SAA mRNA表達的影響
宰 翔,于嘯洋,于孔森,李明皓,張國慶,王 佟,郝景鋒
(吉林農業科技學院,吉林 吉林 132101)
奶牛酮病發生過程中由于機體處于能量負平衡狀態,脂肪動員加劇,在此過程中產生大量的非酯化脂肪酸(NEFA),而這些物質的生成速度遠遠超過了肝臟通過氧化代謝排出的速度,以生成甘油三酯的形式在肝臟內蓄積[1],會對肝臟產生較大刺激,由于這種應激性因素的作用,會對由肝臟合成的急性期反應蛋白HP和SAA產生較大影響,但具體會產生哪些變化目前還不清楚,NEFA以及BHBA作為機體中間代謝產物,在酮病發生時,它們的濃度會發生顯著的變化,肝臟作為脂類物質的主要代謝器官,起著重要的作用,而NEFA和BHBA可能是脂類代謝關鍵的調節因素。眾多的研究者采用了熒光定量PCR法檢測了在長途運輸以及炎癥產物的刺激下對各種動物的急性期反應蛋白的表達的影響,取得了令人滿意的效果。
本研究采用的是利用貼壁法[2]培養新生犢牛原代肝細胞,于培養72 h通過添加(0、0.6、1.2、2.4 mmol/L)NEFA 以及(0、0.6、1.2、2.4 mmol/L)BHBA,培養24 h后收樣,無菌提取肝細胞總RNA,反轉錄為cDNA,通過熒光定量PCR法測定NEFA、BHBA對體外培養牛肝細胞的HP和SAA mRNA表達的影響,通過體外試驗進一步驗證NEFA、BHBA等代謝產物對急性期反應蛋白HP、SAA表達的影響,為進一步揭示奶牛酮病發病機理、奶牛酮病時機體免疫狀態以及合理有效治療與預防奶牛酮病奠定一定的理論依據和試驗基礎。
1 材料與方法
1.1 試驗材料 載體及宿主菌pMD-18T Vector,購自TaKaRa公司;E.coli DH5α宿主菌為吉林大學動物營養代謝與中毒病實驗室自制。
1.2 試劑 肝細胞6孔培養板,購自Gibco公司;低糖DMED培養基,HEPES,新生牛血清,以及Ⅳ型膠原酶等,均購自Gibco公司;TRIZol RNA提取試劑盒,購自Invitrogen公司;Tris和X-gal為Promega產品;焦磷酸二乙酯(DEPC),購自Sigma公司;多聚賴氨酸、胰島素均系Sigma公司產品;標準分子量DNA Marker DL-2 000(分子量為100~2 000 bp)、DNA凝膠回收試劑盒、dNTPs(2.5 mmol/L each)、反轉錄酶AMV、ExTaq DNA聚合酶、Oligo dT、RNase Inhibitor、限制性內切酶,購自TaKaRa公司。
1.3 肝細胞的分離與培養 肝細胞分離與培養采用貼壁法[2]。
1.4 試驗分組 試驗分為8組包括BHBA(0、0.6、1.2、2.4 mmol/L)[5]和 NEFA(0、0.6、1.2、2.4 mmol/L)組。
1.5 引物的設計和合成 從GenBank中查閱出奶牛的HP、SAA基因序列,利用Primer Express 5.0設計軟件進行引物設計,由長春華大中天生物技術有限公司合成。目的基因引物的設計見表1。

表1 PCR引物
1.6 肝臟組織中RNA提取 小牛肝臟組織50~100 mg,加入適量液氮研磨,收集至1.5 mL離心管中,分別加入TRIZol和氯仿,取上清液加入等量的異丙醇,加入75%乙醇沉淀后DEPC處理[3],樣品放入-80℃保存。
1.7 樣品RNA反轉錄 具體方法根據反轉錄試劑盒說明書進行(TaKaRa)。
1.8 PCR擴增基因以上反應得cDNA為模板,進行PCR擴增,體系見表2。

表2 PCR反應體系
PCR反應條件見表3。
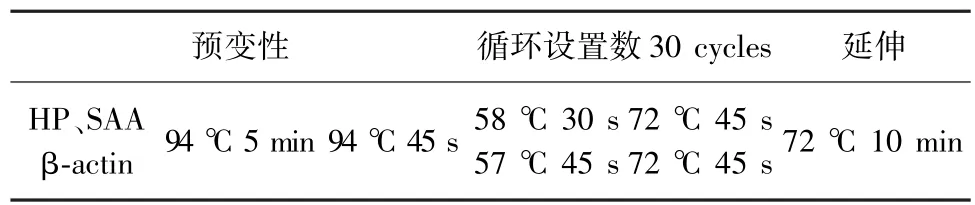
表3 PCR反應條件
1.9 PCR產物回收 PCR產物回收選用的是AxyPrep DNA膠回收試劑盒,按試劑盒操作說明書進行操作。
1.10 目的基因克隆 首先將目的基因與載體連接。構建成重組克隆質粒 pMD-SAA、pMD-HP、pMD-β-actin連接反應體系見表4。

表4 連接反應體系
1.11 重組質粒轉化 取上述4管感受態細胞,分別加入5 μL 連接產物(空載體、pMD-HP、pMD-SAA和pMD-β-actin),靜止30 min后42℃水浴加熱1 min[4],放置冰上(4℃)后加入LB液體培養基置于37℃搖床中培養。
1.12 重組質粒的PCR鑒定 PCR鑒定以上提取的質粒,對照選取陰性質粒。反應物用瓊脂糖凝膠電泳法進行鑒定。
1.13 SAA、HP、β-actin基因序列測定 將鑒定正確的陽性質粒送到生工生物工程(上海)股份有限公司進行核苷酸序列測定。對測序結果進行BLAST比對確定引物是否設計符合要求。
1.14 樣品中HP、SAA mRNA水平的定量檢測HP、SAA以及β-actin基因的熒光定量PCR反應條件體系見表5,反應條件見表6。

表5 RT-qPCR反應體系

表6 RT-qPCR反應條件
1.15 數據分析 數據用X-±SD表示,用SPSS 13.0軟件進行分析,組間差異顯著性用ANOVA(方差分析)。
2 試驗結果
2.1 肝細胞總RNA的提取 如圖1所示,自肝細胞中提取的總RNA通過1%瓊脂糖凝膠電泳進行鑒定,出現完整的3條帶,分別是5 S、18 S以及28 S,條帶清晰可見,沒有出現明顯的降解,符合反轉錄的基本要求,并且A260/A280值均為1.9,符合試驗對于純度的需求,可以滿足熒光定量PCR的要求。
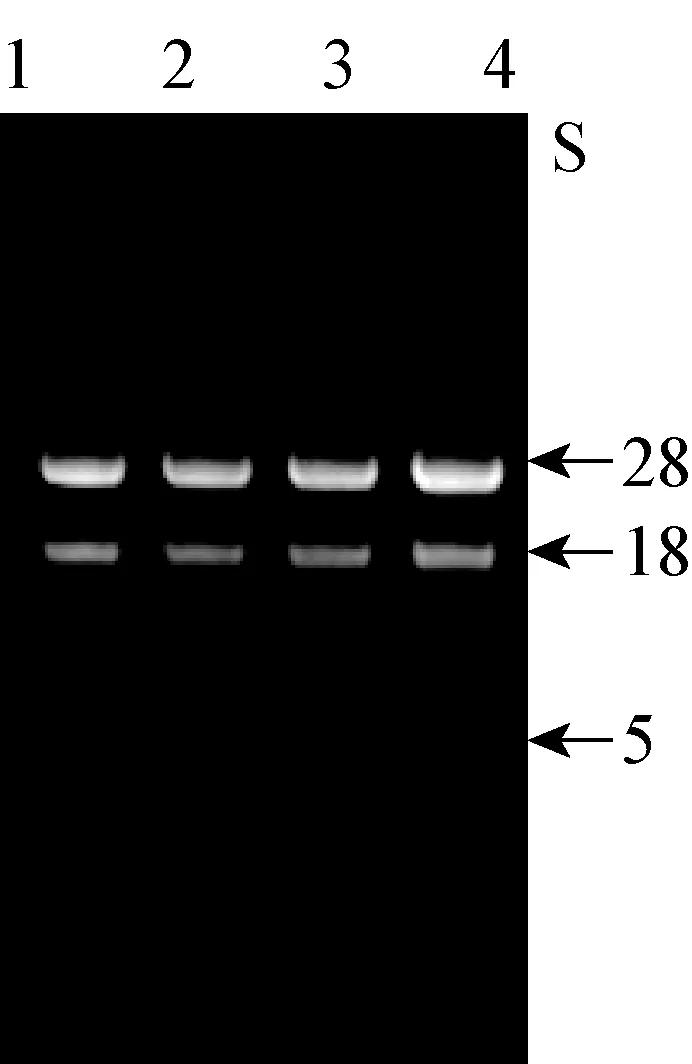
圖1 肝細胞總RNA電泳圖譜圖
2.2 目的基因的PCR結果 通過PCR對目的基因進行確定,結果如圖2、3、4所示。β-actin PCR擴增結果在101 bp,HP基因PCR擴增結果在165 bp,SAA基因PCR擴增結果在127 bp。
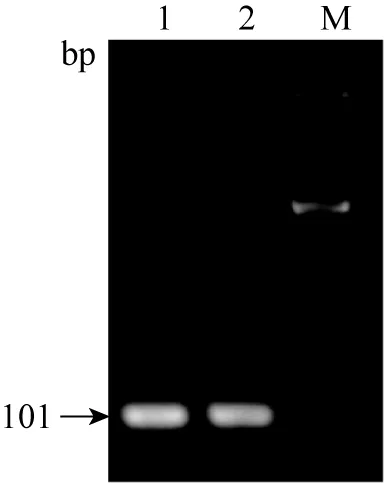
圖2 內參β-actin PCR擴增結果

圖3 HP基因PCR擴增結果
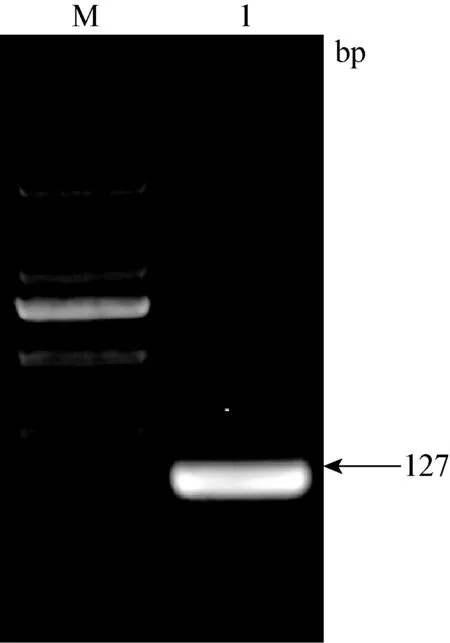
圖4 SAA基因PCR擴增結果
2.3 犢牛肝細胞不同時間的形態學 見中插彩版圖5~8。
2.4 不同濃度梯度的NEFA對體外培養牛肝細胞中HP、SAA mRNA表達影響 由圖9、圖10以及表7統計分析可見:在刺激因子NEFA作用下,HP基因的相對表達倍數明顯增高,其中中等濃度處理組與對照組差異極顯著(P<0.01),中高濃度處理組與對照組差異顯著(P<0.05),高濃度處理組與對照組差異不顯著(P>0.05)。試驗結果表明,中等濃度NEFA能促進肝細胞中HP的表達;在刺激因子NEFA作用下,中等濃度處理組可以促進進肝細胞中SAA基因的表達,其中0.6 mmol/L處理組與對照組差異顯著(P<0.05),而1.2 mmol/L處理組與對照組差異極顯著(P<0.01),說明中等程度的NEFA能促進犢牛肝細胞中SAA表達,高濃度刺激物對肝細胞中SAA的表達無明顯的影響。

表7 NEFA對體外培養原代肝細胞HP、SAA mRNA相對表達量的影響
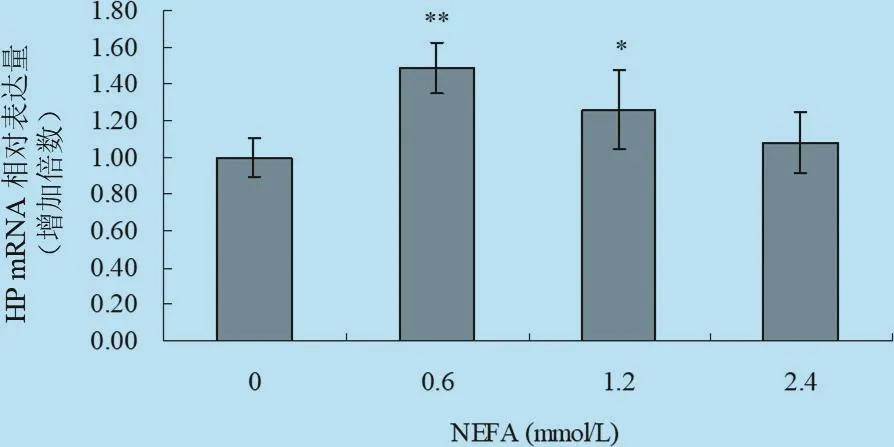
圖9 NEFA對體外培養原代肝細胞HP mRNA轉錄水平的影響
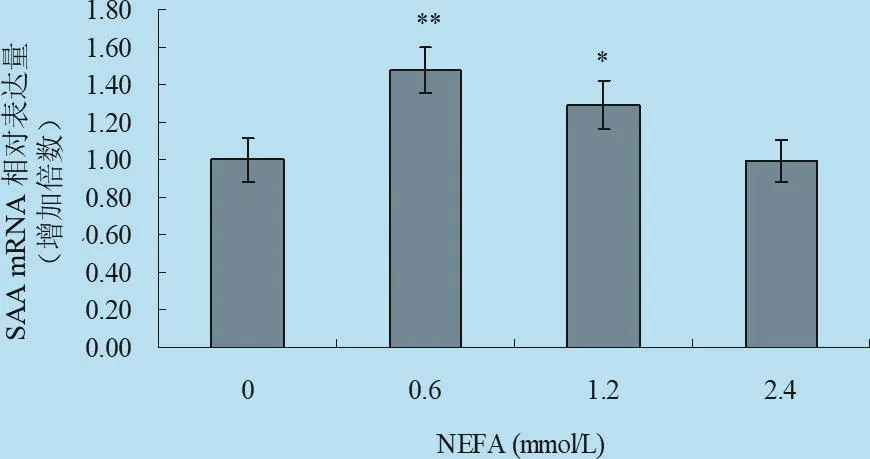
圖10 NEFA對體外培養原代肝細胞SAA mRNA轉錄水平的影響
2.5 不同濃度梯度的BHBA對體外培養牛肝細胞中HP、SAA mRNA表達影響 由以圖11、圖12以及表8所示:在刺激因子BHBA作用下,HP基因表達出現了一定程度的減少,其中中等濃度處理組表現出抑制作用,且中等程度處理組與對照組均表現差異顯著(P<0.05),而2.4 mmol/L的BHBA處理組與對照組比較無明顯差異(P>0.05),說明中等濃度的BHBA對HP基因的表達具有抑制作用,高濃度的BHBA對HP基因的表達影響較小;BHBA作為刺激因子對SAA基因的表達影響較小,只是在0.6 mmol/L的BHBA處理組與對照組差異顯著(P<0.05),但總體趨勢為抑制作用。
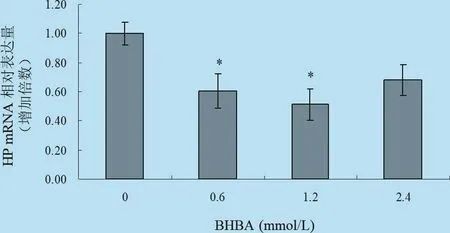
圖11 BHBA對體外培養肝細胞HP mRNA轉錄水平的影
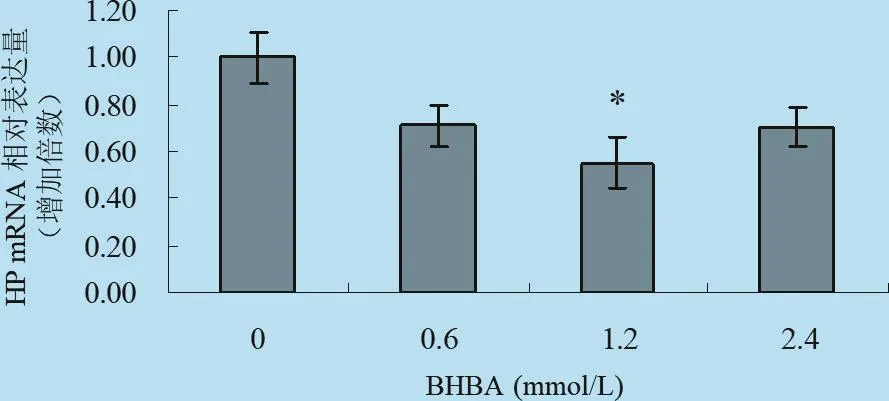
圖12 BHBA對體外培養肝細胞SAA mRNA轉錄水平的影響

表8 BHBA對體外培養原代肝細胞HP、SAA mRNA相對表達量的影響
3 討論與分析
NEFA是調控機體脂肪、蛋白質、糖類等物質代謝過程的重要影響因素,也是奶牛能量負平衡(NEB)的主要標志[5],生理狀態下,奶牛在生產時NEFA濃度一般可以達到1 mmol/L[6],酮病發生時,由于NEB引起脂肪動員,NEFA水平升高,過多的NEFA在肝臟內代謝對機體較大的刺激,但對于急性期蛋白HP、SAA在肝臟中表達是否會產生影響未見報道。
HP、SAA是奶牛在炎癥、應激以及感染過程中產生的急性期反應蛋白,HP主要由肝臟合成,后期研究發現,在腦、脾、食道、腸、腎等器官中也有所表達[7],而且不同部位表達量有所不同,在炎癥刺激下,HP mRNA表達量在大鼠肺、肝、腎以及脾內均有不同程度增加,然而在相同炎癥刺激下,HP mRNA表達量在大鼠睪丸內卻下降了4倍[8],研究發現,HP在奶牛乳房炎發生時表達增加明顯,可以作為奶牛乳房炎的判定指標和預后判斷依據[9];SAA既可以在脂肪組織中合成,也可以在肝臟中合成,在肝臟中合成更具優勢[10],對于SAA這種急性期反應蛋白目前研究較多的是關于它對奶牛乳房炎的研究以及其對肥胖以及糖尿病的研究。
在本次試驗中,經刺激因子NEFA在0.6 mmol/L以及1.2 mmol/L時對體外培養犢牛肝細胞HP基因的表達具有促進作用,其中中低濃度處理組與對照組差異極顯著,促進作用更為明顯,而高濃度處理組對HP基因幾乎不產生影響,可能是高濃度對HP具有一定的抑制作用,需進一步驗證;對于SAA基因的作用與HP基因的作用相當,中等程度對SAA基因的表達具有促進作用,其中中低濃度0.6 mmol/L處理組促進作用更為突出,說明在NEFA添加物的作用下,急性期反應蛋白HP、SAA的表達具有上升趨勢。

