羊猝狙的多重PCR診斷及病原分離株生物學特性試驗
李生慶,張西云,黃 榮,劉懷新,河生德,祁 果,胡國元,王亭亭,李積良
(1.青海大學畜牧獸醫科學院,青海 西寧 810016;2.青海省海晏縣獸醫站,青海 海晏 810018;3.青海省祁連縣野牛溝鄉畜牧獸醫站,青海 祁連 810400)
2017年7月,青海省海北州海晏縣青海湖鄉德吉村牧民養殖的羊發生急性死亡,臨床癥狀表現為病羊出現腹脹嚴重,并在2 h內死亡 ,其他無明顯特征。剖檢心、肝、脾、腎、肺無明顯病理變化,小腸出血明顯,部分腸段呈血紅色,回盲口、盲腸大面積出血。截止送檢,已死亡羊17只,造成較大經濟損失。根據臨床癥狀,該地區疫病發生流行病學狀況,初步懷疑此次疫病由產氣莢膜梭菌引起。
產氣莢膜梭菌(Clostridium perfringens),是引起畜禽猝死癥、壞死性腸炎、腸毒血癥、氣性壞疽的主要致病菌[1]。 該菌分 A、B、C、D、E 5個不同的菌型[2],致病性主要與其毒素有關,其產生的毒素共有12種。其中α毒素是由一種5個菌型均產生的壞死、致死性毒素,有人認為其是 家畜“猝死癥”的主要致病因子[3-4]。由產氣莢膜梭菌引起的羊猝死癥,主要發生于羊的毒血癥,包括羊猝狙、羊腸毒血癥、羔羊痢疾等。由于產氣莢膜梭菌為土壤常在菌,病原菌隨飼料和飲水被羊食入,可長期存在于腸道中,當消化道機能受到損壞時,病原菌迅速繁殖并產生大量毒素,從而使羊發病死亡,因此,很難在胃腸道之外的其他臟器內分離到病原菌,這給該病的診斷工作增加了難度。
鑒于此,我們根據產氣莢膜梭菌所產毒素不同,設計具有特異性的擴增引物,進行了PCR診斷,并結合實驗室常規診斷,確定此次疫病是由C型產氣莢膜梭菌引起的羊瘁疽。此次診斷中,利用產氣莢膜梭菌所產的α、β、ε三種主要毒素,建立的產氣莢膜梭菌多重PCR方法,可在很大程度上降低診斷的難度,并可節省時間,提高疫病診斷的精確性。
1 材料
1.1 病料來源:2017年7月,由青海省海北州海晏縣青海湖達玉鄉德吉村牧民送檢的病死羊心、肝、脾、腎、肺臟及部分腸段。
1.2 標準菌株:C型產氣莢膜梭菌標準菌株(721株),購自中國獸醫藥品監察所微生物室,腐敗梭菌(FB2010株)、B型諾維氏梭菌(TB05株)、D型肉毒梭菌 (D8901株)、B、D型產氣莢膜梭菌(烏B1株、C602株)菌株均為本實驗室分離保存菌株。
1.3 培養基的制備:血液瓊脂、厭氣肝湯兩種培養基均按常規制備,121℃滅菌40 min,4℃保存備用。
1.4 試劑:TaqDNA聚合酶、10×PCR緩沖液、dNTP(10 Mmol/L)、25 mmol/L的MgCl,均購自北京博邁德科技發展有限公司;瓊脂糖為Biowest產品;引物由生工生物工程(上海)股份有限公司合成。
1.5 試驗動物:18~22 g昆明系小鼠,購自青海省地方病研究所。
2 方法
2.1 病原分離
2.1.1 組織摸片、鏡檢:將送檢羊心、肝、脾、腎、肺臟等臟器觸片,革蘭染色,鏡檢。
2.1.2 臟器培養:將送檢羊心、肝、脾、腎、肺臟等臟器接種于普通瓊脂斜面、普通肉湯、厭氣肝湯等培養基中37℃培養24 h。
2.1.3 腸內容培養:取病死羊腸道逐段抹片鏡檢,接種疑似菌密度較大腸段的內容物于加有新鮮生肝塊的厭氣肝湯37℃培養24 h,將該培養物接種于鮮血瓊脂平板上,挑取疑似菌落,得到純培養物;也可直接用腸內容物劃線接種于鮮血瓊脂平板,挑取疑似菌落。
2.2 動物試驗
2.2.1 腸內容物毒素測定 將病死羊的回腸內容物1 mL加入9 mL生理鹽水中,充分混勻后5000 r/min離心30 min,吸取上清液,用生理鹽水作適當稀釋后,在可能的毒力范圍內靜脈注射小鼠,每一滴度注射2只,0.2 mL/只,觀察記錄小鼠死亡情況,確定小鼠最小致死量。
2.2.2 分離菌株產毒測定 血平板上培養24~48 h后,挑取平板上溶血特征明顯的單個菌落于VF厭氣肝湯培養基中,37℃培養24 h,吸取純培養2 mL 2管,其中1管4 000 r/min離心30 min,另1管中加入2 mL含2.5 g/L胰酶的10 g/L的碳酸鈉溶液2 mL,37℃活化50 min后,用生理鹽水倍比稀釋,每一滴度靜脈注射小鼠2只,0.2 mL/只,觀察記錄小鼠發病、死亡情況,確定小鼠最小致死量。
2.3 C型產氣莢膜梭菌的多重PCR檢測
2.3.1 DNA模板的制備 將純化的分離待檢菌和標準陽性產氣莢膜梭菌分別接種于鮮血平板,37℃厭氧培養24 h,挑取單個菌落3~4個至裝有0.5 mL蒸餾水的Doff管中,震蕩混勻,12 000 r/min離心1 min,棄去上清液,用1×PBS緩沖液200 μL懸浮菌體,13000 r/min離心1 min,棄上清后加入200 μL 1×PBS液重懸,混勻后加入蛋白酶K 20 μL,再加200 μL CB結合液,混勻后,70℃水浴放置10 min.取出冷卻后加100 μL異丙醇,混勻。利用博邁德科技發展有限公司研制的組織/細胞DNA提取試劑盒提取DNA.提取物于4℃冰箱保存備用。
2.3.2 引物設計 根據GenBank中報道的產氣莢膜梭菌基因序列及相關的參考文獻[1~4],分別在α毒素和ε毒素的保守區域設計2對引物,由生工生物工程(上海)股份有限公司合成,引物序列如下:
α 毒素:上游引物:5′-CACGATGTATCAGAGGGTA-3′;
下游引物:5′-TAAGTGTCTTTGCTTCCAG-3′;
預期擴增片段大小:325 bp;
β 毒素:上游引物:5′-GCGAATATGCTGAATCATCTA-3′;
下游引物:5′-GCAGGAACATTTAGTATATCTTC-3′;
預期擴增片段大小:236 bp;
ε 毒素:上游引物:5′-GTATCTAATGAAATGTCCA-3′;
下游引物:5′-CTTCCACTTACTTGTCCTAC-3′;預期擴增片段大小:585 bp。
2.3.3 PCR擴增反應體系 PCR反應總體系為25 μL:10 × Buffer緩沖液 2.5 μL,10 mmol/LdNTP 1.0 μL,上下游引物各 0.5 μL,模板 DNA 5.0 μL,Taq DNA 聚合酶 0.5 μL,滅菌雙蒸水 14 μL。
反應程序為:96℃預變性20 min,然后94℃變性30 s,51℃延伸40 s,72℃復性1 min,共循環30次,最后在72℃延伸10 min。
2.3.4 PCR產物電泳 PCR反應結束后取5 μL產物在1.2%的瓊脂糖凝膠中電泳120 V,20 min,紫外燈下觀察并拍照,分析PCR擴增結果。
2.3.5 PCR檢測的特異性試驗 分別以C型產氣莢膜梭菌標準株(721株)為陽性對照,以乳酸大腸桿菌、D型肉毒梭菌、腐敗梭菌、D型產氣莢膜梭菌、B型諾維氏梭菌等作為陰性對照,檢測PCR反應的特異性。
3 結果
3.1 組織觸片鏡檢 送檢各臟器觸片,革蘭染色后鏡檢,均未未見到有疑似產氣莢膜梭菌存在,不同腸段摸片,革蘭染色鏡檢,可見有革蘭陽性、兩端鈍圓的大桿菌。
3.2 分離菌的形態與培養特性 小腸內容物在厭氣肝湯培養基中培養24 h后涂片,見到兩端鈍圓的大桿菌;在鮮血瓊脂平板上厭氣培養24 h開始生長,48 h可見圓形略隆起、灰白色半透明的菌落,菌落周圍有溶血環,涂片鏡檢可見與腸內容物涂片相同的細菌(見圖1,2)。

圖1 菌落形態
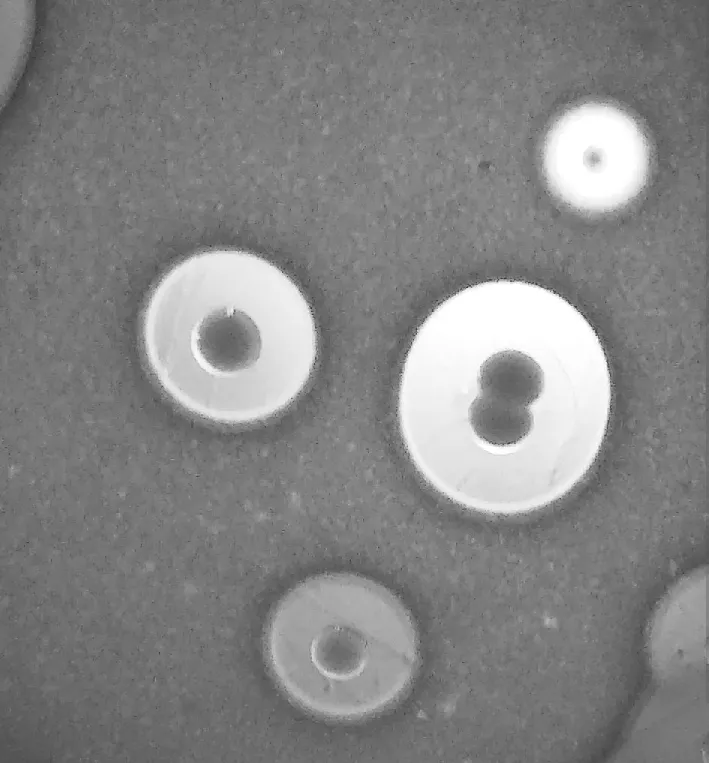
圖2 平板溶血特性
3.3 動物試驗結果 分別從4個腸段血平板培養基上挑取菌落形態大小、溶血不一的菌落,接種于VF厭氣肝湯中,37℃培養24 h,經胰酶活化和未活化培養物離心后,上清經稀釋后測毒,經胰酶活化后,所有菌株培養物均未致死小鼠,未活化菌株培養物測得其小鼠最小致死量分別為50~1 000 MLD/mL(見圖3)。
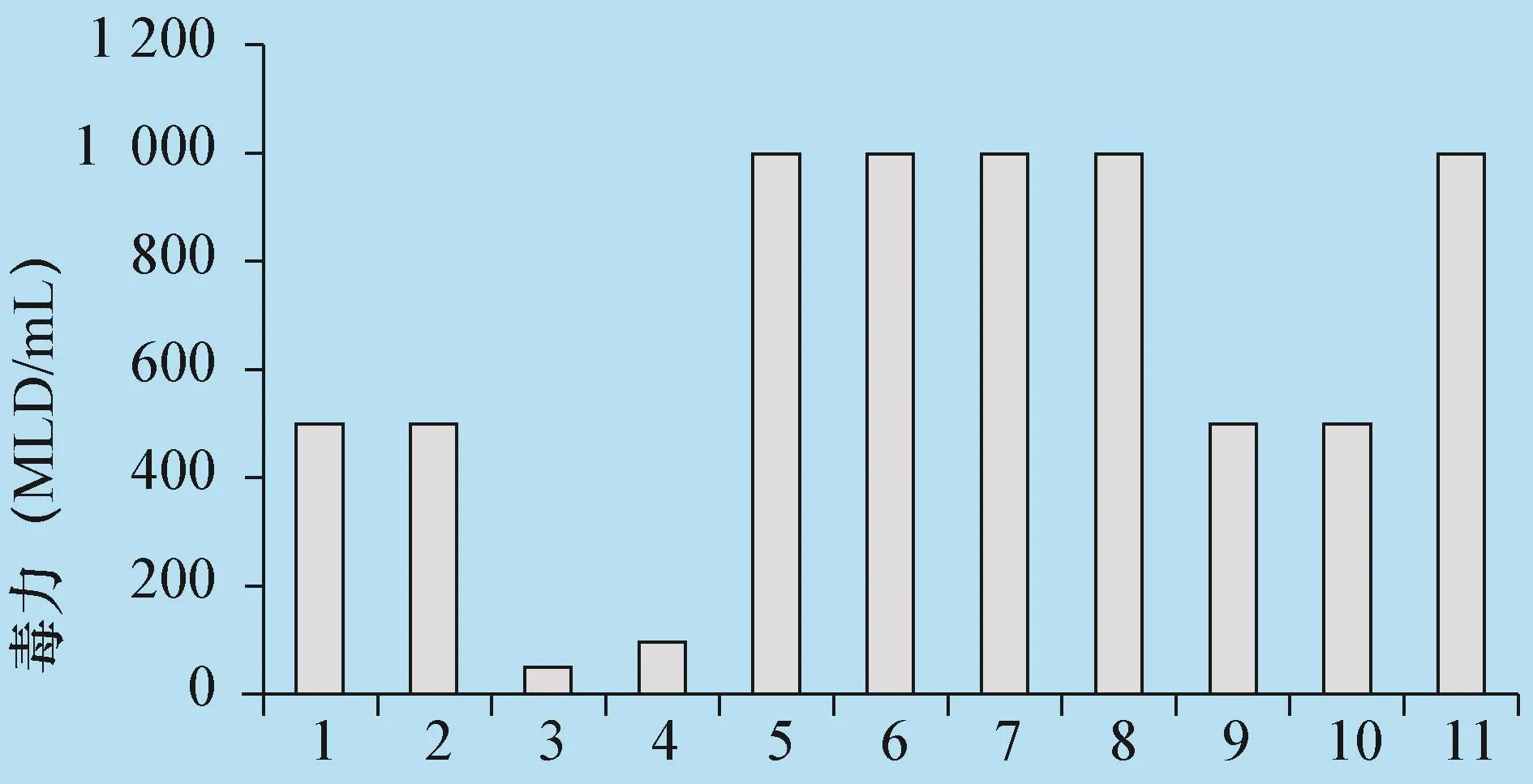
圖3 不同菌株產毒能力對比
3.4 PCR擴增結果 利用合成的2種引物進行PCR擴增,標準菌株C602和分離菌株都擴增出大小為325 bp的α毒素及236 bp的β毒素的目的條帶,結果如圖4。
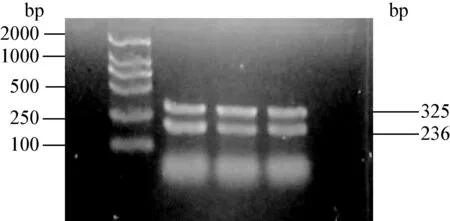
圖4 產氣莢膜梭菌分離株PCR擴增
3.5 特異性試驗 在相同條件下,只有標準菌株和兩株分離菌擴增出大小325 bp的α毒素及585 bp的ε毒素相應條帶,其他腐敗梭菌、乳酸大腸桿菌及金黃色葡萄球菌均未擴增出上述條帶,表明該試驗結果具有很好的特異性。結果如圖5。
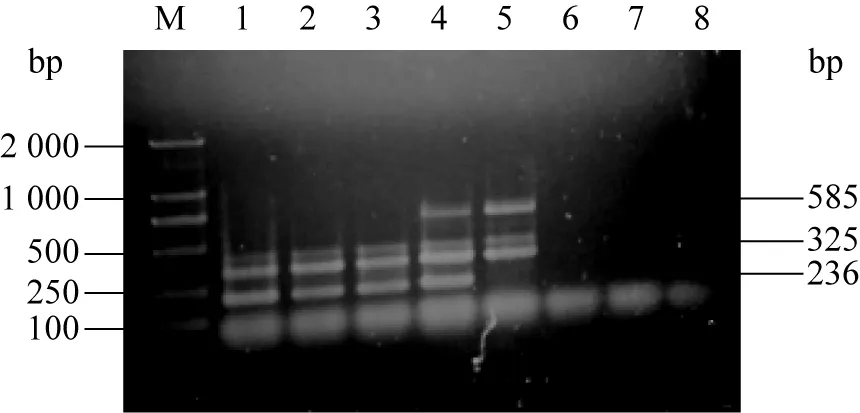
圖5 特異性擴增結果
4 討論
4.1 產氣莢膜梭菌廣泛分布于土壤、污水、飼料、糞便以及動物腸道中。若飼養管理不當、氣候變化等諸多因素改變極易誘發綿羊和山羊發病,引起羊腸毒血癥、羊猝狙、羔羊痢疾等,導致發病動物急性死亡[5]。因此,經常看不到特征癥狀即發生死亡,雖然可以初步懷疑是由產氣莢膜梭菌引起的疫病,但若要得到確切的結果,就必須分離到菌株,且進行血清型鑒別,才能確診。由于該菌是由腸道毒素引起的動物急性死亡,故在臟器內一般分不到病原菌,而從腸道內分離致病菌株尤其麻煩。另外,只有得到確切的分型結果,才能指導牧戶正確使用疫苗進行全群預防,防治疫病的繼續發生。因此建立產氣莢膜梭菌的快速診斷方法,對于疫病的診斷、檢測以及預防具有重大的意義。
4.2 此次病死羊的診斷過程中,我們從不同腸段分離到產毒能力不一的菌株11株,以往的試驗中,一般在同一腸段的培養基上挑取1~2個典型、單個菌落進行培養,測毒分析,然而,此次試驗結果證明,同一腸段上的不同菌落在同一培養條件下的產毒能力有較大區別,此次試驗中,1號結腸段,共分離出5株菌,毒力最低的為100 MLD/mL,最高的達1 000 MLD/mL,回腸4號腸斷共分出3株菌,毒力最低的為50 MLD/mL,最高的達1 000 MLD/mL,2號結腸段共分離出3株菌,毒力在500-1 000 MLD/ml之間。因此,在進行病原菌毒力分析時,盡可能多挑菌落,才能選出致病性較高的菌株,作為疫苗生產的備用菌株。另外,如果挑選菌落太少,找不到致病性病原菌,就會對疫病的診斷結果產生較大影響。
4.3 隨著分子生物學研究的發展,許多產氣莢膜梭菌新的定型方法相繼出現,比如基因芯片和酶聯免疫吸附試驗(ELISA)[6]等。目前,國內外利用PCR方法擴增產氣莢膜梭菌不同毒素完成病原檢測的比較多[7]。早期常經過單獨擴增每個主要致死毒素基因(4~5次)才能完成病原分離株的定型[8]。多重PCR具有很高的敏感度和特異性,從而實現高效率、短周期、低成本的檢測目的[9]。本試驗依據產氣莢膜梭菌不同血清型產毒素種類的差異,利用多重PCR方法,對分離株進行鑒別診斷,得到的結果與實驗室診斷結果相一致,證明該方法對于建立產氣莢膜梭菌的快速診斷方法具有指導意義。

