豬流行性腹瀉傳染性胃腸炎雙重RT-PCR檢測方法的建立及優化
趙光偉,涂少宇,汪 洋,賀 然,賴靖堯,譚陽春,郭道兵,牛晨霞,楊曉偉
(西南大學動物科學學院,重慶 榮昌 402460)
豬傳染性胃腸炎(TGE)與豬流行性腹瀉(PED)都是一種由冠狀病毒引起的一種急性胃腸道傳染病,臨床上以突然發病、傳播迅速、嘔吐、水樣腹瀉、脫水和2周齡以內仔豬高病死率為特征[1]。本病可發生于各種年齡段的豬,但對仔豬的影響最為嚴重。10日齡以內的仔豬病死率高達100%,5周齡以上的豬感染后病死率較低,成年豬感染后幾乎沒有死亡,但嚴重影響增重和降低飼料報酬,由此造成了藥物和人力增加等重大損失,是危害豬場最嚴重的疾病之一[2-3]。二者均為高度接觸性腸道疾病,分別由豬傳染性胃腸炎病毒和豬流行性腹瀉病毒引起。由于TGEV和PEDV有相似的臨床表現及傳染途徑,其鑒別診斷通常需借助實驗室診斷技術,如病毒分離、免疫熒光試驗、PCR技術等[4]。傳統的診斷技術如病毒分離、免疫熒光試驗等費時費力,不適于臨床快速診斷,也不適于大規模的流行病學調查;而PCR技術具有特異性強、敏感度高、可進行活體診斷等特點,在實驗室診斷中具有較突出的優勢[5]。因此本研究通過對豬流行性腹瀉和傳染性胃腸炎的雙重RT-PCR檢測的建立和優化為這兩種病毒的檢測提供技術支撐。
1 材料與方法
1.1 材料
1.1.1 毒株 豬流行性腹瀉病毒、傳染性胃腸炎病毒、豬瘟病毒、豬圓環病毒2型、豬繁殖與呼吸綜合征病毒、豬偽狂犬病病毒,均于西南大學榮昌校區動物疾病快速診斷中心保存。
1.1.2 主要試劑 Total RNA提取試劑、RT-PCR試劑盒、Permix TaqDNA聚合酶、DL-2 000 DNA Marker,均購自寶生物工程(大連)有限公司。
1.1.3 引物 根據豬流行性腹瀉和傳染性胃腸炎的基因序列,應用Primer5.0分別設計了2對引物,序列見表1,引物由上海生工生物工程技術服務有限公司合成。
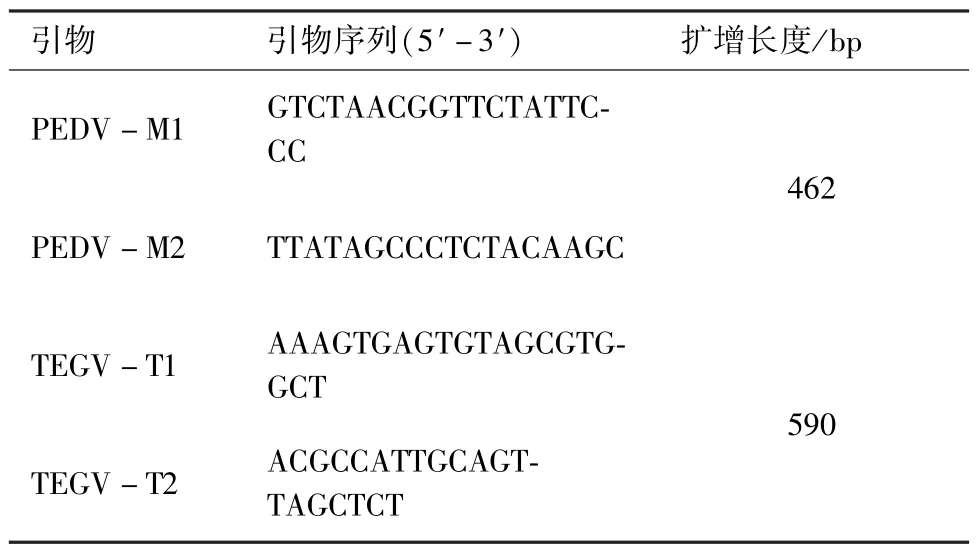
表1 引物序列
1.2 方法
1.2.1 病毒RNA提取 分別從實驗室保存的流行性腹瀉、傳染性腹瀉毒株樣本中提取RNA,具體操作參見RNA試劑盒(TaKaRa)說明書方法。
1.2.2 雙重RT-PCR方法的建立
1.2.2.1 RT反應 取PEDV和TGEV樣本各3 μL,反轉錄酶混合液(PrimeScript RT Master Mix)2 μL,無RNA酶的超純水(RNase Free dH2O)補足至10 μL。混勻后以37℃ 15 min,85℃ 5 s,4℃保存為反應程序進行反轉錄,得到病毒 cDNA,置于-20℃保存備用。
1.2.2.2 雙重RT-PCR反應最佳退火溫度 取PEDV、TGEVcDNA 各 3 μL 為模版,Permix Taq TaqDNA 聚合酶 25 μL,上、下游引物各 1 μL,最后用ddH2O補足至50 μL。退火溫度在51.8℃ ~57.8 ℃ 區間設置 51.8、52.2、52.9、54.1、55.5、56.6、57.3、57.8℃八個溫度梯度進行反應。
1.2.2.3 雙重RT-PCR反應引物濃度稀釋 將設計的PEDV和TGEV引物用紫外分光光度計進行OD260nm/OD280nm值測定,將引物作10倍稀釋,并分別測定稀釋后的濃度,各取1 μl加入到多重PCR最佳退火溫度反應體系進行反應。
1.2.2.4 雙重RT-PCR反應靈敏性檢測 將提取的PEDV和TGEV的反轉錄產物用紫外分光光度計進行OD260nm/OD280nm值測定,將模版作10倍系列稀釋,并分別測定稀釋后的含量,并各取1 μL加入到最佳反應程序,進行靈敏性檢測。
1.2.2.5 雙重RT-PCR反應特異性檢測 分別取CSFV、PCV2、PRRSV和 PRV的 DNA或 RNA按照相同條件代替PDEV和TGEV的cDNA模板進行RT-PCR擴增,以檢測其特異性。
2 結果與分析
2.1 雙重RT-PCR反應退火溫度優化 以PEDV和TGEV基因組cDNA為模板進行PCR擴增,通過電泳、測序分別得到462 bp和590 bp的cDNA序列,見圖1。
通過優化確定最佳反應體系(50 μL)為:25 μL 5X PeimeScript RT Master Mix酶,上、下游引物各1 μL,cDNA 模版 6 μL,ddH2O 補足至 50 μL。 對RT-PCR反應溫度、時間和循環次數等進行優化,最后確定PEDV和TGEV的最佳反應條件:94℃預變性5 min、94 ℃變性50 s、52.9 ℃退火 1 min、72 ℃延伸1 min、循環 35次、72℃終末 10 min、15℃保存。
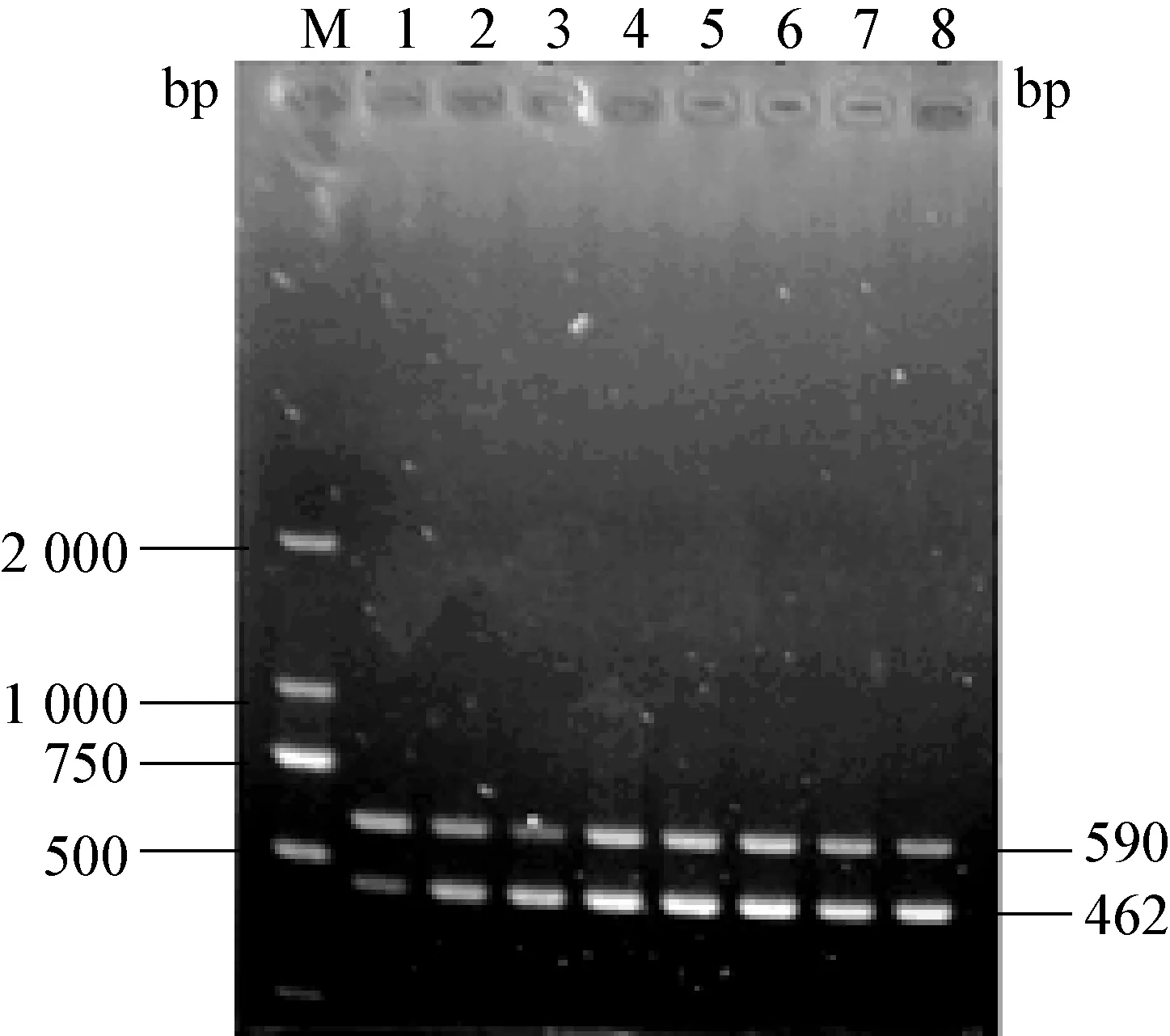
圖1 PEDV和TGEV雙重RT-PCR反應退火溫度優化
2.2 雙重RT-PCR引物濃度稀釋 將PEDV和TGEV引物由原濃度10 μmol/L稀釋為1 μmol/L,5×10-1μmol/L,2.5 ×10-1μmol/L,1.25 ×10-1μmol/L,1×10-1μmol/L,1×10-2μmol/L,用雙重PCR最佳反應條件進行 PCR擴增,電泳,結果見圖2。
通過圖像對比可看出,引物濃度為5×10-1μmol/L時,條帶最亮,其為最適引物濃度。
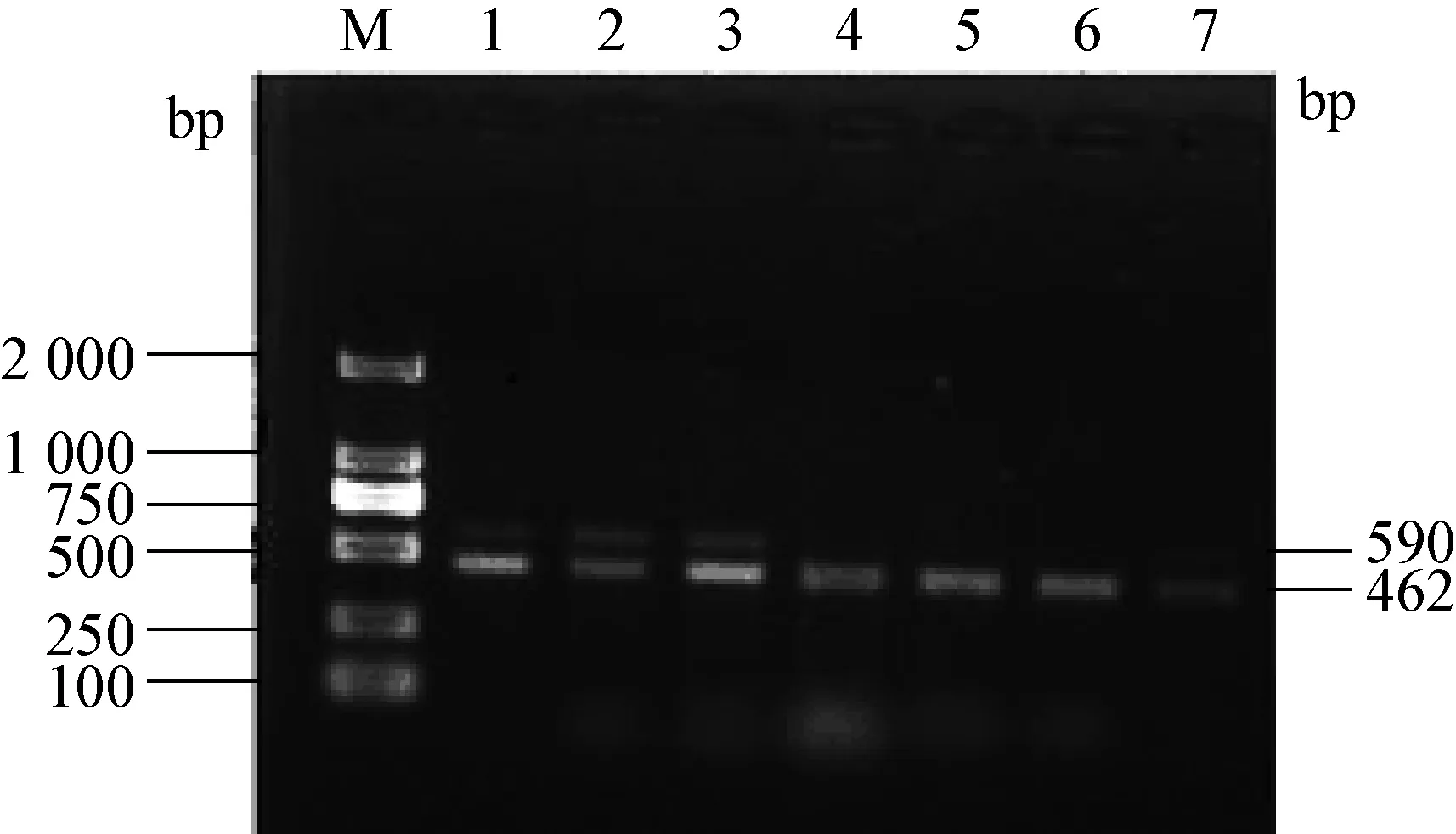
圖2 PEDV和TGEV雙重RT-PCR引物濃度稀釋
2.3 雙重RT-PCR靈敏性檢測 將cDNA濃度由原濃度93.3×101ng/μL以10倍梯度稀釋為93.3×100ng/μL,93.3 × 10-1ng/μL,93.3 × 10-2ng/μL,93.3×10-3ng/μL。用雙重PCR最佳反應條件進行PCR擴增,跑電泳,結果見圖3。
通過圖像對比可以看出,cDNA濃度為93.3×101ng/μL時,條帶最亮,故其為最適cDNA濃度。
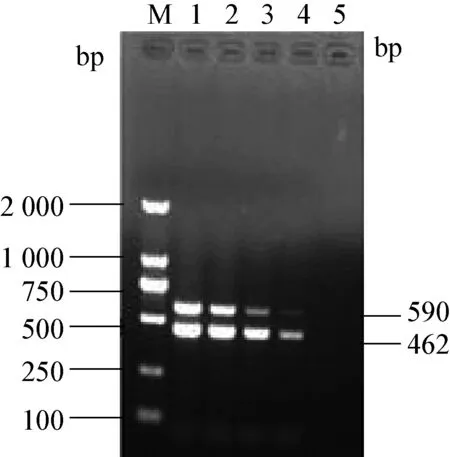
圖3 PDEV和TGEV雙重RT-PCR的敏感性
2.4 雙重RT-PCR的特異性 用建立的雙重RTPCR方法檢測豬瘟病毒(CSFV)、豬圓環病毒2型(PCV-2)、豬繁殖與呼吸綜合征病毒(PRRSV)、豬偽狂犬病病毒(PRV)均未出現條帶,顯示陰性,可見其特異性好。結果見圖4.
3 討論

圖4 雙重RT-PCR特異性檢測
2010年以來,中國大陸大部分地區的豬場出現了仔豬腹瀉的疫情,與此同時韓國、日本、越南等亞洲國家及區域也發生腹瀉疫情,導致大量出生仔豬死亡。2013年4月以后,美國、加拿大、墨西哥等美洲國家,甚至有歐洲國家均有豬腹瀉疫情的報道,豬腹瀉病給養豬業造成巨大經濟損失,其發病范圍的擴大,再度引起了科研工作者們對引發腹瀉病相關病毒的研究熱情[6]。TGEV和PDEV這兩種病毒性腹瀉病是仔豬的常見疾病,發病率高,目前均無有效的藥物去預防和治療,且兩者在臨床癥狀、病理變化和流行病學上無明顯差異[7].傳統的檢測方法,如細胞培養、免疫學和動物試驗等雖能對兩者鑒別診斷,但它們最大的缺點是檢測靈敏度低、周期長[8]。RT-PCR技術是目前鑒別診斷TGEV和PEDV兩種病毒的特異性更強、敏感度更高的方法[9]。相對于傳統PCR檢測單一病原體,雙重RTPCR能同時進行多種病原微生物的鑒定,且具有靈敏、快捷等優點,適于大規模檢測,在動物疫病的流行病學調查和預防中,具有不可替代的作用。近年來,隨著分子生物學技術的發展,某些新的檢測方法,如多重RT-PCR、實時熒光定量RT-PCR、恒溫隔熱RTPCR等也逐漸應用于動物病原的檢測[10],在臨床應用中,也越來越多的運用多重PCR技術解決疾病的診斷問題,用以提高檢測的效率。多重PCR技術能在同一個體系中實現對多個目的基因的特異性擴增,相比普通單重PCR檢測效率更高、且節約試劑和人工成本,而較之熒光定量PCR、恒溫隔熱RT-PCR技術,其靈敏度略低,但對儀器設備的要求、各項試劑耗材等成本也較低[11]。因此,雙重RT-PCR方法的建立對PEDV和TGEV的快速診斷有重要意義。
本試驗根據實驗室保存的PEDV和TGEV毒株設計特異性引物,建立了PEDV和TGEV雙重RT-PCR快速檢測方法。雙重RT-PCR檢測靈敏性顯示,該方法最低,cDNA模板檢出濃度為93.3×10-1ng/μL,表明本試驗建立的雙重RT-PCR檢測方法準確性高,具有較高的檢測靈敏性。同時,該雙重RT-PCR特異性結果顯示,該方法僅能檢測到PEDV和TGEV,不能檢測到PRRSV、CSFV和PRV等,對PEDV和TGEV的快速診斷和疫病防控具有重要意義。

