敖漢細(xì)毛羊Hoxa5基因質(zhì)粒的構(gòu)建及在成纖維細(xì)胞中表達(dá)量的研究
張夢(mèng)瑤,楊 峰,劉開東,劉積鳳,柳 楠,賀建寧
(1.青島農(nóng)業(yè)大學(xué)動(dòng)物科技學(xué)院,山東 青島 266109;2.青島畜牧獸醫(yī)研究所,山東 青島 266121;3.內(nèi)蒙古農(nóng)業(yè)大學(xué)動(dòng)物科技學(xué)院,內(nèi)蒙古 呼和浩特 010018)
在早些年我國就培育出細(xì)毛羊品種敖漢細(xì)毛羊,主要分布在東北地區(qū)、內(nèi)蒙古地區(qū)。其羊毛的品質(zhì)相比于其他羊的毛品質(zhì)要高,是我國最具有代表性的細(xì)毛羊之一[1]。細(xì)毛羊毛囊是皮膚的重要附屬結(jié)構(gòu),是產(chǎn)生被毛的組織,它的性狀和組織結(jié)構(gòu)決定著被毛品質(zhì)和羊毛產(chǎn)量。毛囊發(fā)育形態(tài)結(jié)構(gòu)特征及發(fā)育規(guī)律,對(duì)羊毛性狀有重要影響,是探究毛囊生長發(fā)育調(diào)控機(jī)制的基礎(chǔ)。毛囊具有自我更新和周期性生長的特點(diǎn),其周期性變化決定被毛的生長與脫落,并受多種因子調(diào)控[2]。因此探究毛囊的生長發(fā)育調(diào)控的基因已顯得非常重要。
Hox家族是重要的轉(zhuǎn)錄調(diào)節(jié)因子,目前共有39個(gè)[3],其對(duì)毛囊細(xì)胞增殖與分化有重要作用[4-5]。對(duì)人和小鼠的研究發(fā)現(xiàn),幾乎所有的Hox家族基因均在皮膚和毛囊中表達(dá)[6]。Hoxa5參與皮膚細(xì)胞增殖、分化與凋亡的調(diào)控[7],是毛囊退行期調(diào)控的關(guān)鍵因子,在誘導(dǎo)細(xì)胞周期阻滯和終端分化中發(fā)揮作用[8]。張燕軍等[9]研究發(fā)現(xiàn),在絨山羊胚胎115 d和成年羊10月時(shí),于初級(jí)毛囊內(nèi)根鞘和毛干皮質(zhì)層中檢測(cè)到Hoxa4和Hoxa5基因。Hoxa7在人和鼠的毛囊內(nèi)、外根鞘中表達(dá)[10]。張燕軍等[11]研究表明,Hoxa5基因在胚胎不同時(shí)期及成年羊皮膚毛囊中均有表達(dá),推斷該基因?qū)γ壹?xì)胞增殖起作用。Hoxa5在控制毛生長發(fā)育中有重要作用,當(dāng)過表達(dá)時(shí),小鼠會(huì)表現(xiàn)出毛生長的缺陷[12]。吳江鴻[13]發(fā)現(xiàn),Hoxa5基因的表達(dá)量與絨山羊胎兒皮膚厚度變化趨勢(shì)一致,成年后則與次級(jí)毛囊周期呈顯著相關(guān),且在體外培養(yǎng)的毛囊中Hoxa5基因表達(dá)導(dǎo)致角質(zhì)化細(xì)胞死亡。
目前,對(duì)Hoxa5基因與家畜皮膚毛囊關(guān)系的研究主要集中在絨山羊和小鼠身上,主要通過熒光定量PCR在分子水平上有過相應(yīng)的研究,還有一些是與骨的調(diào)節(jié),繁殖等與皮膚毛囊無關(guān)的研究,尚未發(fā)現(xiàn)Hoxa5基因通過在細(xì)胞水平上來研究細(xì)毛羊毛囊發(fā)育方面的相關(guān)報(bào)道。因而本研究通過對(duì)其質(zhì)粒的構(gòu)建及轉(zhuǎn)染成纖維細(xì)胞來進(jìn)行Hoxa5基因表達(dá)的分析。結(jié)果表明,質(zhì)粒構(gòu)建成功且Hoxa5基因轉(zhuǎn)染細(xì)胞后過表達(dá)。可為此基因在個(gè)體層次上的研究提供了堅(jiān)實(shí)的基礎(chǔ)。
1 材料與方法
1.1 試驗(yàn)材料 選取健康40日齡的胎羊(由青島畜牧獸醫(yī)研究所奧特種羊場(chǎng)提供)。
1.2 主要試驗(yàn)試劑及儀器 pGM-T載體、pcDNA3.1質(zhì)粒、EcoR1、Nde1限制性內(nèi)切酶、DH5ɑ感受態(tài)細(xì)胞、DMEM、標(biāo)準(zhǔn)胎牛血清等,均購自青島賽尚科貿(mào)有限公司。BB5060UV型賀氏二氧化碳培養(yǎng)箱,購自德國Eppendorf公司;Leica DMIRB型倒置顯微鏡、Redbio CFX ConnectTM熒光定量PCR系統(tǒng),均購自Bio-Rad公司。
1.3 質(zhì)粒構(gòu)建
(1)引物設(shè)計(jì):利用RNA提取試劑盒對(duì)組織進(jìn)行RNA的提取及反轉(zhuǎn)錄。選取綿羊Hoxa5基因組(GenBank登錄號(hào)為NM-001009431.1)CDS區(qū) ,在CDS區(qū)外側(cè)通過Primer5.0軟件設(shè)計(jì)引物并在上下游引物 5′端加入保護(hù)堿基和 EcoR1、Nde1酶切位點(diǎn)。
上 游 引 物:5′-CCGGAATTCATGAGCTCTTATTTTGTAAAC-3′;
下游引物:5′-GGAATTCCATATGTAAACGCTCAAATACTCAGG-3′;并進(jìn)行PCR擴(kuò)增及瓊脂糖凝膠電泳檢測(cè),擴(kuò)增體系為:DNA模板1 μL,上下游引物各 1 μL,Green Mix 17 μL。
(2)TA克隆:對(duì)PCR產(chǎn)物進(jìn)行瓊脂糖凝膠電泳回收連接。pGM-T載體連接體系:T4 DNA連接酶2 μL;T4 DNA 連接酶 Buffer 1 μL;pGM-T 載體2 μL;DNA 片段5 μL;置于16 ℃金屬浴中3 h,然后4℃過夜。轉(zhuǎn)化DH5ɑ感受態(tài)細(xì)胞、涂布在AMP抗生素的平板上,37℃、培養(yǎng)12 h,挑單菌搖菌并送上海生工生物工程技術(shù)服務(wù)有限公司測(cè)序[14]。
(3)Hoxa5基因與pcDNA3.1質(zhì)粒重組:對(duì)TA克隆載體及pcDNA3.1質(zhì)粒同時(shí)進(jìn)行EcoR1、Nde1雙酶切,酶切體系為:EcoR1 1 μL;Nde1 1 μL;pGM-THoxa5 和 pcDNA3.1 5 μL;Buffer 1 μL;ddH2O 42 μL;37℃ 2 h,對(duì) Hoxa5基因和 pcDNA3.1進(jìn)行膠回收。連接體系:Hoxa5片段5 μL;pcDNA3.1 3 μL;T4 DNA 連接酶 1 μL;T4 DNA 連接酶 Buffer 1 μL;22℃金屬浴中反應(yīng)2 h,16℃ 3 h后轉(zhuǎn)化DH5ɑ感受態(tài)細(xì)胞,挑單菌搖菌,進(jìn)行菌液PCR鑒定陽性率,將陽性組送往公司測(cè)序,并通過質(zhì)粒提取試劑盒獲得陽性質(zhì)粒[14]。
1.4 敖漢細(xì)毛羊成纖維細(xì)胞培養(yǎng) 取40日齡胎羊用75%酒精和PBS清洗。去除頭部和四肢剩余軀干用眼科剪將其剪成1.0~2.0 mm3大小的組織塊,滴加37.0℃預(yù)熱的胎牛血清,加入培養(yǎng)液置于CO2培養(yǎng)箱(37℃,5.0%CO2)。24 h進(jìn)行換液,每日在倒置顯微鏡下觀察細(xì)胞形態(tài)和生長情況,待細(xì)胞密度達(dá)到90%左右進(jìn)行傳代。傳代時(shí)加入0.25%胰蛋白酶1.0 mL,37.0℃消化5 min,當(dāng)細(xì)胞變圓,加入3倍體積的DMEM終止消化,按相應(yīng)比例進(jìn)行傳代[14]。
1.5 細(xì)胞轉(zhuǎn)染 待細(xì)胞傳代后2~3天用Lipofectamine2000進(jìn)行瞬時(shí)轉(zhuǎn)染。孵育體系:試驗(yàn)組:脂質(zhì)體 20 μL,DMEM(不含雙抗)480 μL;對(duì)照組:脂質(zhì)體 20 μL,DMEM(不含雙抗)480 μL;混勻,靜置5 min。 轉(zhuǎn)染體系:試驗(yàn)組:質(zhì)粒 40 μL,DMEM 460 μL;對(duì)照組:DMEM 500 μL;靜置 20 min,各加入4 mL DMEM,37℃培養(yǎng)6 h后換液,培養(yǎng)36 h。
1.6 轉(zhuǎn)染細(xì)胞的定量檢測(cè) 對(duì)轉(zhuǎn)染成功的細(xì)胞進(jìn)行培養(yǎng),待細(xì)胞密度達(dá)到90%時(shí)加入3 mL的TR-IZol(Roche)裂解細(xì)胞并提取RNA。完成后利用核酸蛋白測(cè)定儀測(cè)定其濃度和純度,并用反轉(zhuǎn)錄試劑盒(Roche)將RNA逆轉(zhuǎn)錄成cDNA。根據(jù)敖漢細(xì)毛羊Hoxa5基因的CDS區(qū)和綿羊GAPDH的CDS區(qū),使用PrimerPremier5.0軟件設(shè)計(jì)Hoxa5和GAPDH基因的引物序列,見表1。
實(shí)時(shí)熒光定量PCR反應(yīng)程序:94℃預(yù)變性10 min;94℃變性30 s,60℃退火30 s,72℃延伸30 s,共40個(gè)循環(huán)。每個(gè)樣品設(shè)置3次重復(fù),采用Ct(2-ΔΔCt)值法計(jì)算各樣本中Hoxa5相對(duì)于內(nèi)參基因GAPDH的表達(dá)量。利用SPSS 17.0軟件中t檢驗(yàn)對(duì)數(shù)據(jù)進(jìn)行差異顯著性分析,結(jié)果以平均值±標(biāo)準(zhǔn)差表示,以 P<0.01作為差異極顯著性判斷標(biāo)準(zhǔn)[14]。
1.7 質(zhì)粒轉(zhuǎn)染后Western Blotting檢測(cè)Hoxa5基因蛋白表達(dá) 樣品分為對(duì)照組和試驗(yàn)組。每個(gè)樣品3個(gè)平行。用細(xì)胞裂解液提取細(xì)胞總蛋白,收集置于-20℃凍存?zhèn)溆?β-actin作為內(nèi)參。蛋白樣品回收后轉(zhuǎn)印,5%BSA封閉2 h;TBST洗膜3次,每次5 min;將一抗用1∶2 000比例稀釋,孵育膜4℃過夜;用TBST洗膜3次,每次5 min。山羊抗兔的二抗用以1∶2 000的比例稀釋,孵育膜1 h;用TBST洗膜3次,每次5 min,在暗室中曝光。條帶用ImageJ軟件分析,同一樣本不同處理的結(jié)果用SPSS統(tǒng)計(jì)分析軟件進(jìn)行t檢驗(yàn),多組數(shù)據(jù)之間應(yīng)用SPSS統(tǒng)計(jì)分析軟件進(jìn)行方差分析。
2 結(jié)果
2.1 Hoxa5基因PCR擴(kuò)增 以敖漢細(xì)毛羊的肌肉組織提取的RNA反轉(zhuǎn)錄的cDNA為模板,應(yīng)用設(shè)計(jì)的上下游引物進(jìn)行PCR擴(kuò)增目的基因片段。1%瓊脂糖凝膠電泳分析結(jié)果如圖1所示,電泳結(jié)果表明,引物擴(kuò)增的條帶單一,產(chǎn)物大小為804 bp,與已知的目的基因大小一致,可用于后續(xù)的試驗(yàn)。
2.2 TA克隆測(cè)序比對(duì) 將擴(kuò)增的目的基因片段與pGM-T載體連接,并轉(zhuǎn)化大腸桿菌DH5ɑ,37℃過夜振蕩培養(yǎng)。將菌液送至擎科公司進(jìn)行測(cè)序,測(cè)序后的序列用BLAST與已知目的基因的序列進(jìn)行比對(duì),比對(duì)結(jié)果顯示堿基沒有發(fā)生突變,與已知目的基因完全一致。
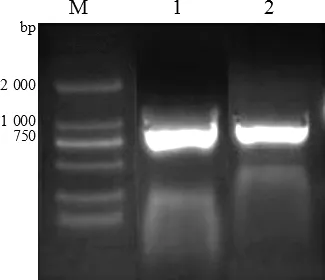
圖1 Hoxa5基因PCR擴(kuò)增
2.3 克隆載體的鑒定 將擴(kuò)增的目的基因連接到pGM-T載體中,經(jīng)轉(zhuǎn)化大腸桿菌DH5ɑ,過夜振蕩培養(yǎng)后對(duì)克隆載體利用試劑盒進(jìn)行提取,通過1%瓊脂糖凝膠電泳檢測(cè),結(jié)果如圖2所示,目的基因大小為804 bp,T載體大小為3 489 bp,連接上目的基因后應(yīng)在4 293 bp處,條帶清晰單一,結(jié)果顯示克隆載體構(gòu)建提取成功,可用于后續(xù)的酶切試驗(yàn)。
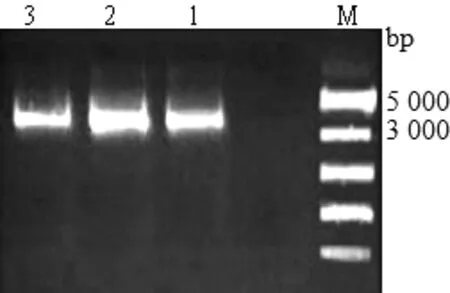
圖2 克隆載體的鑒定
2.4 克隆載體及pcDNA3.1載體雙酶切 對(duì)克隆載體和pcDNA3.1載體分別進(jìn)行雙酶切,克隆載體的雙酶切將目的基因片段切下,pcDNA3.1的雙酶切把載體切開,對(duì)兩者雙酶切之后的片段進(jìn)行切膠回收用于后續(xù)的連接。結(jié)果如圖3所示,1~2酶切效果良好1、2是對(duì)克隆載體的EcoR1、Nde1雙酶切,目的基因?yàn)?04 bp,T載體為3 489 bp,與圖中條帶所吻合。3~4是對(duì)pcDNA3.1的雙酶切,大小為5 428 bp,與圖中條帶所吻合。因此1~4可進(jìn)行目的基因與表達(dá)載體pcDNA3.1的連接。
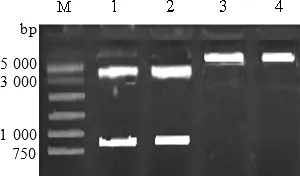
圖3 克隆載體及pcDNA3.1載體雙酶切
2.5 表達(dá)載體pcDNA3.1構(gòu)建及鑒定 對(duì)克隆載體和pcDNA3.1載體EcoR1、Nde1雙酶切產(chǎn)物進(jìn)行切膠回收后用T4 DNA連接酶將目的片段和pcDNA3.1載體進(jìn)行連接,轉(zhuǎn)化大腸桿菌DH5α,37℃過夜振蕩培養(yǎng),對(duì)菌液進(jìn)行PCR電泳鑒定,如圖4所示,在804 bp處有單一明亮的條帶,說明目的基因與pcDNA3.1載體連接成功。
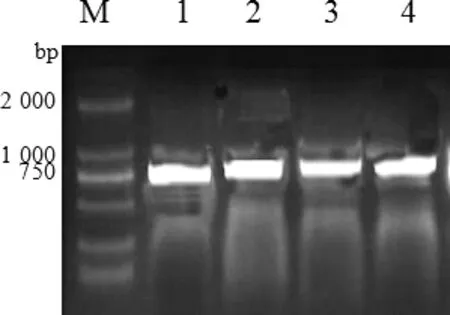
圖4 表達(dá)載體pcDNA3.1的鑒定-PCR擴(kuò)增
2.6 表達(dá)載體菌液測(cè)序鑒定 對(duì)目的基因Hoxa5連接到pcDNA3.1載體的菌液送至公司進(jìn)行測(cè)序,測(cè)序結(jié)果與已知目的基因的序列用BLAST進(jìn)行比對(duì),結(jié)果顯示堿基完全一致,沒有堿基發(fā)生突變。說明目的基因成功的連接到了pcDNA3.1載體中去,并能夠穩(wěn)定的存在。
2.7 細(xì)胞形態(tài)觀察 每天定時(shí)用電子倒置顯微鏡觀察成纖維細(xì)胞的生長情況。細(xì)胞生長24 h可觀察到組織塊附近有梭形、不規(guī)則三棱形的成纖維細(xì)胞游離生長,除此細(xì)胞外還有橢圓形或圓形的上皮樣細(xì)胞生長。當(dāng)細(xì)胞密度達(dá)到90%左右時(shí)進(jìn)行傳代,采用胰酶消化法和差速離心法可將成纖維細(xì)胞和上皮樣細(xì)胞及其他細(xì)胞分離開,經(jīng)3~4代培養(yǎng)的細(xì)胞僅剩成纖維細(xì)胞,經(jīng)傳代后細(xì)胞增殖加快,細(xì)胞形態(tài)上不發(fā)生明顯的變化。
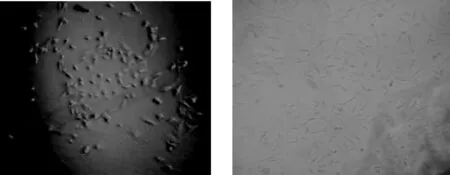
圖5 成纖維細(xì)胞原代培養(yǎng) (×100)與成纖維細(xì)胞傳代培養(yǎng) (×100)
2.8 實(shí)時(shí)熒光定量PCR檢測(cè)Hoxa5基因表達(dá) 以cDNA為模板,應(yīng)用設(shè)計(jì)的上下游引物進(jìn)行PCR擴(kuò)增目的基因Hoxa5和內(nèi)參基因GAPDH片段。1%瓊脂糖凝膠電泳分析結(jié)果如圖6所示,電泳結(jié)果表明,引物擴(kuò)增的條帶單一,GAPDH產(chǎn)物大小為125 bp,Hoxa5產(chǎn)物大小為186 bp與已知的內(nèi)參基因、目的基因大小一致,可用于熒光定量PCR試驗(yàn)。
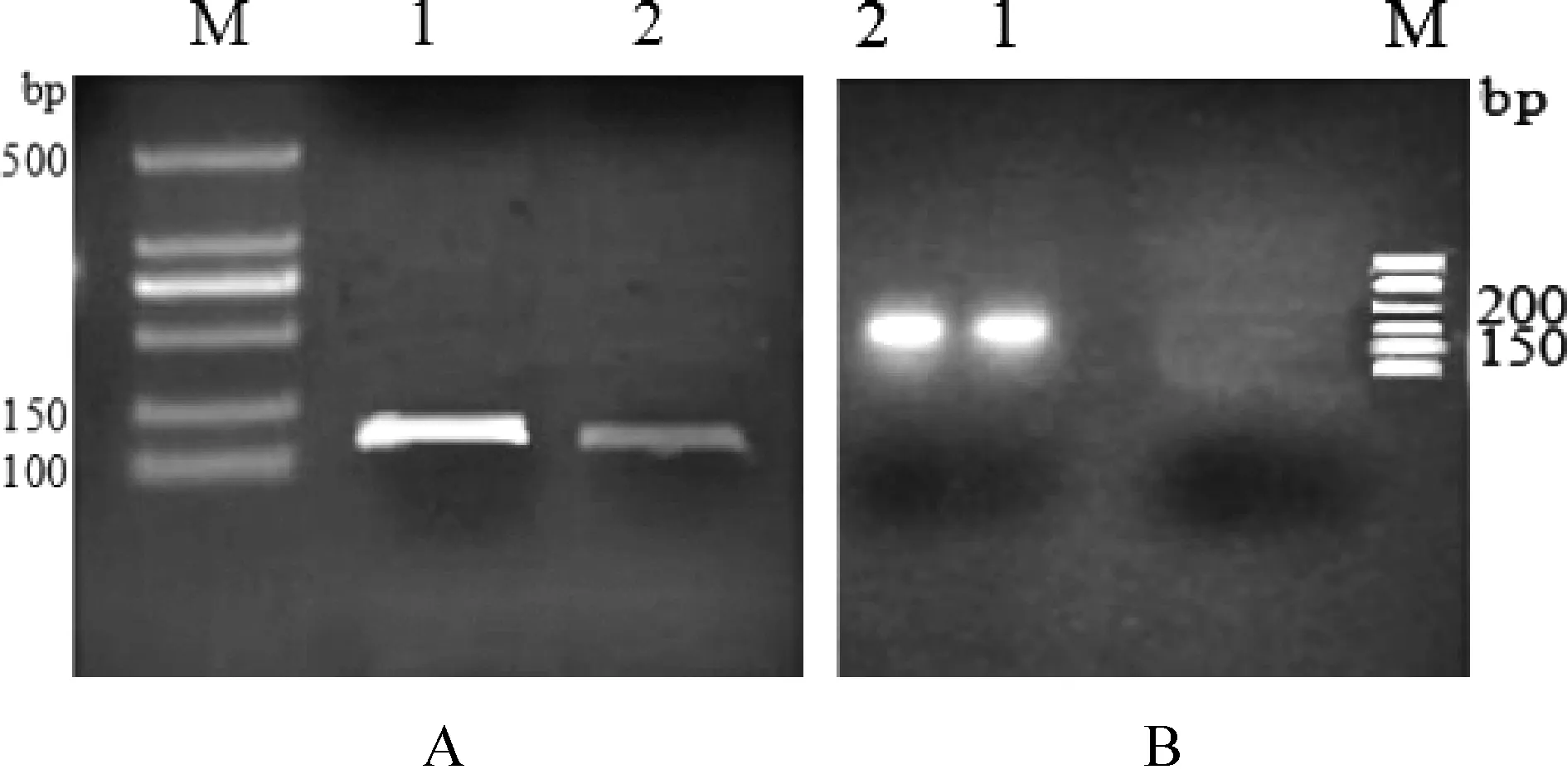
圖6 內(nèi)參基因GAPDH(A)目的基因Hoxa 5擴(kuò)增產(chǎn)物(B)
由圖7可見,Hoxa5和內(nèi)參基因GAPDH的熔解曲線峰值圖只有1個(gè)明顯的峰,表明在實(shí)時(shí)熒光定量PCR過程中熒光信號(hào)均來自特異性擴(kuò)增產(chǎn)物,Hoxa5和GAPDH均沒有產(chǎn)生非特異性擴(kuò)增及引物二聚體,引物可以用來進(jìn)行下一步試驗(yàn)。采用SPSS軟件對(duì)轉(zhuǎn)染的細(xì)胞和沒有進(jìn)行轉(zhuǎn)染的細(xì)胞mRNA表達(dá)量進(jìn)行分析,Hoxa5基因經(jīng)過質(zhì)粒構(gòu)建轉(zhuǎn)染成纖維細(xì)胞后與未進(jìn)行轉(zhuǎn)染的細(xì)胞之間差異顯著(P<0.05)見圖8。
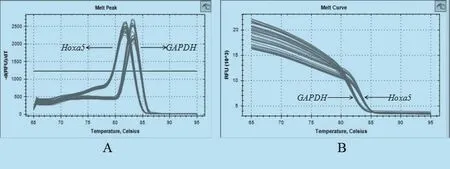
圖7 Hoxa 5和GAPDH熔解曲線峰值圖(A)和擴(kuò)增曲線圖(B)
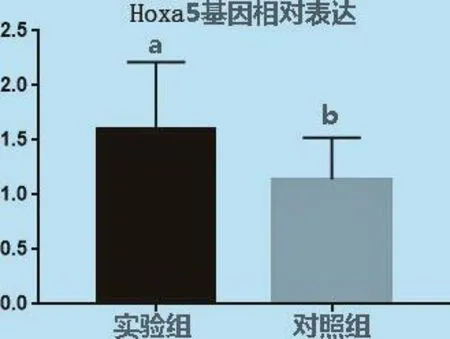
圖8 Hoxa 5基因mRNA相對(duì)表達(dá)量
2.9 Hoxa5基因蛋白表達(dá)的檢測(cè) 以成纖維細(xì)胞提取的蛋白為模板進(jìn)行Western Blot。試驗(yàn)結(jié)果顯示,試驗(yàn)組細(xì)胞瞬時(shí)轉(zhuǎn)染Hoxa5基因的條帶明顯亮、粗與未轉(zhuǎn)染的對(duì)照組,經(jīng)ImageJ和SPSS分析得試驗(yàn)組細(xì)胞瞬時(shí)轉(zhuǎn)染Hoxa5基因蛋白的表達(dá)顯著高于對(duì)照組(P<0.05),說明質(zhì)粒pcDNA3.1-Hoxa5能高效表達(dá)Hoxa5基因。
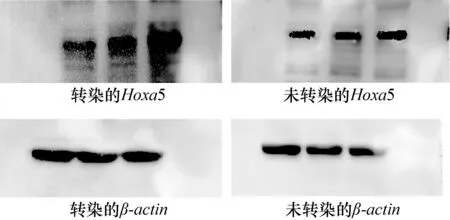
圖9 Hoxa 5基因表達(dá)蛋白條帶
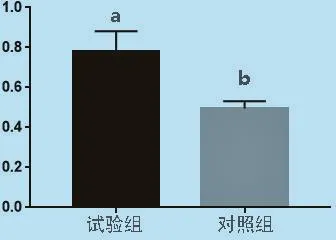
圖10 Hoxa 5基因蛋白相對(duì)表達(dá)量
3 討論
毛囊發(fā)育和周期性生長過程中受多種信號(hào)通路調(diào)控。這些信號(hào)分子73.2%屬于Wnt轉(zhuǎn)化生長因子家族、絲裂原活化蛋白激酶家族、NOTCH、JAK-STAT和SHH 6個(gè)傳導(dǎo)通路[15]。還有一部分屬于腫瘤壞死因子(TNF)家族、成纖維細(xì)胞生長因子家族、BMP家族等。在毛囊發(fā)育過程中,雖然有一些其他分子的參與,但是這些分子大部分是通過上述的6個(gè)信號(hào)通路參與毛囊的發(fā)育過程。Hoxa5作為Hox家族重要成員之一,其編碼蛋白是與發(fā)育相關(guān)的重要轉(zhuǎn)錄因子。研究發(fā)現(xiàn)[16],Hox家族成員調(diào)節(jié)人體白色與棕色脂肪發(fā)育,并且在身體不同部位脂肪組織中的表達(dá)有很大差異,Hoxa5的甲基化水平調(diào)節(jié)著小鼠不同部位脂肪細(xì)胞的分化[17]。柳楠等[18]研究發(fā)現(xiàn),通過基因芯片技術(shù),篩選出在羊皮膚毛囊中表達(dá)的Hox基因家族中的基因,在羊的肩部(多毛區(qū))和腹部有顯著的表達(dá),在此過程中主要調(diào)控毛干的分化。
本研究選擇易培養(yǎng)活力高的成纖維細(xì)胞作為研究工具。選取子三代進(jìn)行轉(zhuǎn)染,避免了轉(zhuǎn)染過程中摻雜了其他的細(xì)胞,減少了試驗(yàn)的誤差。Hoxa5基因在成纖維細(xì)胞中能夠穩(wěn)定的存在并表達(dá)。首先,在mRNA的水平通過實(shí)時(shí)熒光定量PCR來檢測(cè)Hoxa5基因的表達(dá)。結(jié)果顯示,轉(zhuǎn)染組的mRNA量顯著高于空白對(duì)照組的量。其次,已知Hoxa5蛋白分子量約為30 kD,經(jīng)過轉(zhuǎn)染的細(xì)胞Hoxa5基因蛋白表達(dá)量明顯高于空白對(duì)照。經(jīng)過顯色曝光后條帶明顯比對(duì)照組的條帶黑、寬。經(jīng)Image J分析,相對(duì)表達(dá)的灰度值也明顯高于對(duì)照組。將目的基因Hoxa5與內(nèi)參基因β-actin的灰度值的比值進(jìn)行SPSS分析,結(jié)果顯示差異極顯著。進(jìn)一步說明了轉(zhuǎn)染后Hoxa5基因的過表達(dá)。
目前尚未發(fā)現(xiàn),Hoxa5基因在細(xì)胞水平上的表達(dá)量與羊毛性狀和毛囊密度之間關(guān)系的研究報(bào)道,本試驗(yàn)可對(duì)此起到補(bǔ)充作用。本研究通過基因的克隆,成功的構(gòu)建了Hoxa5基因表達(dá)載體,將載體轉(zhuǎn)染到成纖維細(xì)胞中,采用實(shí)時(shí)熒光定量PCR、Western Blot來檢測(cè)基因的表達(dá),從而來進(jìn)一步的研究基因的作用。經(jīng)過轉(zhuǎn)染的細(xì)胞,Hoxa5基因的mRNA和蛋白表達(dá)量明顯的升高,這從細(xì)胞層次上研究了與羊毛有關(guān)的基因。Hoxa5基因本身具有抑制毛囊發(fā)育的作用,通過在細(xì)胞層次上的研究Hoxa5基因過表達(dá),Hoxa5基因過表達(dá)的同時(shí)也將影響相關(guān)信號(hào)通路中基因的表達(dá)。Hoxa5基因的過表達(dá),會(huì)影響與它相關(guān)的基因表達(dá)增強(qiáng)與減弱。這為以后的個(gè)體水平上的研究提供了堅(jiān)實(shí)的基礎(chǔ),極大可能的解決綿羊羊毛生長的問題。
4 結(jié)論
本研究通過對(duì)Hoxa5基因質(zhì)粒的構(gòu)建、質(zhì)粒轉(zhuǎn)染成纖維細(xì)胞后進(jìn)行實(shí)時(shí)熒光定量PCR、Western Blot等,結(jié)果成功地構(gòu)建了質(zhì)粒并轉(zhuǎn)染成纖維細(xì)胞,轉(zhuǎn)染后細(xì)胞生長良好,Hoxa5基因過表達(dá),mRNA表達(dá)量和蛋白的表達(dá)量極顯著高于對(duì)照組,為進(jìn)一步在個(gè)體水平上研究其功能奠定基礎(chǔ)。

