頂復門原蟲酰基CoA結合蛋白中的生物信息學分析及功能預測
周冰心,傅 勇,劉 群,劉 晶
(中國農業大學動物醫學院 國家動物寄生原蟲實驗室農業部動物流行病學重點實驗室,北京 海淀 100193)
頂復門原蟲是一類專性細胞內寄生原蟲,包括弓形蟲(Toxoplasma gondii)、隱孢子蟲(Cryptosporidium spp.)、瘧原蟲(Plasmodium spp.)等,是人和動物的重要病原。這些頂復門原蟲不僅能利用宿主細胞的脂肪酸,同時自身也存在脂肪酸代謝1]。盡管頂復門原蟲的脂肪酸代謝途徑在不同種屬之間存在很大差異[2],如惡性瘧原蟲存在Ⅱ型脂肪酸代謝途徑,隱孢子蟲存在Ⅰ型脂肪酸合成途徑,弓形蟲同時存在兩種途徑[3],但游離的脂肪酸只有被CoA或酰基載體蛋白硫脂化形成脂酰CoA之后才能夠參與細胞內的各種代謝途徑。
脂酰CoA需要載體蛋白協助才能轉運到各靶位點發揮作用。生物體內的脂肪酸載體蛋白主要有3種,分別為脂肪酸轉運蛋白(Fatty acid transport proteins,FATPs)、脂肪酸結合蛋白(Fatty acid binding proteins,FABPs)和酰基CoA結合蛋白(Acyl coenzyme A-binding proteins,ACBPs)。其中ACBPs是一類保守性極強的家族蛋白,又稱為安定結合抑制劑或地西泮結合抑制劑,廣泛存在于真核生物中[4]。目前關于ACBP在植物、哺乳動物中的結構與功能研究相對深入,但對真核生物中頂復門原蟲的ACBP研究鮮有文獻報道,本研究以隱孢子蟲已公布的ACBP為模板[5-6],從NCBI數據庫中搜索到一些具有代表性的頂復門原蟲的ACBPs氨基酸序列,包括隱孢子蟲、新孢子蟲、弓形蟲、瘧原蟲、巴貝斯蟲、艾美耳球蟲,并利用 ToxoDB、CryptoDB、PlasmoDB等專屬數據庫對預測的部分蟲種ACBPs進行核實。利用生物信息學軟件對這些蛋白的氨基酸序列進行比對分析,對其理化性質、進化情況、蛋白結構和功能進行預測,歸納其異同點,為頂復門原蟲脂肪酸代謝研究提供理論依據。
1 材料與方法
1.1 頂復門原蟲ACBPs序列來源及比對數據庫NCBI 數 據 庫 (https://www.ncbi.nlm.nih.gov/);ToxoDB 數據庫(http://toxodb.org/toxo/);CryptoDB 數據庫(http://cryptodb.org/cryptodb/);PlasmoDB 數據庫(http://plasmodb.org/plasmo/)。
1.2 理化性質分析 運用在線工具ExPASy-ProtParam(https://web.expasy.org/protparam/)分析頂復門原蟲ACBPs的相對分子量、氨基酸組成、等電點、親水性等理化性質。
1.3 系統進化分析 應用DNAMAN(V6)軟件對頂復門原蟲ACBPs氨基酸殘基進行比對分析并構建系統發育樹。
1.4 保守性結構域分析 運用在線工具SMART(http://smart.embl-heidelberg.de/)分析頂復門原蟲ACBPs蛋白的保守性結構域,并使用IBS 1.0軟件繪制頂復門原蟲ACBPs的保守性結構域圖。
1.5 二級和三級結構預測 運用在線軟件Predict-Protein(https://www.predictprotein.org)對頂復門原蟲ACBPs的二級結構進行預測;運用在線軟件SWISS-MODEL(https://www.swissmodel.expasy.org)將頂復門原蟲ACBPs同源建模進而預測三級結構,同時使用在線工具 RAMPAGE(http://mordred.bioc.cam.ac.uk/~rapper/rampage.php)對預測到的三級結構進行驗證。
1.6 亞細胞定位和功能預測 運用在線工具MultiLoc2(http://abi.inf.uni-tuebingen.de/Services/MultiLoc2)以及 TargetP 1.1 Server(http://www.cbs.dtu.dk/services/TargetP/)對頂復門原蟲ACBPs的亞細胞定位進行預測。
2 結果與分析
2.1 頂復門原蟲ACBPs理化性質分析 通過比對隱孢子蟲的ACBP序列發現,隱孢子蟲與新孢子蟲均只有一個ACBP,弓形蟲、巴貝斯蟲、艾美耳球蟲各有2個ACBP,瘧原蟲有4個ACBP(表1)。ACBPs按照蛋白質分子量大小可分為兩大類:Ⅰ型分子量較小,約為10 kDa左右,如NcACBP1,PfACBP1,TgACBP1,EtACBP1等;Ⅱ型ACBPs分子量較大,約為30 kDa左右,如TgACBP2,BbACBP2等。
蛋白質的親水性與其氨基酸的極性有關,等電點主要取決于其氨基酸所帶的電荷性質,同時也與該蛋白的大小及其亞細胞定位相關[7]。對頂復門原蟲ACBPs氨基酸序列的親水性和等電點分析發現,其絕大多數氨基酸為疏水性,故所有ACBPs的親水性質均為負值,且親水性大小依次為 Ⅰ型<Ⅱ型。頂復門原蟲 ACBPs的等電點相差較大,CpACBP帶負電荷的氨基酸(Asp+Glu,14.9%)大于帶正電荷的氨基酸(Lys+Arg,11.2%),其等電點最低;而PfACBP4(Asp+Glu,11.30%)小于(Lys+Arg,14.00%),其等電點最高。
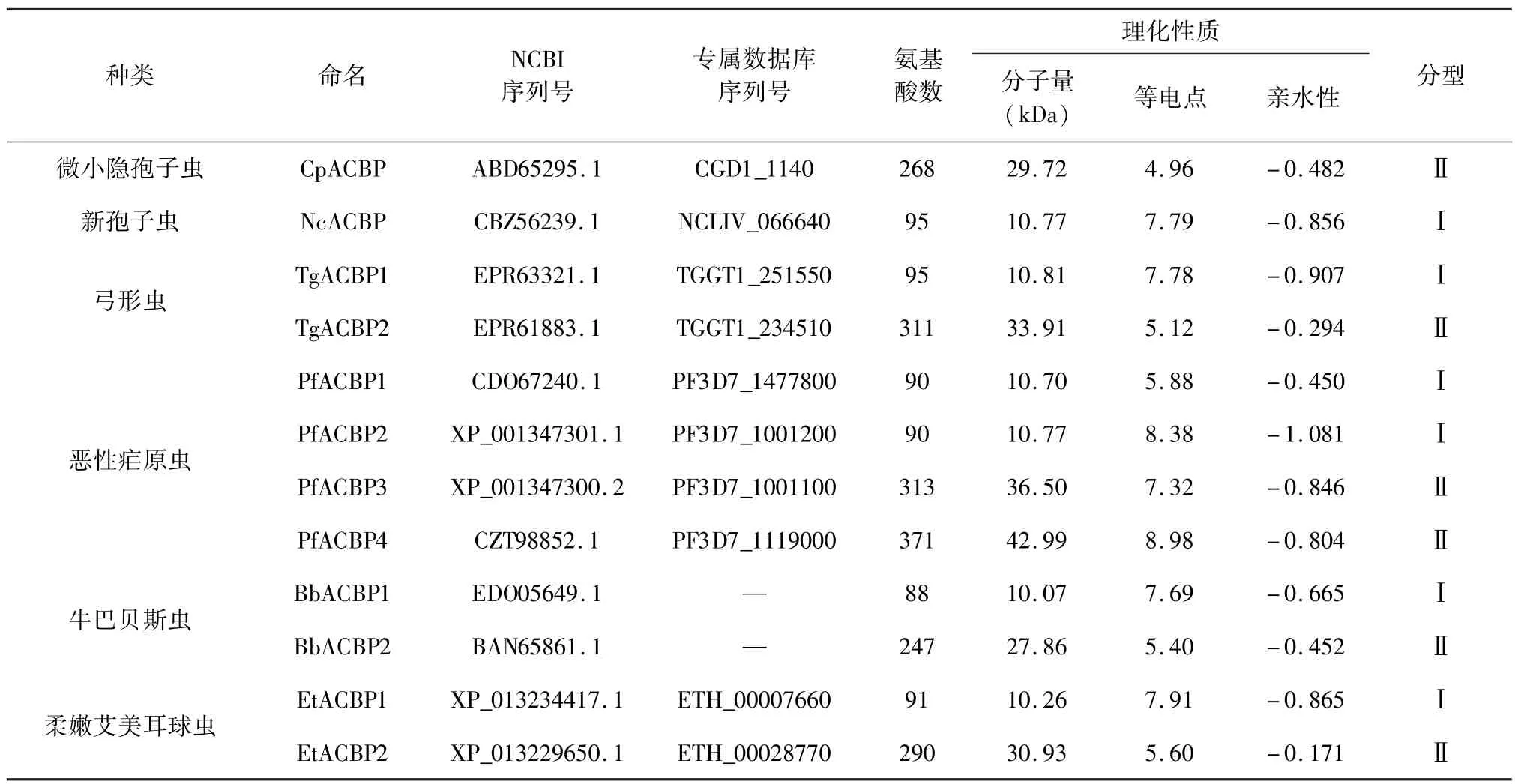
表1 幾種頂復門原蟲酰基輔酶A結合蛋白(ACBP)的理化參數
2.2 頂復門原蟲ACBPs的系統進化分析 同源性是指在進化過程中源于同一祖先的分支之間的關系,對氨基酸序列的同源性進行分析有助于推測各物種間的親緣關系。對頂復門原蟲ACBPs氨基酸殘基比對發現,該蛋白在進化過程中保守性非常強,見封二彩版圖1中所示粉色標注部分的幾種氨基酸殘基如 Tyr(Y)、Lys(K)、Cys(C)、Gly(G)、Val(V)、Ala(A)的相似性高達75%,均是構成ACBD所需的保守性氨基酸殘基。而且大部分氨基酸殘基的相似性可達33%。這些相似性極強的氨基酸殘基可能在ACBPs的結構與穩定性、有效折疊以及與其配體結合或其他功能中起到重要作用。
系統發育樹可以描述不同生物之間的相關關系,并揭示生物的進化歷史過程。NcACBP與TgACBP1以及TgACBP2與CpACBP在系統發育樹中均相距很近(圖2),說明兩者在物種進化過程中親緣性非常高;此外,進化樹分支的長短體現出此類蛋白質在進化過程中出現的先后順序,由此推斷出EtACBP1是在頂復門原蟲進化過程中最早出現,而PfACBP4則出現的最晚。雖然系統發育樹并不能揭示各頂復門原蟲ACBPs之間的聯系,但能夠說明這些蛋白參與了頂復門原蟲的進化過程[4]。
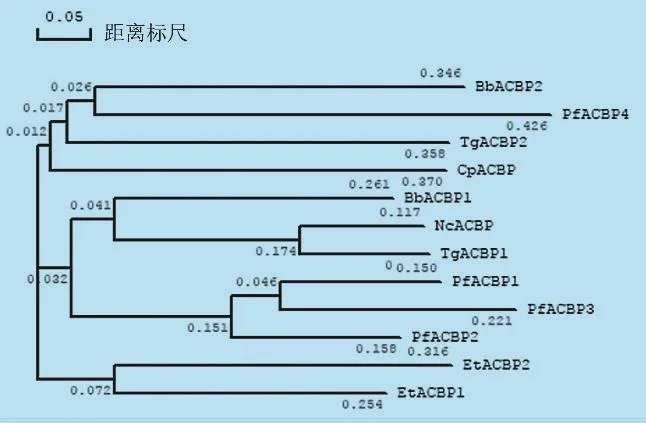
圖2 頂復門原蟲ACBPs的氨基酸系統發育樹
2.3 頂復門原蟲ACBPs的保守性結構域 結構域是生物大分子中具有特異結構和獨立功能的區域,是蛋白質生理功能的結構基礎。保守性結構域是指在生物進化或者一個蛋白家族中具有不變或相同的結構域,對蛋白質的保守性結構域的研究有助于揭示其在生物進化過程中的重要功能。對頂復門原蟲ACBPs的保守性結構域分析發現,不同蟲體的ACBPs都至少含有1個ACBD,但在不同物種中該結構所處的位置有所差異(圖3)。蛋白質分子量越大,其結構與功能也越復雜。Ⅰ型ACBPs僅含有1個ACBD,且位于3~89位氨基酸殘基處,說明其蛋白功能比較單一且特異;Ⅱ型ACBPs除了2個ACBD之外還包含2個ANK,位于其N-末端的第168~356位氨基酸殘基處,其中EtACBP2還含有1個跨膜結構域(Transmembrane region,TMR),位于其10~32位氨基酸殘基處;PfACBP4有2個ANK(294-323、327-356)和 4 個 ACBD(63-71、118-155、158-183、253-260),故其分子量較大,可能影響其對酰基CoA的結合親和力和轉運能力。
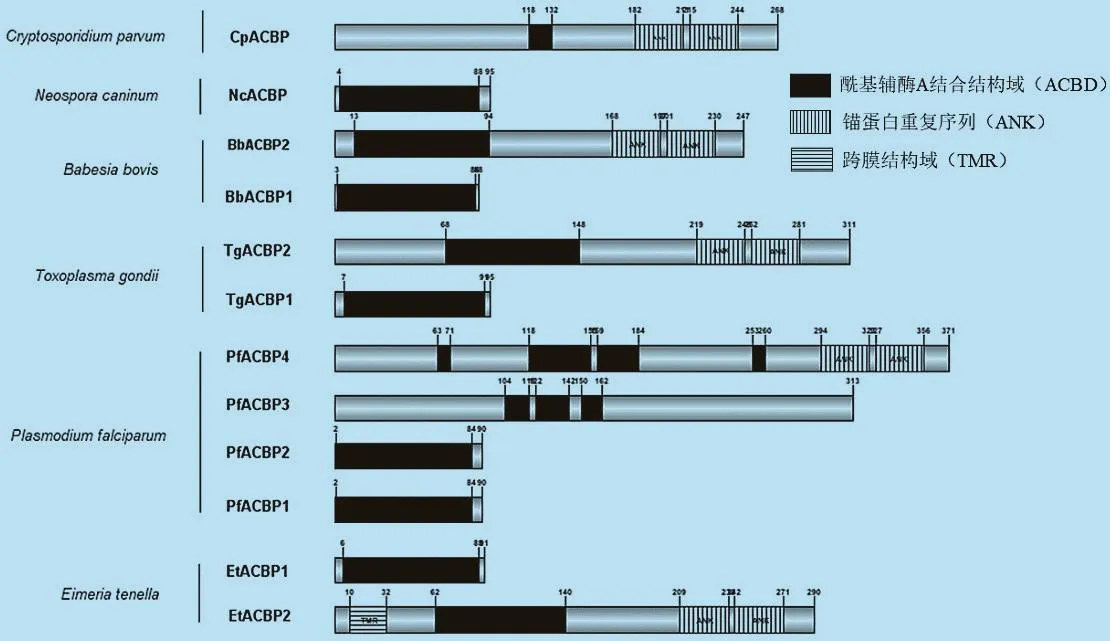
圖3 頂復門原蟲ACBPs的保守性結構域分析
2.4 頂復門原蟲ACBPs的二級和三級結構預測蛋白質二級結構是指多肽鏈借助氫鍵沿一維方向排列成具有周期性的結構構象,是多肽鏈局部的空間結構,主要構成有α螺旋、β折疊、β轉角、無規則卷曲等幾種形式。頂復門原蟲ACBPs的二級結構相對簡單,主要為α-螺旋(alpha-helix)和無規則卷曲(random coil)或稱為環(loop)。由于EtACBP2的保守性結構域中不僅僅由1個ACBD組成,還分別含有1個TMR及2個ANK,BbACBP2也含有2個ANK結構,所以兩者在二級結構上還包含有小部分延長鏈(extend strand)。除此之外,頂復門原蟲中其他ACBPs的二級結構均由簡單的α-螺旋和無規則卷曲組成。其中CpACBP的HELIX與LOOP各占一半(50%)。而且即使是同種寄生蟲的ACBP,其二級結構也存在差異,一般而言分子量大的ACBP中LOOP的含量要高于HELIX;分子量較小的 ACBP中 LOOP的含量則低于 HELIX。如TgACBP1(95 kDa)中HELIX約占60%,而TgACBP2(311 kDa)中HELIX僅占45%左右。
從蛋白質結構分析,蛋白質分子的疏水內核保守性比親水表面高,疏水結構核心大部分由規則的二級結構單元,即α螺旋和β折疊構成,其埋藏表面積較大。而蛋白質結構的親水表面則很少出現有規則的二級結構,常見的是轉角和無規則卷曲,這部分結構的埋藏表面積較小。因此,從其二級結構的構成便可以解釋,為何這幾種頂復門原蟲ACBPs的親水性均為負值。
蛋白質的三級結構是指球狀蛋白質的多肽鏈在二級結構的基礎上相互配置而形成特定的構象。根據預測結果,選定與模型蛋白比對覆蓋率最高(≥98%)的模型,可以發現ACBPs的三級結構較為簡單:4個α螺旋束蛋白上下排列形成疏水性結合口袋,其間由殘基環與之相連(見封二彩版圖4)。ACBPs的配體結合位點理論上由三部分組成:一部分以鹽橋或氫鍵的方式與酰基CoA的3′-磷酸集團結合并提供全部結合過程中40%的能耗,一部分以非極性分子作用力與腺嘌呤環相結合并保證其在極性溶劑中的穩定性,另一部分結合配體的酰基鏈以發揮轉運功能[8]。雖然蛋白質穩定性的微小變化僅導致其結合親和力和能量有所損失,但其結合能一旦發生微小改變,蛋白質的穩定性將產生巨大變化。不同物種ACBPs的α螺旋處氨基酸殘基有所不同,使得形成的結合口袋的大小、以及針對不同配體的結合親和力存在差異,以適應不同物種對不同脂肪酸的需求量差異,同時也說明蛋白質結構上存在的微小差異,可能導致其主要的生物功能發生很大變化。ACBPs為疏水性蛋白質,二級結構相對簡單,主要為α螺旋和無規則卷曲;其疏水性結合口袋末端氨基酸殘基的差異使其能夠與不同的配體特異性結合;其中,與酰基CoA特異性結合的ACBD是其結構中最重要的一部分,對三級結構的分析將有助于闡明ACBP與其他分子相互作用的空間結構基礎。
2.5 頂復門原蟲ACBPs的亞細胞定位和功能預測 蛋白質在核糖體合成后經蛋白質分選信號引導后被轉運到特定的細胞器中,部分蛋白質則被分泌到細胞外或留在細胞質中,只有轉運到正確的部位才能參與細胞的各種生命活動,如果定位發生偏差,將會對細胞功能產生重大影響。此外,蛋白質在細胞內常在不同的亞細胞環境中運動而發揮作用,而非靜止不動的;而且成熟的蛋白質必須在特定的細胞部位才能發揮其生物學功能。頂復門原蟲ACBPs的亞細胞定位預測結果發現,TgACBP2、EtACBP2、PfACBP3均屬于分泌蛋白,其他蛋白均定位于細胞質中。
蛋白質的結構可以決定其功能以及發揮此功能的亞細胞定位。ACBD是ACBPs中最為核心的結構域,而且ACBPs也是由于該結構域能夠以高特異性和親和性結合酰基CoA而命名的[4],所有的ACBPs都是由同一個祖先演化而來的,只是在該過程的基因復制和重排中產生了差異,所以才進化出了不同型的ACBPs[9]。ACBPs在細胞內的定位取決于其與何種配體相結合[15],故對其亞細胞定位的預測發現,ACBPs大部分定位于細胞質中,少部分屬于分泌蛋白,這與其在生物體內結合并轉運酰基CoA的功能有關。同時,EtACBP2上的跨膜結構域(TMR)可與信號肽重疊,既可將其自身錨定于細胞內膜系統又可將其輸送至胞外環境中[10],故EtACBP2被預測為分泌蛋白的一種。另外,BbACBP2、TgACBP2與PfACBP4中的ANK可參與轉錄起始、離子轉運、細胞信號傳導和細胞周期調節以及細胞骨架完整性等多種基本生物學功能,并將不同結構的蛋白質運送至內質網或質膜等特定的區域[11],故BbACBP2、TgACBP2與PfACBP4等均定位于細胞質中。
3 討論
ACBPs能夠高特異性、高親和力地結合不同長度的長鏈脂酰CoA(C14~C22);對短鏈和游離脂酰CoA的結合親和力低;不結合游離脂肪酸、棕櫚酰肉毒堿和類固醇等,在生物體內作為酰基CoA庫的前體并參與其轉運,發揮多種重要功能[9,12]。另外,ACBPs可以將質體中合成的脂肪酸轉運至內質網中,參與脂肪酸、甘油三酯等的生物合成與代謝活動[5]。釀酒酵母、惡性瘧原蟲以及人的ACBPs蛋白結構非常相似[10],且該蛋白在哺乳動物中的肝臟、心臟、骨骼肌等許多組織器官中也有較高的表達水平[11],提示ACBPs可能參與許多重要的基本生物功能,在生物進化過程中具有較高的保守性。本研究從生物信息學角度解析了幾種代表性的頂復門原蟲的ACBPs,也發現這類蛋白的保守性很強。早期研究認為,小分子量的ACBP是唯一能夠以高親和力結合酰基CoA的蛋白,但近年來的研究發現,植物和動物中存在分子量更大的ACBPs(50~80 kDa)[13-14],大分子量的ACBPs不僅僅局限于一個ACBD,有的還包含ANK以及TMR等結構,蛋白結構越復雜提示其功能越多樣化。本實驗室目前已經驗證弓形蟲中存在2個ACBPs,其中TgACBP1僅含有95個氨基酸殘基(~10 kDa),TgACBP2含有311個氨基酸殘基(~34 kDa),雖然兩者分子量大小存在差異但均具有結合并轉運酰基CoA的功能。
新興的基因編輯技術為研究ACBPs的功能提供了極大的便利。運用siRNA調控干擾ACBP基因在人肝癌細胞HepG2中的表達,可導致飽和(16∶0)及單不飽和(16∶1,18∶1)的脂肪酸在細胞內的含量顯著減少,并嚴重影響脂肪酸的新陳代謝活動15]。酵母和小鼠ACBPs基因缺失后,也表現出長鏈脂肪酸和神經酰胺的合成受損,表明ACBPs可能特異性的影響長鏈脂酰輔酶A代謝酶的活動[14]。
頂質體是頂復門原蟲特有的細胞器,參與頂復門原蟲脂肪酸、血紅素等的新陳代謝過程[16]。在頂質體內進行的各類新陳代謝過程中,脂肪酸是蟲體重要的能量來源,其中ACBPs在脂肪酸代謝中起著關鍵性作用。頂復門原蟲中的弓形蟲和新孢子蟲等胞內寄生原蟲能感染多種動物,同時作為機會性致病原蟲,不僅藥物治療效果不顯著而且還容易產生耐藥性,給人類健康和畜牧業生產帶來巨大威脅。從生物信息學入手找到它們的ACBPs,分析這些ACBPs的進化關系、保守性結構域、蛋白結構特征和生物學功能不僅能夠為研究頂復門原蟲脂肪酸代謝提供背景資料,還有可能為研發治療頂復門原蟲病的藥物提供理論依據。

