關節鏡下髁間窩微骨折術與髕下脂肪墊粉碎術在半月板損傷中的應用研究*
[湖南師范大學第一附屬醫院(湖南省人民醫院) 關節與運動醫學科,湖南 長沙 410000]
半月板是一種纖維軟骨結構,在關節內傳遞負荷、營養軟骨及減少摩擦等,其損傷后導致關節內異常負荷及炎癥的產生,繼發軟骨的退變,加速骨關節炎的進展[1],成為了運動醫學中的難題。早期的治療如半月板切除術,雖能在一定程度上緩解癥狀,但導致軟骨的 接觸應力大幅度增加。隨著微創技術的發展,關節鏡下修復半月板損傷是目前最佳的手術方式。然而,由于半月板最常見的損傷區域(白區)的無脈管系統分布,常導致術 后恢復受限[2]。因此,在行手術時,使用其他方法促進半月板修復成為了熱點[3]。目前臨床上的方法如纖維蛋白凝塊技術[4]、滑膜移植[5-6]、藥物[7]及生長因子[8]等,效果有限,且手術難度和費用較高。隨著基礎醫學的發展,間充質干細胞(mesenchyma stem cell,MSC)得到了廣泛的研究[9],并視其為修復半月板損傷的最佳種子細胞[10]。MSC可體外復合天然生物或高分子合成支架,構建半月板再生結構組織[11-12];缺損處自體MSC聚集組裝移植與關節腔內MSC注射能促進半月板再生等[13-15]。因此,圍手術期中利用干細胞的多分化潛能成為了焦點[16],但現有的MSC治療方法存在周期長、細胞來源少、支架力學性能及生物活性差和二次手術的可能等問題[17],導致其在臨床上使 用受到限制。從解剖中,本團隊發現膝關節毗鄰股骨髓腔,其內有髕下脂肪墊,若通過在關節鏡下手術處理,釋放骨髓及脂肪來源 的干細胞,可減少操作流程,有望加快和簡化修復半月板損傷的進程。本研究希望通過基礎實驗及臨床研究,分析關節鏡下髁間窩微骨折術與髕下脂肪墊粉碎術對半月板損傷修復的作用機制及其療效。
1 資料與方法
1.1 試劑與材料
DMEM/F12培養基、胎牛血清、甘氨酸購自Sigma公司;紅細胞裂解液、磷酸緩沖鹽溶液( p hosphate buffer saline,PBS)購自Beyotime公司;Human MSC Analysis Kit購自BD StemflowTM;二氧化碳CO2恒溫培養箱購自Thermo Forma公司;倒置顯微鏡、光學顯微鏡購自Olympus公司;臺式冷凍離心機購自Thermo Scientific公司。
1.2 髁間窩微骨折術
于股骨髁間窩內行微骨折術,吸引器將孔洞流出的骨髓液吸入離心管,轉運至實驗室。500 g離心5 min,棄上清,紅細胞裂解液重懸,避光裂解2 min,500 g離心5 min,棄上清,PBS重懸,500 g離心5 min,棄上清,加入10%胎牛血清(fetal bovine serum,FBS)的DMEM/F12培養基重懸,轉移至培養瓶,于37℃+5% CO2孵箱中培養,48 h后首次換液,每隔2 d換液,細胞匯合度達到80% 以上時傳代,對第1代實驗細胞進行鏡下觀察,用人間充質干細胞試劑盒對其進行鑒定。
1.3 髕下脂肪墊粉碎術
在股骨髁間窩前方髕下脂肪墊處,刨削刀將一小塊脂肪墊打碎成1.0 mm×1.0 mm大小,吸引器將脂肪小塊連同周圍的液體吸入離心管,轉運至實驗室。PBS反復清洗,100μm及40μm濾網過濾,400 g離心5 min,棄上清,紅細胞裂解液重懸,避光裂解10 min,400 g離心5 min,加入10% FBS的DMEM/ F12培養基重懸,轉移至培養瓶,于37℃+5% CO2孵箱中培養,48 h后首次換液,每隔2 d換液,細胞匯合度達到80%以上時傳代,對第1代實驗細胞進行鏡下觀察,用人間充質干細胞試劑盒對其進行鑒定。
1.4 一般資料
回顧性分析2014年1月-2016年1月診療的單側單純半月板損傷并行手術的患者,共計75例(75膝),病例均來自本院同一治療組的住院患者。納入標準:年齡18~35歲,無嚴重肝、腎、心及造血系統疾病等;既往無膝關節手術史;符合下述診斷標準者;簽署知情同意書者。排除標準:患有韌帶損傷、髕骨軟骨軟化、軟骨損傷、游離體及滑膜皺襞綜合征等其他關節紊亂疾病;精神狀態欠佳或不配合者;既往有膝關節手術史;患有嚴重肝、腎、心及造血系統疾病等;骨腫瘤;未簽知情同意書者。按照關節鏡中手術處理方式不同,將75例患者分為髁間窩微骨折術組(A組25例)、髕下脂肪墊粉碎術組(B組25例)及對照組(C組25例)。3組患者的年齡、體質指數(body mass index,BMI)、半月板損傷類型及性別構成比等方面分布相近,差異無統計學意義(P>0.05),具有可比性。見表1。

表1 各組患者一般資料比較Table 1 Comparison of general data among the three groups
1.5 診斷標準
1.5.1 癥狀急性受傷時膝關節內可有撕裂聲;上下樓時有打軟腿及錯動感;患肢有乏力不穩感;運動能力明顯下降。
1.5.2 體征急性期間可有關節腫脹;關節間隙壓痛;McMurry(+),Apley(+);過伸、過屈(+)。
1.5.3 檢驗結果急性損傷可有紅細胞沉降率(erythrocyte sedimentation rate,ESR)、C反應蛋白(C reactive protein,CRP)及白細胞數目增多;陳舊性損傷中血生化檢查一般無明顯異常。
1.5.4 影像學檢查X片及CT一般無明顯異常,偶見關節間隙增寬;磁共振成像(magnetic resonance imaging,MRI)提示半月板損傷(多為Ⅲ度信號,通向上下關節腔表面)影像。
1.6 治療方法
A組:在行半月板成型縫合術后,用微骨折器械,于髁間窩處鉆出小孔,使一部分骨髓和血液從孔中滲出。B組:在行半月板成型縫合術后,在髁間窩前方髕下脂肪墊處,用刨削刀將一小塊脂肪墊(約0.5 cm×0.5 cm)充分反復打碎,成1.0 mm×1.0 mm大小。C組:空白對照組,行常規的半月板縫合術后,并未進行其他特殊處理。
常規手術方式:麻醉滿意后,患者取仰臥位,取常規膝前內外側入路長約0.5 cm,置入關節鏡,探查可見半月板損傷,清理半月板白區撕裂組織,紅白區采用Fast-fix進行縫合,修整半月板邊緣,注入玻璃酸鈉,彈力繃帶加壓包扎。術中具體過程見圖1。
1.7 治療后隨訪及療效評估
所有患者手術前及隨訪時均采用Lysholm、視覺模擬評分法(visual analogue scale,VAS)評分 及不良事件(關節腫脹及膝前區疼痛)評估。
1.8 統計學方法
應用SPSS 21.0統計學軟件進行處理。檢驗數據差值是否符合正態分布和滿足組間方差齊性,如果滿足,采用均數±標準差(±s)表示,組間采用單因素方差分析與配對t檢驗;若不滿足,采用秩和檢驗,計數資料的比較采用χ2檢驗。以P<0.05為差異有統計學意義。
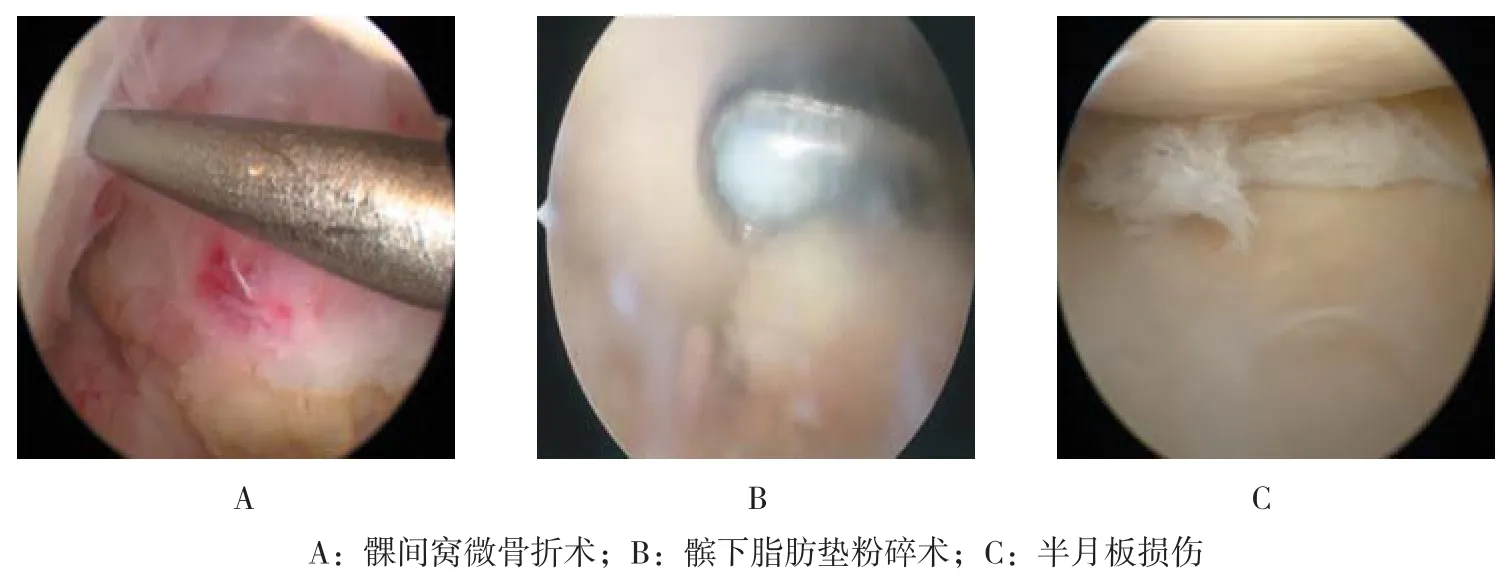
圖1 術中具體過程Fig.1 Intraoperative specific process

圖2 髁間窩微骨折體外細胞培養鏡下圖片Fig.2 Micrograph of cells released by fossa intercondyloidea of micro-fracture
2 結果
2.1 體外基礎實驗
2.1.1 髁間窩微骨折術體外實驗在體外培養8~10 d后可見培養瓶中細胞類似 成纖維細胞,生長迅速,長梭狀,呈旋渦狀分布,細胞界限清楚,排列緊密,密度較高,具有干細胞的特性,見圖2。將第1代細胞用人干細胞分析試劑盒進行鑒定,可見樣本細胞表面CD90、CD105、CD73及CD44表達比例高(>95%),符合干細胞的定義標準,考慮其為骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)[18],見圖3。
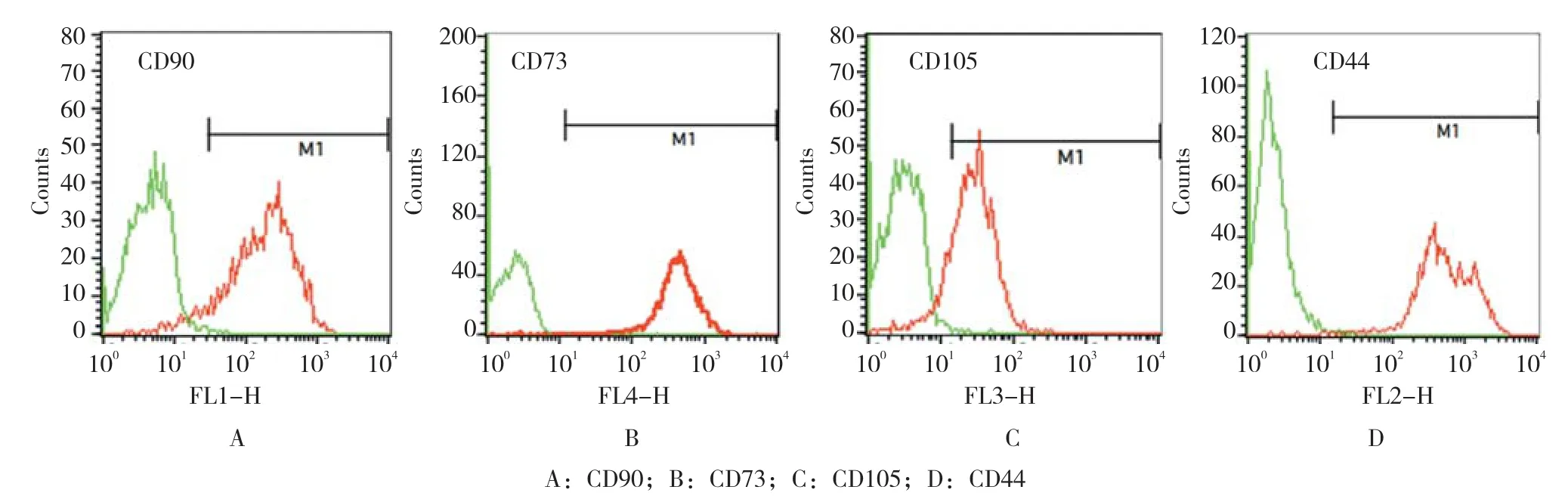
圖3 髁間窩微骨折體外細胞干細胞試劑盒鑒定結果Fig.3 Human MSC Analysis Kit results of cells released by fossa intercondyloidea of micro-fracture
2.1.2 髕下脂肪墊粉 碎術體外實驗在體外培養8~10 d后可見培養瓶中絕大多 數細胞類似成纖維細胞,含有少量雜質及壞死細胞,呈長梭狀,呈平行排列,網狀輻射狀生長,細胞界限清楚,排列規則,具有干細胞的特征,見圖4。將第1代細胞用人干細胞分析試劑盒進行鑒定,可見樣本細胞表面CD90、CD105及CD73表達比例高(>95%),CD44相對較少,符合干細胞的定義標準,考慮其為髕下脂肪墊來源干細胞(infrapatellar fat pad-derived stem cells,IPFPSCs)[18],見圖5。
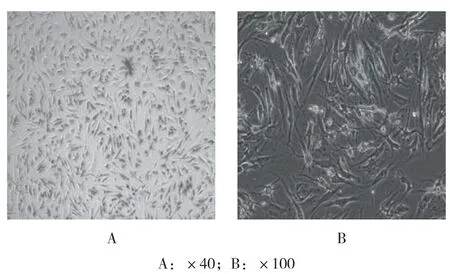
圖4 髕下脂肪墊粉碎體外細胞鏡下圖片Fig.4 Micrograph of cells released by comminution of subcutaneous fat pad
2.2 臨床研究
所有患者均獲平均10個月(8~11個月)隨訪,無神經血管損傷、感染等并發癥。術前,A、B、C組的Lysholm及VAS評分的組間差異無統計學意義(P>0.05),不良事件大致相同。術后末次隨訪中,各組末次隨訪的結果較治療前均有明顯改善,差異有統計學意義(P<0.05);A組與C組、B組與C組間的Lysholm及VAS評分差異具有統計學意義(P<0.05);A組與B組間的差異無統計學意義(P>0.05),見表2。B組的不良事件早期發生率高于A組及C組,末次隨訪時無明顯差異,見表3。半月板損傷修復術后情況見圖6。
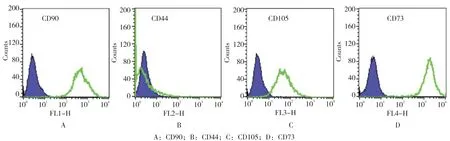
圖5 髕下脂肪墊粉碎體外細胞干細胞試劑盒鑒定結果Fig.5 Human MSC Analysis Kit results of cells released by comminution of subcutaneous fat pad
表2 各組治療前后Lysholm和VAS評分比較 (分,±s)Table 2 Comparison of Lysholm and VAS score among the three groups (score,±s)
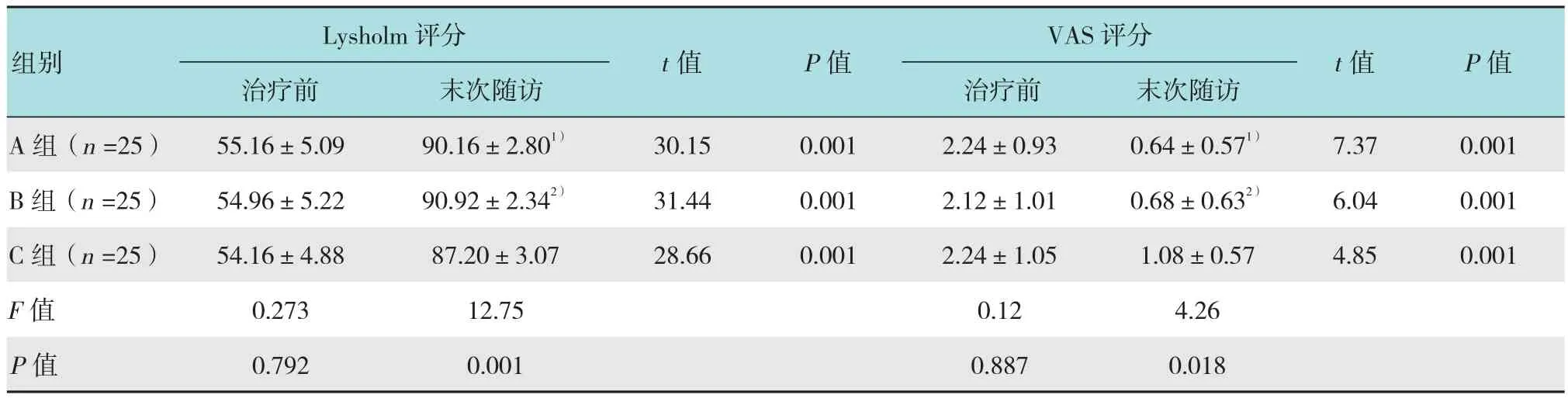
表2 各組治療前后Lysholm和VAS評分比較 (分,±s)Table 2 Comparison of Lysholm and VAS score among the three groups (score,±s)
注:1)A組與C組比較,差異有統計學意義(P <0.05);2)B組與C組比較,差異有統計學意義(P <0.05)
t值 P值治療前 末次隨訪 治療前 末次隨訪A組(n =25) 55.16±5.09 90.16±2.801) 30.15 0.001 2.24±0.93 0.64±0.571) 7.37 0.001 B組(n =25) 54.96±5.22 90.92±2.342) 31.44 0.0 01 2.12±1.01 0.68±0.632) 6.04 0.001 C組(n =25) 54.16±4.88 87.20±3.07 28.66 0.001 2.24±1.05 1.08±0.57 4.85 0.001 F值 0.273 12.75 0.12 4.26 P值 0.792 0.001 0.887 0.018 Lysholm評分VAS評分組別t值 P值
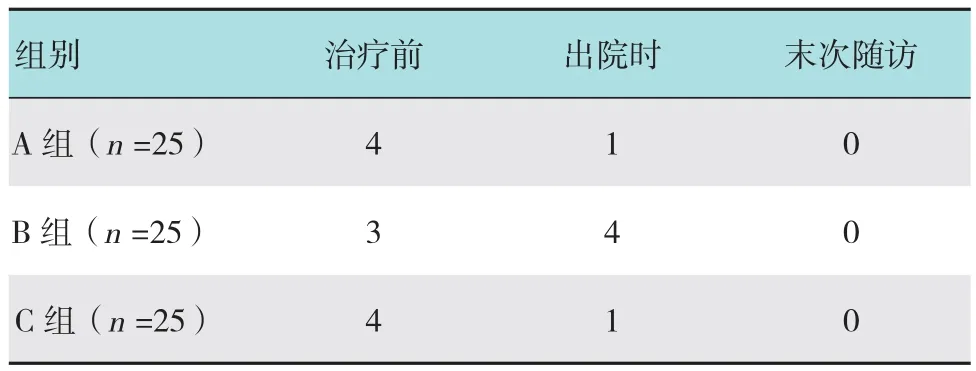
表3 各組治療前后不良事件發生例數比較 例Table 3 Comparison of adverse event rate among the three groups n
圖6 半月板損傷修復術后Fig.6 Repaired meniscus injury
3 討論
半月板損傷后增加關節內接觸壓力,導致關節功能障礙[19]。近年來,隨著基礎醫學的深入,通過再生醫學修復損傷的半月板得到了關注[20-21],并認為最佳的修復方法通過下列途徑:①細胞通過黏附于機械支架并形成新的組織形態;②選擇合適的種子細胞進行誘導分化,來促進組織的愈合及新基質的合成;③添加某種生長因子或尋找能刺激細胞分化及基因表達的信號[22-24]。
目前,研究者們希望使用MSCs治療半月板白區損傷。HORIE等[25]研究發現將滑膜干細胞移植黏附于半月板白區受損部位,最終可分化成類似于天然半月板成纖維軟骨的細胞;HATSUSHIKA等[26]通過組織學和MRI檢查發現滑膜干細胞使半月板缺損處滑膜早期填充,可有效保留更多的半月板;DUYGULU等[27]通過電鏡觀察到自體BMSCs可使半月板缺損處新生血管、纖維軟骨細胞及軟骨斑塊增多。因此,MSC被認為是修復半月板損傷的最佳種子細胞[28]。
臨床中常用微骨折術修復關節軟骨損傷,其機制是利用從骨髓腔流出的BMSC填充于缺損處,利用其多分化功能,最終可形成纖維軟骨[29]。由此,本研究設想其是否同樣可以利用來修復半月板損傷。相比常規在軟骨上的微骨折術,選擇髁間窩處微骨折,在釋放干細胞的基礎上,可避免造成新的軟骨損傷、能減少疼痛的發生率及康復難度。基礎實驗可證實術中釋放的骨髓液中含有BMSC;臨床隨訪可見Lysholm評分及VAS評分較對照組改善。因此,髁間窩微骨折術從理論、基礎和臨床應用中證實其對半月板損傷修復有良好的效果,這與HOWARTH等研究是相同的[30]。
半月板損傷后,髕下脂肪墊常發生水腫,導致膝前區疼痛。在術中,脂肪墊需修整,減少其病理炎癥的發展。研究表明:髕下脂肪墊靠近滑膜面,所處環境與關節腔類似,具有同源性[31],其干細胞為脂肪來源,具有多分化能力[32-33]。由此,本研究探索性地提出了髕下脂肪墊粉碎術,在緩解病理炎癥的基礎上,釋放脂肪干細胞至關節內。基礎實驗表明粉碎后的脂肪墊懸液中含有IPFPSC。臨床隨訪提示該技術的術后評分優于對照組,與髁間窩微骨折術的效果相當,這與NISHIMUTA及HINDLE等研究較為相似[32-34]。然而,本研究中發現,髕下脂肪墊粉碎術的早期不良事件發生率較高,遠期則無明顯差異,可能與脂肪墊的出血及無菌炎癥反應增加有關[35]。綜上所述,關節下髁間窩微骨折術與髕下脂肪墊粉碎術能在一定程度上促進半月板損傷的修復,并具有獨特的優勢。至于其具體的詳細作用機制及修復的遠期效果,還有待進一步研究。
[1]FELSON D T. Osteoarthritis as a disease of mechanics[J]. Osteoarthritis Cartilage, 2013, 21(1):10-15.
[2]BOCHYNSKA A I, VAN TIENEN T G, HANNINK G, et al. Development of biodegradable hyper-branched tissue adhesives for the repair of meniscus tears[J]. Acta Biomaterialia, 2016, 32:1-9.
[3]CUCCHIARINI M, MCNULTY A L, MAUCK R L, et al. Advances in combining gene therapy with cell and tissue engineering-based approaches to enhance healing of the meniscus[J]. Osteoarthritis Cartilage, 2016, 24(8):1330-1339.
[4]ISHIMURA M, OHGUSHI H, HABATA T, et al. Arthroscopic meniscal repair using fibrin glue. Part I:Experimental study[J]. Arthroscopy, 1997,13(5):551-557.
[5]SHIRAKURA K, NIIJIMA M, KOBUNA Y, et al. Free synovium promotes meniscal healing. Synovium, muscle and synthetic mesh compared in dogs[J]. Acta Orthopaedica Scandinavica, 1997, 68(1):51-54.
[6]CISA J, BASORA J, MADARNAS P, et al. Meniscal repa ir by synovial fl ap transfer. Healing of the avascular zone in rabbits[J]. Acta Orthopaedica Scandinavica, 1 995, 66(1):38-40.
[7]ZHANG S, MATSUSHITA T, KURODA R, et al. Local Administration of simvastatin stimulates healing of an avascular meniscus in a rabbit model of a meniscal defect[J]. American Journal of Sports Medicine, 2016, 44(7):1735-1743.
[8]PETERSEN W, PUFE T, ST?RKE C, et al. The effect of locally applied vascular endothelial growth factor on meniscus healing:gross and histological findings[J]. Arc hives of Orthopaedic and Trauma Surgery, 2007, 127(4):235-240.
[9]JONES E A, CRAWFORD A, ENGLISH A, et al. Synovial fl uid mesenchymal stem cells in heal th and early osteoarthritis:detection and functional evaluation at the single-cell level[J]. Arthritis Rheumatism, 2008, 58(6):1731-1740.
[10]TER HUURNE M, SCHELBERGEN R, BLATTES R, et al. Ant iin fl ammatory and chondroprotective effects of intraarticular injection of adipose-derived stem cells in experimental osteoarthritis[J]. Arthritis Rheumatism, 2012, 64(11):3604-3613. [11]KONDO S, MUNETA T, NAKAGAWA Y, et al. Transplantation of autologous synovial mesenchymal stem cells promotes meniscus regeneration in aged primates[J]. J Orthop Res, 2017, 35(6):1274-1282.
[12]HATSUSHIKA D, MUNETA T, H ORIE M, et al. Intraarticular injection of synovial stem cells promotes meniscal regeneration in a rabbit massive meniscal defect model[J]. Journal of Orthopaedic Research, 2013, 31(9):1354-1359.
[13]AL FAQEH H, NOR HAMDAN B M, C HEN H C, et al. The potential of intra-articular injection of chondrogenic-induced bone marrow stem cells to retard the progression of osteoarthritis in a sheep model[J]. Experimental Gerontology, 2012, 47(6):458-464.
[14]TORATA NI T, NAKASE J, NUMATA H, et al. Scaffold-free tissue-engineered allogenic adipose-derived stem cells promote meniscus healing[J]. Arthroscopy, 2017, 33(2):346-354.
[15]NUMPAISAL P O, ROTHRAUFF B B, GOTTARDI R, et al. Rapidly dissociated autologous meniscus tissue enhances meniscus healing:An in vitro study[J]. Connective Tissue Research, 2016, 58(3-4):355-365.
[16]BOCHYNSKA A I, HANNINK G, GRIJPMA D W, et al. Tissue adhesives for meniscus tear repair:an overview of current advances and prospects for future clinical solutions[J]. Journal of Materials Science Materials in Medicine, 2016, 27(5):85.
[17]BUMA P, RAMRATTAN N N, VAN TIENEN T G, et al. Tissue engineering of the meniscus[J]. Biomaterials, 2004, 25(9):1523-1532.
[18]DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for de fi ning multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position sta tement[J]. Cytotherapy, 2006, 8(4):315-317.
[19]WALKER P S, ARNO S, BELL C, et al. Function of the medial meniscus in force transmission and stability[J]. Journal of Biomechan ics, 2015, 48(8):1383-1388.
[20]YU H, ADESIDA A B, JOMHA N M. Meniscus repair using mesenchymal stem cells - a comprehensive review[J]. Stem Cell Research Therapy, 2015, 6:86.
[21]LIU C, TOMA I C, MASTROGIACOMO M, et al. Meniscus reconstruction:today’s achievements and premises for the future[J]. Archives of Orthopaedic and Trauma Surgery, 2013, 133(1): 95-109.
[22]FREYMANN U, METZLAFF S, KRUGER J P, et al. Effect of human serum and 2 different types of platelet concentrates on human meniscus cell migration, proliferation, and matrix formation[J]. Arthroscopy, 2016, 32(6):1106-1116.
[23]PIONTEK T, CIEMNIEWSKA-GORZELA K, NACZK J, et al. Complex meniscus tears treated with collagen matrix wrapping and bone marrow blood injection:a 2-year clinical follow-up[J]. Cartilage, 201 6, 7(2):123-139.
[24]HADIDI P, PASCHOS N K, HUANG B J, et al. Tendon and ligament as novel cell sources for engineering the knee meniscus[J]. Osteoarthritis Ca rtilage, 2016, 24(12):2126-2134.
[25]HORIE M, DRISCOLL M D, SAMPSON H W, et al. Implantation of allogenic synovial stem cells promotes meniscal rege neration in a rabbit meniscal defect model[J]. J Bone Joint Surg Am, 2012, 94(8):701-712.
[26]HATSUSHIKA D, MUNETA T, NAKAMURA T, et al. Repetitive allogeneic intraarticular injections of s ynovial mesenchymal stem cells promote meniscus regeneration in a porcine massive meniscus defect model[J]. Osteoarthritis Cartilage, 2014, 22(7):941-950.
[27]DUYGULU F, DEMIREL M, ATALAN G, et al. Effects of intraarticular a dministration of autologous bone marrow aspirate on healing of full-thickness meniscal tear:an experimental study on sheep[J]. Acta orthopaedica et traumatologica turcica, 2012, 46(1):61-67.
[28]QI Y, CHEN G, FE NG G. Osteoarthritis prevention and meniscus regeneration induced by transplantation of mesenchymal stem cell sheet in a rat meniscal defect model[J]. Experimental and Therapeuti c Medicine, 2016, 12(1):95-100.
[29]OGURA T, BRYANT T, MINAS T. Biological knee reconstruction with concomitant autologous chondrocyte implantation and meniscal allograft transplantation:mid- to long-term outcomes[J]. Orthopaedic Journal of Sports Medicine, 2016, 4(10):2325967116668490.
[30]HOWARTH W R, BROCHARD K, CAMPBELL S E, et al. Effect of Microfracture on Meniscal Tear Healing in a Goat (Capra hircus) Model[J]. Orthopedics, 2016, 39(2):105-110.
[31]FELIMBAN R, YE K, TRAIANEDES K, et al. Differentiation of stem cells from human infrapatellar fat pad:characterization of cells undergoing chondrogenesis[J]. Tissue Engineering Part A, 2014, 20(15-16):2213-2223.
[32]NISHIMUTA J F, BENDERNAGEL M F, LEVENSTO N M E. Co-culture with infrapatellar fat pad differentially stimulates proteoglycan synthesis and accumulation in cartilage and meniscus tissues[J]. Connective Tissue Research, 2017, 58(5):447-455.
[33]HINDLE P, KHAN N, BIANT L, e t al. The infrapatellar fat pad as a source of perivascular stem cells with increased chondrogenic potential for regenerative medicine[J]. Stem Cells Translational Medicine, 2017, 6(1):77-87.
[34]NORDBERG R C, CHAROENPANICH A, VAUGHN C E, et al. Enhanced ce llular in fi ltration of human adipose-derived stem cells in allograft menisci using a needle-punch method[J]. Journal of Orthopaedic Surgery and Research, 2016, 11(1):132.
[35]EYMARD F, PIGENET A, CITADELLE D, et al. Knee and hip intra-articular adipose tissues (IAATs) compared with autologous subcutaneous adipose tissue:a specific phenotype for a central player in osteoarthritis[J]. A nn Rheum Dis, 2017, 76(6):1142-1148.

