側腦室注射瘦素對2型糖尿病大鼠阿黑皮素原及神經肽Agouti相關蛋白的影響*
董 迎,呂春鳳,李文化
(天津市北辰醫院內分泌科 300400)
瘦素是一種肽類蛋白質,由白色脂肪組織細胞分泌。上世紀50年代至今瘦素在機體代謝方面的獲益被逐步證實。隨著重組瘦素技術的發展,瘦素相關的基礎及臨床實驗也有廣泛開展。近期有研究證實低劑量瘦素在不減少動物進食量及體質量的情況下仍然會降低2型糖尿病大鼠血糖水平[1]。這項研究首次證實瘦素可獨立于其對體質量及進食量的作用之外而調節血糖水平。在另外一項實驗中未經瘦素治療的肥胖大鼠在進食量與經瘦素治療的大鼠相等的情況下并不能達到瘦素治療組大鼠達到的控制血糖的水平[2]。有趣的是在1型糖尿病大鼠中,瘦素同樣表現出了治療糖尿病的作用[3-4],這表明瘦素獨立于胰島素之外的調節血糖的作用是通過中樞神經系統及其介質實現的[5]。
瘦素在大腦中調節抗2型糖尿病作用的特定區域在2005年首次被確定,該研究證實僅在下丘腦的弓狀核(ARH)恢復瘦素表達可以降低肥胖,高胰島素血癥和嚴重高血糖大鼠的血糖水平,而不影響其進食量和體質量[6]。并且,僅在下丘腦的弓狀核(ARH)的阿黑皮素原(POMC)分泌神經元選擇性表達瘦素的情況下對瘦素缺乏的糖尿病大鼠便可達到顯著的血糖控制效果[7]。這些結果證實ARH的POMC的表達是瘦素在2型糖尿病大鼠中抗糖尿病作用的重要途徑[7]。另外,在野生型大鼠中選擇性消除POMC的表達并未出現預期的嚴重高血糖表現[8]。這表明除POMC之外的其他分泌性神經元同樣參與瘦素介導的血糖控制作用。ARH同時包含有與POMC類似的神經肽Agouti相關蛋白(AGRP)分泌神經元[6]。AGRP是中樞黑皮素系統中的重要的神經肽成分具有拮抗α-促黑素細胞激素與黑皮素受體4(MC4R)結合的作用[9]。這些受體在中樞神經體用的神經元中廣泛表達,這些神經元通過軸突與POMC和AGRP表達神經元廣泛連接,作為瘦素表達神經元的二階神經元[10-11],MC4R的缺失在大鼠及人體都會引起肥胖[9]。本研究通過對2型糖尿病大鼠進行側腦室瘦素注射,并隨后進行空腹血糖、POMC及AGRP的測定,以觀察瘦素在中樞神經系統中對上述神經遞質的影響,進一步明確瘦素對2型糖尿病大鼠血糖控制作用的上游通路。
1 材料與方法
1.1材料
1.1.1實驗動物 8周齡2型糖尿病SD雄性大鼠80只,購自北京華阜康生物科技股份有限公司[實驗動物機構許可證號SCXK(京)2014-0004],平均體質量為(200±20)g。
1.1.2主要試劑 重組瘦素購自美國R&D Systems 公司;鏈脲佐菌素(STZ)美國SIGMA公司生產;大鼠POMC ELISA分析檢測試劑盒及AGRP ELISA分析檢測試劑盒購自德賽診斷(上海)有限公司。
1.2方法
1.2.12型糖尿病SD大鼠模型制備 健康雄性SD大鼠以高糖高脂飼料(10%豬油、20%蔗糖、10%蛋黃粉、0.5%膽酸鈉、59.5%基礎飼料)喂養,4周后腹腔注射STZ 30 mg/kg,繼續高糖高脂飲食。4周以后斷尾,便攜式血糖儀測定大鼠尾尖血糖,選取空腹血糖持續1周穩定大于或等于16.7 mmol/L作為2型糖尿病模型,并同時觀察大鼠是否出現多飲、多食、尿量增多、生長遲緩、身體消瘦等糖尿病癥狀[12]。
1.2.2實驗分組 將大鼠分為側腦室內注射瘦素組(n=40)和側腦室內注射vehicle對照組(n=40)。
1.2.3側腦室定位 以40 mg/kg劑量腹腔注射2%戊巴比妥鈉,使各組大鼠麻醉。平整放好麻醉后大鼠,將其牙齒扣在齒桿上并扭緊鼻夾,耳桿插入雙耳外耳道中,使兩邊耳桿刻度一致,固定好頭部。適當調節大鼠身體高度,使大鼠身體和頭部保持水平,并將其固定好。用棉球蘸取聚維酮碘消毒頭部皮膚,眼科剪剪開頭部皮膚并用手術刀片剝離骨膜,并用3%過氧化氫灼燒骨膜使冠狀縫和矢狀縫的交點(前囟)充分暴露,并用記號筆將此點標記[13]。根據Paxinos-Watson鼠腦定位圖譜,以前囟為中心定好坐標,讀取立體定位儀上讀數并記錄。調節 XYZ 軸至指定位點,使用記號筆將此點標記,見圖1A。
1.2.4側腦室注射瘦素 在上述指定的位點處使用電動顱骨鉆將顱骨鉆開一個直徑約0.5 mm的小孔,見圖1B。將已固定好位置的裝有瘦素的微量進樣器緩緩地插入到4.5 mm深度時停止。觀察大鼠的呼吸情況,若沒有異常情況把藥物緩緩地注射完畢。瘦素注射劑量為5 μL/kg,對照組注射等劑量vehicle。注射完畢后停頓2 min,使得微量進樣器中所有藥物進入到大鼠腦內。慢慢地取出微量進樣器,并使用聚羧酸鋅水門汀封閉傷口,并以肌內注射3.2萬單位/鼠青霉素進行抗感染治療[14]。將已注射大鼠清醒后進行獨籠飼養,術后12 h對其禁食但不禁水。
1.2.5血液樣本 各組分別在造模后48 h并禁食4 h后剪尾取血4 mL,用Surestep Life scan血糖儀檢測大鼠靜脈血糖水平,剩余血樣室溫放置1 h后,以2 000 r/min離心10 min,分離血清,放置于-80 ℃的超低溫冰箱中保存。按相應的血液指標檢測試劑盒說明書測定各組POMC及AGRP。

A:使用腦立體定位儀將大鼠頭部固定;B:使用微量進樣器將瘦素注入大鼠側腦室部位
圖1側腦室定位及注射瘦素
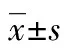
2 結 果
與對照組相比,側腦室注射瘦素組大鼠平均空腹血糖為(35.40±3.02)mmol/L,顯著低于對照組大鼠空腹血糖(39.62±2.66)mmol/L(t=1.548,P<0.05),側腦室注射瘦素組大鼠血清POMC表達顯著高于對照組(P<0.05),側腦室注射瘦素組大鼠血清神經肽Agouti相關蛋白(AGRP)表達顯著低于對照組(P<0.05),見圖2、3。

圖2 兩組大鼠POMC水平比較

圖3 兩組大鼠AGRP水平比較
3 討 論
盡管近年來糖尿病的治療藥物及手段都有了發展,且其就醫渠道也得到了改善,但糖尿病患者仍面臨血糖控制不理想、并發癥較多、生活質量較差的問題[15-16],其心血管事件仍呈高發狀態[17-18],美國有報道指出40%的糖尿病患者血糖沒有得到良好控制[19]。盡管胰島素的發展使1、2型糖尿病得到了良好控制,但這些藥物并未重建糖尿病患者的代謝平衡,且隨著治療時間延長,還會帶來嚴重的并發癥狀,所以,探討一種新的平衡代謝的藥物是很有必要的。
瘦素作為一種由脂肪組織產生、分泌的激素,可與中樞神經系統中的瘦素受體相結合激發一系列的下游效應以達到調節機體代謝的作用[20-21],位于第3腦室底部的弓狀核在瘦素的能量代謝調節過程中發揮主要作用。弓狀核含有兩類不同的瘦索反應性一級神經元,即分泌神經肽Y(NPY)/AGRP神經元和POMC神經元,前者能增強食欲、抑制能量消耗,后者所分泌的POMC的降解產物α-黑色素細胞刺激素(α-MSH)可起到抑制食欲和促進能量消耗的作用。瘦素可抑制NPY/AGRP神經元產生和釋放NPY、AGRP,另一方面則可促進POMC神經元產生和釋放POMC,從而調節機體的能量代謝。本研究通過對進行腦室注射瘦素大鼠的2型糖尿病大鼠POMC及AGRP的測定,觀察到瘦素在中樞神經系統中對上述神經遞質的影響,進一步明確瘦素對2型糖尿病大鼠血糖控制作用的上游通路。進一步的分析瘦素-中樞神經系統-血糖通路相關分子機制顯然是必要的,以進一步明確瘦素作用從而使其有機會開發為抗糖尿病治療的新途徑。
[1]PELLEYMOUNTER M A,CULLEN M J,BAKER M B,et al.Effects of the obese gene product on body weight regulation in ob/ob mice[J].Science,1995,269(5223):540-543.
[2]SCHWARTZ M W,BASKIN D G,BUKOWSKI T R,et al.Specificity of leptin action on elevated blood glucose levels and hypothalamic neuropeptide Y gene expression in ob/ob mice[J].Diabetes,1996,45(4):531-535.
[3]LIN C Y,HIGGINBOTHAM D A,JUDD R L,et al.Central leptin increases insulin sensitivity in streptozotocin-induced diabetic rats[J].Am J Physiol Endocrinol Metab,2002,282(5):1084-1091.
[4]CHINOOKOSWONG N,WANG J L,SHI Z Q.Leptin restores euglycemia and normalizes glucose turnover in insulin-deficient diabetes in the rat[J].Diabetes,1999,48(7):1487-1492.
[5]FUJIKAWA T,CHUANG J C,SAKATA I,et al.Leptin therapy improves insulin-deficient type 1 diabetes by CNS-dependent mechanisms in mice[J].Proc Nati Acad Sci USA,2010,107(40):17391-17396.
[6]COPPARI R,ICHINOSE M,LEE C E,et al.The hypothalamic arcuate nucleus:A key site for mediating leptin′s effects on glucose homeostasis and locomotor activity[J].Cell Metab,2005,1(1):63-72.
[7]HUO LIHONG,GAMBER K,GREELEY S,et al.Leptin-dependent control of glucose balance and locomotor activity by POMC neurons[J].Cell Metab,2009,9(6):537-547.
[8]BALTHASAR,NINA,COPPARI,et al.Leptin receptor signaling in POMC neurons is required for normal body weight homeostasis[J].Neuron,2004,42(6):983-991.
[9]CONE R D.Anatomy and regulation of the central melanocortin system[J].Nat Neurosci,2005,8(5):571-578.
[10]BAGNOL D,LU X Y,KAELIN C B,et al.Anatomy of an endogenous antagonist:relationship between Agouti-related protein and proopiomelanocortin in brain[J].J Neurosci,1999,19(18):RC26.
[11]KISHI T,ASCHKENASI C J,LEE C E,et al.Expression of melanocortin 4 receptor mRNA in the central nervous system of the rat[J].J Comp Neurol,2003,457(3):213-235.
[12]段薇,張學梅,于萌,等.2型糖尿病大鼠急性心肌缺血對心肌新生血管的影響[J].中華糖尿病雜志,2012,4(6):361-364.
[13]劉清忠,王大斌,韓麗梅,等.側腦室注射丹參酮對腦癱模型大鼠神經行為學的影響[J].中國中醫急癥,2016,25(7):1281-1284.
[14]李聃丹.側腦室注射CART對T2DM大鼠胰島素調節作用及機制初步研究[D].重慶:第三軍醫大學,2014.
[15]WISLICKI L.Diabetes mellitus and cancer[J].Eur J Int Med,1971,1(5744):245-252.
[16]MAZZONE T,CHAIT A,PLUTZKY J.Cardiovascular disease risk in type 2 diabetes mellitus:insights from mechanistic studies[J].Lancet,2008,371(9626):1800-1809.
[17]LARSEN J,BREKKE M,SANDVIK L,et al.Silent coronary atheromatosis in type 1 diabetic patients and its relation to long-term glycemic control[J].Diabetes,2002,51(8):2637-2641.
[18]ORCHARD T J,OLSON J C,ERBEY J R,et al.Insulin resistance-related factors,but not glycemia,predict coronary artery disease in type 1 diabetes:10-year follow-up data from the pittsburgh epidemiology of diabetes complications study[J].Diabetes Care,2003,26(5):1374-1379.
[19] HOERGER T J,SEGEL J E,GREGG E W,et al.Is glycemic control improving in U.S.adults?[J].Diabetes Care,2008,31(1):81-86.
[20]FRIEDMAN J M.Leptin at 14 years of age:an ongoing story[J].Am J Clin Nutr,2009,89(3):973-979.
[21]FLIER J S,MARATOS-FLIER E.Lasker lauds leptin [J].Cell,2010,143(1):9-12.

