長期低劑量錳染毒對子代大鼠睪丸生精細胞線粒體狀態和細胞凋亡的影響*
王乾興,褚 慧,于明明,張先平
(1.遵義醫學院細胞生物學教研室,貴州遵義 563003;2.湖南省婁底市中心醫院生殖醫學中心 422907)
男性不育是臨床常見疾病之一。環境污染、不良生活習慣等使男性精液質量顯著下降[1-2],已引起了學界廣泛關注。環境錳暴露是引發男性生殖障礙的一個重要因素。錳通過血睪屏障蓄積于睪丸,引起雄性精液質量降低和生精細胞凋亡[3-4]。但慢性錳染毒對子代雄性的生殖毒理效應尚未見報道。此外,線粒體凋亡途徑引起的凋亡可能是錳毒性的重要原因[5]。線粒體融合/分裂的動態平衡受視神經萎縮蛋白1(optic atrophy 1,Opa1)和動力相關蛋白1(dynamin related protein 1,Drp1)控制,其動態失衡將導致細胞凋亡[6]。錳的雄性生殖毒性是否也通過這對基因起作用亦未見相關報道。本研究探索母代大鼠長期低劑量錳染毒對子代睪丸生精細胞線粒體功能狀態和細胞凋亡的影響,為錳中毒的預防和治療、環境錳暴露的安全限量確定提供實驗依據。
1 材料與方法
1.1材料
1.1.1實驗動物及分組 滿月SPF級雌性SD大鼠(90~120 g)[第三軍醫大學實驗動物中心,SCXK(渝)2012-0005],分為對照組、低、中、高劑量組,每組8只。每天12 h光照,平均環境溫度(21±1)℃,自由進食飲水。實驗獲得遵義醫學院倫理學委員會批準。
1.1.2主要試劑 MnCl2·4H2O(分析純,中國醫藥集團上海化學試劑公司);TUNEL試劑盒(美國Roche公司);RNAiso Plus(日本TaKaRa公司);qPCR反應試劑盒(北京全式金生物技術有限公司);Drp1、半胱氨酸蛋白酶9(Caspase9)兔多抗(美國Proteintech公司);Opa1兔單抗(英國Abcam公司);qPCR擴增引物序列由生工生物工程(上海)股份有限公司合成:Opa1 (CTC GCT ATC ACT GCC AAC AC,CTT CTT CTC GCC GTC TTC AG);Drp1 (AAC AGG CAA CTG GAG AGG AA,GCA ACT GGA ACT GGC ACA T);Caspase9 (CCA CTG CCT CAT CAT CAA CA,TCG TTC TTC ACC TCC ACC AT);GAPDH (GAC ATG CCG CCT GGA GAA AC,AGC CCA GGA TGC CCT TTA GT)。
1.2方法
1.2.1動物模型及取材 雌性SD大鼠飼養1周,注射生理鹽水或2、4、8 mg/kg氯化錳8周,與正常雄性大鼠交配,檢測到陰栓后單獨飼養。雌鼠在妊娠期和哺乳期繼續染毒,總染毒時間14周。給藥途徑為腹腔注射,1次/天,5天/周。每3天測大鼠體質量以調整MnCl2用量。每組8只12周齡子代大鼠斷頭處死后分離雙側睪丸,左側用于qPCR和Western blot實驗;右側用5%戊二醛或4%多聚甲醛固定,用于透射電鏡觀察、蘇木精-伊紅(HE)染色、末端標記法(TUNEL)和免疫組織化學實驗。
1.2.2透射電鏡觀察生精細胞線粒體形態 將睪丸剪成 1 mm3組織塊,5%戊二醛固定、脫水、樹脂包埋,超薄切片、醋酸雙氧鈾染色,透射電鏡觀察。
1.2.3TUNLE法檢測生精細胞凋亡 睪丸冠狀切片常規脫蠟水化。微波修復抗原。0.3%的 H2O2-甲醇封閉10 min。加反應液37 ℃避光溫育1 h,加轉化劑POD 37 ℃反應30 min,二氨基聯苯胺(DAB)顯色,復染、脫水、透明、封片、鏡檢。同時設陰性對照(只加標記反應液)和陽性對照(10 μg/mL 的DNAase Ⅰ預處理)。每張切片選擇10個生精小管,計數凋亡信號陽性的生精細胞數占總生精細胞數的比例,即為凋亡指數(apoptosis index,AI)。
1.2.3qPCR檢測Opa1、Drp1、Caspase9 mRNA表達 RNAiso Plus提取總RNA,經純度鑒定和濃度測定后取2 μg總RNA,兩步法RT反應合成cDNA(42 ℃ 30 min、85 ℃ 5 s、4 ℃ 10 min)。按說明書進行qPCR(20 μL體系:94 ℃ 30 s、94 ℃ 5 s、60 ℃ 30 s,40個循環)。以甘油醛-3-磷酸脫氫酶(GAPDH)為內參,以2-△△CT為目的基因相對表達量。每個標本設置3管重復,取3次的平均值計算mRNA的相對表達量。
1.2.4免疫組織化學檢測Opa1、Drp1和Caspase9蛋白表達 石蠟切片常規脫蠟水化,3% H2O2阻斷,微波修復抗原,山羊血清封閉。滴加一抗Drp1(1∶50)、Caspase9(1∶50)和Opa1(1∶500),4 ℃過夜。二抗37 ℃反應30 min。DAB顯色,復染、脫水、封片,光鏡觀察。以磷酸緩沖鹽溶液(PBS)代替一抗為陰性對照。
1.2.5Western blot檢測Opa1、Drp1和Caspase9蛋白表達 睪丸100 mg加500 μL RIPA 裂解液,同時加5 μL PMSF和蛋白磷酸酶抑制劑,4 ℃勻漿,12 000 r/min離心15 min,小心吸取上清,BCA 法測定蛋白濃度。取40 μg蛋白上樣,10%分離膠120 V電泳,100 mA轉印,5%脫脂奶粉封閉1 h,加入一抗(Opa1為1∶1 000、Drp1為1∶500、Caspase9為1∶1 000、GAPDH為1∶4 000)4 ℃過夜。二抗37 ℃孵育1 h,ECL發光、顯影、定影。將膠片掃描,用Image Pro Plus軟件分析目的條帶光密度值,以目的條帶/GAPDH為目的蛋白相對表達量。
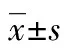
2 結 果
2.1長期低劑量錳染毒對子代大鼠睪丸組織形態學的影響 對照組睪丸曲細精管管腔大小基本一致、各級生精細胞有序排列,管腔內可見大量精子細胞和成熟精子。各錳染毒組睪丸生精小管呈現不同程度的形態學改變。隨著錳染毒劑量的增加,生精細胞層數逐漸減少,生精細胞排列紊亂、數量減少或缺如,管腔內成熟的精子數目明顯減少,見圖1。

A:對照組;B:低劑量組;C:中劑量組;D:高劑量組
圖1子代大鼠睪丸組織形態學的改變(HE ×400)

A:線粒體結構完整,連接成網;B:線粒體分離成單個;C.線粒體腫脹,嵴消失(箭頭所示)
圖2子代大鼠睪丸生精細胞線粒體結構形態的改變(TEM×1400)
2.2長期低劑量錳染毒對子代大鼠生精細胞線粒體形態的影響 對照組生精細胞線粒體結構完整,相互連接成網;低、中劑量組生精細胞線粒體則分離成單個;高劑量組線粒體表現為腫脹、嵴消失,見圖2。
2.3長期低劑量錳染毒對子代大鼠生精細胞Opa1和Drp1 mRNA及蛋白表達的影響 qPCR結果顯示,與對照組比較,低劑量組Opa1 mRNA表達量無明顯變化,但中、高劑量組顯著降低,且隨錳染毒劑量的增加逐漸遞減(P<0.05,P<0.01);Drp1 mRNA表達情況則剛好與Opa1相反,見表1。
免疫組織化學結果顯示,Opa1表達于各級生精細胞和精子細胞細胞質,呈棕黃色。其染色強度隨錳染毒劑量的增加而減弱;Drp1主要表達于各級生精細胞細胞質,呈棕黃色。低劑量組和對照組染色強度無明顯差異,中、高劑量組明顯升高,見圖3。
Western blot結果顯示,與對照組相比,低劑量組Opa1蛋白表達無顯著性差異,而中、高劑量組均顯著降低,且隨錳染毒劑量的增加而降低(P<0.05,P<0.01)。與對照組相比,各錳染毒組Drp1蛋白表達均顯著增加,且隨錳染毒劑量的增加而遞增(P<0.01),見表2。

表1 子代大鼠睪丸組織Opa1、Drp1和Caspase 9 mRNA相對表達量
a:P<0.01,與對照組比較;b:P<0.05,與低劑量組比較;c:P<0.01,與低劑量組比較;d:P<0.05,與中劑量組比較;e:P<0.01,與中劑量組比較

表2 子代大鼠睪丸組織Opa1、Drp1、Caspase 9蛋白相對表達量和
a:P<0.05,與對照組比較;b:P<0.01,與對照組比較;c:P<0.05,與低劑量組比較;d:P<0.01,與低劑量組比較;e:P<0.05,與中劑量組比較;f:P<0.05,與中劑量組比較
2.4長期低劑量錳染毒對子代大鼠生精細胞凋亡和Caspase9表達的影響 TUNEL法原位檢測大鼠生精細胞凋亡結果顯示,各組大鼠均可見生精細胞凋亡,其細胞核呈棕黃色,主要見于精原細胞、精母細胞和精子細胞。各劑量組生精細胞AI均明顯高于對照組(P<0.01),且隨錳染毒劑量的增加而增加(P<0.01)。qPCR結果顯示,與對照組相比,各錳染毒組Caspase 9 mRNA相對表達量均升高,且隨錳染毒劑量的增加逐漸增加(P<0.05)。這一規律在免疫組織化學和Western blot結果中也有相同的體現,見表2、圖3~5。

圖3 子代大鼠生精細胞Opa1、Drp1和Caspase9蛋白表達定位(SP×400)

圖4 子代大鼠睪丸組織內蛋白定量(Western blot)

圖5 子代大鼠生精細胞的凋亡(TUNEL×400)
3 討 論
毒理學實驗所采用的錳染毒途徑有經呼吸道、消化道、循環系統3條[4,7-9]。呼吸道染毒可以較真實地反映錳塵導致的毒性,但操作比較繁瑣;消化道染毒由于動物活動度下降而可能影響到最終錳攝入量。以往采用循環系統染毒的劑量大都在7.5 mg/kg以上,遠大于環境錳暴露水平,對職業防護指導意義有限。因此本實驗采取較低劑量(2、4、8 mg/kg)氯化錳進行腹腔注射,以評價其對子代雄性的生殖毒性。
線粒體的融合/分裂的動態平衡反映了線粒體的功能狀態。研究證實線粒體分裂是細胞凋亡的最早階段,凋亡過程中存在線粒體從管網狀向點狀的轉換[10-11]。本實驗結果顯示,對照組睪丸生精細胞內線粒體結構完整,相互連接成網;錳染毒后則分離成單個甚至表現出腫脹、嵴消失。結合HE染色結果,隨著錳染毒劑量的增加,生精細胞層數逐漸減少,各級生精細胞排列紊亂、數量減少或缺如,管腔內成熟的精子數目明顯減少,提示長期低劑量錳染毒后子代大鼠生精細胞線粒體功能降低,降低其能量供應而影響生精功能。
線粒體的融合/分裂的動態平衡主要受到Opa1/Drp1控制。Opa1是由核基因編碼的動力相關蛋白,主要誘導線粒體膜融合和控制凋亡過程中嵴的重塑。Opa1低表達凋亡敏感性增加,過表達則抑制凋亡[12-13]。Drp1是動力蛋白GTP酶超家族成員,在線粒體分裂中起關鍵作用[14]。Drp1磷酸化可引起細胞色素C的釋放、促凋亡蛋白釋放,激活Caspase9,引起細胞凋亡[15]。本實驗發現,長期低劑量錳染毒后,子代大鼠生精細胞中Opa1 mRNA和蛋白表達量在中、高劑量組顯著降低,且隨錳染毒劑量的增加逐漸遞減;Drp1的表達趨勢則與之相反。例外的是低劑量組Drp1的Western blot結果也高于對照組,可能和樣本量較小有關。所以,當錳染毒劑量達4 mg/kg以上時,Opa1表達下降同時Drp1表達上升,提示子代大鼠睪丸生精細胞線粒體趨向分裂,導致生精細胞能量供應不足,誘導其凋亡,這與大鼠腦膠質瘤細胞的研究結果相似[16-17]。
錳誘導的細胞凋亡主要是通過線粒體途徑進行,即通過降低Opa1、增加Drp1的表達,引起線粒體膜電位的改變、細胞色素C的釋放,細胞色素C與凋亡酶激活因子(Apaf1) 結合,募集并激活 Caspase9,啟動Caspase級聯反應,引起細胞凋亡[16-19]。本研究結果顯示,Caspase 9 mRNA和蛋白在各錳染毒組均升高,且隨錳染毒劑量的增加逐漸增加,且生精細胞 AI 也隨錳染毒劑量的增加而上升。提示長期低劑量錳染毒可誘導子代大鼠睪丸生精細胞Caspase級聯信號被啟動,引起生精細胞的細胞凋亡。
綜上所述,長期低劑量錳染毒可抑制Opa1和促進Drp1表達,使線粒體融合/分裂失衡,啟動Caspase9信號,最終導致子代大鼠生精細胞凋亡。
[1]HUANG C,LI B S,XU K R,et al.Decline in semen quality among 30 636 young Chinese men from 2001 to 2015[J].Fertil Steril,2017,107(1):83-88.
[2]BORGES E,SETTI A S,BRAGA D P,et al.Decline in semen quality among infertile men in Brazil during the past 10 years[J].Int Braz J Urol,2015,41(4):757-763.
[3]WANG Y X,SUN Y,HUANG Z,et al.Associations of urinary metal levels with serum hormones,spermatozoa apoptosis and sperm DNA damage in a Chinese population[J].Environ Int,2016,94:177-188.
[4]王乾興,金華,張先平.谷胱甘肽拮抗錳致雄性大鼠生殖損傷的研究[J].中國計劃生育學雜志,2011,19(9):537-539,549.
[5]ROTH J A,GARRICK M D.Iron interactions and other biological reactions mediating the physiological and toxic actions of Manganese[J].Biochem Pharmacol,2003,66(1):1-13.
[6]KALIA K,ZHENG W,JIANG W.Importance of mitochondria in manganese-induced cellular toxicity[J].Neurotoxicology,2009,30(4):727-727.
[7]SAPUTRA D,CHANG J,LEE B J,et al.Short-term Manganese inhalation decreases brain dopamine transporter levels without disrupting motor skills in rats[J].J Toxicol Sci,2016,41(3):391-402.
[8]WANG L,SHIRAKI A,ITAHASHI M,et al.Aberration in epigenetic gene regulation in hippocampal neurogenesis by developmental exposure tomanganese chloride in mice[J].Toxicol Sci,2013,136(1):154-165.
[9]SANTOS D,DINAMENE S,BATORéU M C,et al.Evaluation of neurobehavioral and neuroinflammatory end-points in the post-exposure period in rats sub-acutely exposed to Manganese[J].Toxicology,2013,314(1):95-99.
[10]WU S N,ZHOU F F,ZHANG Z Z,et al.Mitochondrial oxidative stress causes mitochondrial fragmentation via differential modulation of mitochondrial fission-fusion proteins[J].FEBS J,2011,278(6):941-954.
[11]PATTEN D A,WONG J,KHACHO M,et al.Opa1-dependent cristae modulation is essential for cellular adaptation to metabolic demand[J].EMBO J,2014,33(22):2676-2691.
[12]RENAULT T T,FLOROS K V,ELKHOLI R,et al.Mitochondrial shape governs BAX-induced membrane permeabilization and apoptosis[J].Mol Cell,2015,57(1):69-82.
[13]KUSHNAREVA Y,SEONG Y,ANDREYEV A Y,et al.Mitochondrial dysfunction in an Opa1(Q285STOP)mouse model of dominant optic atrophy results from Opa1 haploinsufficiency[J].Cell Death Dis,2016,7(7):e2309.
[14]MACDONALD P J,STEPANYANTS N,MEHROTRA N,et al.A dimeric equilibrium intermediate nucleates Drp1 reassembly on mitochondrial membranes for fission[J].Mol Biol Cell,2014,25(12):1905-1915.
[15]WANG P,WANG P G,LIU B,et al.Dynamin-related protein Drp1 is required for Bax translocation to mitochondria in response to irradiation-induced apoptosis[J].Oncotarget,2015,6(26):22598-22612.
[16]ALAIMO A,GOROJOD R M,BEAUQUIS J,et al.Deregulation of mitochondria-shaping proteins Opa-1 and Drp-1 in manganese-induced apoptosis[J].PLoS One,2014,9(3):e91848.
[17]ALAIMO A,GOROJOD R M,MIGLIETTA E A,et al.Manganese induces mitochondrial dynamics impairment and apoptotic cell death:a study in human Gli36 cells[J].Neurosci Lett,2013,554(1):76-81.
[18]ZHANG L,SANG H,LIU Y,et al.Manganese activates caspase-9-dependent apoptosis in human bronchial epithelial cells[J].Hum Exp Toxicol,2013,32(11):1155-1163.
[19]WANG Y H,YANG X L,HAN X,et al.Mimic of Manganese superoxide dismutase to induce apoptosis of human non-Hodgkin lymphoma Raji cells through mitochondrial pathways[J].Int Immunopharmacol,2012,14(4):620-628.

