Mg2+依賴性蛋白磷酸酶1δ的生物信息學分析
劉 暢,劉 安
(1.長治醫學院 中心實驗室,山西 長治 046000;2.長治醫學院附屬和濟醫院 醫務科,山西 長治 046000)
肝癌(Hepatocellular carcinoma,HCC)是世界第3大致死癌癥,也是中國乃至亞洲最廣泛的一種癌癥。目前對于肝癌細胞癌變機制的研究尚無系統工作。臨床上通常采用肝移植、手術切除、肝動脈化療栓塞等方法治療肝癌,但術后復發率和轉移率偏高。有研究人員[1]發現,PPM1D的mRNA表達水平與肝癌患者的腫瘤體積、腫瘤分級和總體生存時間密切相關。
Mg2+依賴性蛋白磷酸酶1δ(PPM1D),亦被稱為野生型p53誘導的蛋白磷酸酶1(Wip1,wild-type p53-induced phosphatase 1)。在乳腺腫瘤、卵巢透明細胞癌、胰腺癌、神經母細胞瘤和髓母細胞瘤等固體腫瘤中,發現PPM1D常過量表達,且與癌癥患者生存狀況不佳呈正相關[2]。研究人員[1,3]發現,對于中分化或低分化肝癌患者,腫瘤抑制基因p53通常發生突變或表達受到抑制。PPM1D能夠抑制p53信號途徑和p38 MAPK信號通路,推測其為致癌基因[4-5]。但PPM1D的致癌機制和預后價值仍未完全闡明,針對該分子的基因治療手段也尚未見報道。
越來越多的證據表明,在多種固體腫瘤中,PPM1D是一個潛在的腫瘤相關分子,也是一個有價值的預后標志物。PPM1D在接近59 %的肝癌患者體內過量表達,且高表達PPM1D的患者特點是:AFP水平偏高、腫瘤體積偏大、TNM分期偏高、腫瘤復發率偏高、存在肝癌家族史,總體存活時間偏短[1]。文獻[2]使用siRNA下調PPM1D表達,發現能夠抑制腫瘤異種移植小鼠模型體內肝癌細胞的增殖和遷移能力,降低其致瘤性。因此,PPM1D作為肝癌的一個潛在預后標志物和治療靶點,它的功能及其參與的信號通路值得深入研究。本文使用生物信息學分析方法,研究PPM1D蛋白的理化性質、結構與功能,可為進一步研究PPM1D的作用機制及其作為肝癌治療靶點提供依據。
1 材料與方法
1.1 材 料
以“PPM1D+物種名”為關鍵詞,在美國國立生物技術信息中心(National Center for Biotechnology Information,NCBI)的GenBank數據庫(https://www.ncbi.nlm.nih.gov/),搜索獲得人PPM1D基因轉錄本序列和PPM1D蛋白的氨基酸序列信息。
1.2 方 法
使用Clustal2.1(http://www.clustal.org/download/current/)進行PPM1D同源蛋白間的多重序列比對。使用MEGA6軟件,Neighbor-joining方法,Boot-strap分析重復數設置為1 000,構建系統進化樹,并計算進化距離[6]。使用NCBI的UniGene數據庫中EST結果分析PPM1D的組織表達特異性,PSORTII(https://psort.hgc.jp/)進行亞細胞定位預測。使用ExPASy數據庫中的ProtParam在線工具(http://web.expasy.org/protparam/)對PPM1D進行理化性質分析。使用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)和TMHMM 2.0工具(http://www.cbs.dtu.dk/services/TMHMM/)預測PPM1D的信號肽和跨膜區域。使用NetPhosK3.1(http://www.cbs.dtu.dk/services/NetPhos/)和PhosphoSitePlus工具(http://www.phosphosite.org/homeAction.action)分析PPM1D的翻譯后修飾情況。使用SOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)分析PPM1D的二級結構,NCBI的Conserved Domain數據庫分析結構域,SWISS-MODEL 建模服務器(https://swissmodel.expasy.org/)預測三維結構。使用STRING數據庫(http://string-db.org/),構建與PPM1D相互作用的蛋白網絡。
2 結果與分析
2.1 PPM1D蛋白多序列比對和進化關系分析
在NCBI數據庫中搜索到人PPM1D蛋白在哺乳動物、兩棲類和魚類中的同源序列。人PPM1D蛋白的氨基酸序列與黑猩猩、獼猴、野豬、小鼠、大鼠、雞、非洲爪蟾、黃鱔和斑馬魚的相似性分別為99.34 %、98.51 %、94.05 %、89.13 %、78.45 %、73.38 %、61.02 %、54.75 %和50.94 %。圖1表明,人PPM1D蛋白與其他幾種哺乳動物序列相似性較大,組成一支,而與兩棲類和魚類幾種動物的序列相似性較小。人與黑猩猩的同源性最高,進化距離為0.004,與野豬、小鼠和雞的同源蛋白進化距離分別為0.027、0.044、0.111,進化距離最遠的是斑馬魚和黃鱔,分別為0.323、0.305。由此推測,PPM1D蛋白的同源性與物種間親緣關系呈正相關,親緣關系越近,蛋白的同源性越高,提示該蛋白在物種進化過程中扮演一定角色。
2.2 PPM1D的組織表達特異性、亞細胞定位、信號肽與跨膜結構域分析
根據NCBI的UniGene數據庫中EST結果顯示,PPM1D在以下正常組織均有表達,拷貝數分別是:腦34、睪丸26、肺10、腎8、腸8、子宮8、胰腺5、肝1。由此推測,PPM1D的組織表達特異性不強,在多數組織中均有表達。PSORTII預測,PPM1D定位于細胞核的可能性最大(60.9 %),其次可能定位于細胞質(13.0 %)、質膜(8.7 %)、細胞骨架(8.7 %)、分泌系統囊泡(4.3 %)和高爾基體(4.3 %)。由此推測,PPM1D主要在細胞核中發揮生理功能,而在其他亞細胞結構中也可能動態存在。
SignalP 4.0預測PPM1D蛋白不含切割位點,無信號肽序列如圖2所示,說明該蛋白不是分泌蛋白。TMHMM 2.0預測PPM1D無跨膜結構域如圖3所示。圖3中,紅色細線、藍色細線和粉色細線分別表示跨膜區域、膜內部分和膜外部分。圖中PPM1D蛋白位于膜外的概率幾乎為100 %,跨膜區域和位于膜內的概率幾乎為0。藍色細線與縱坐標為0的基線重疊。粉色粗線用來標識多肽鏈中跨膜區域所在位置,因PPM1D蛋白沒有跨膜區域,所以在粗線上沒有相應標記。
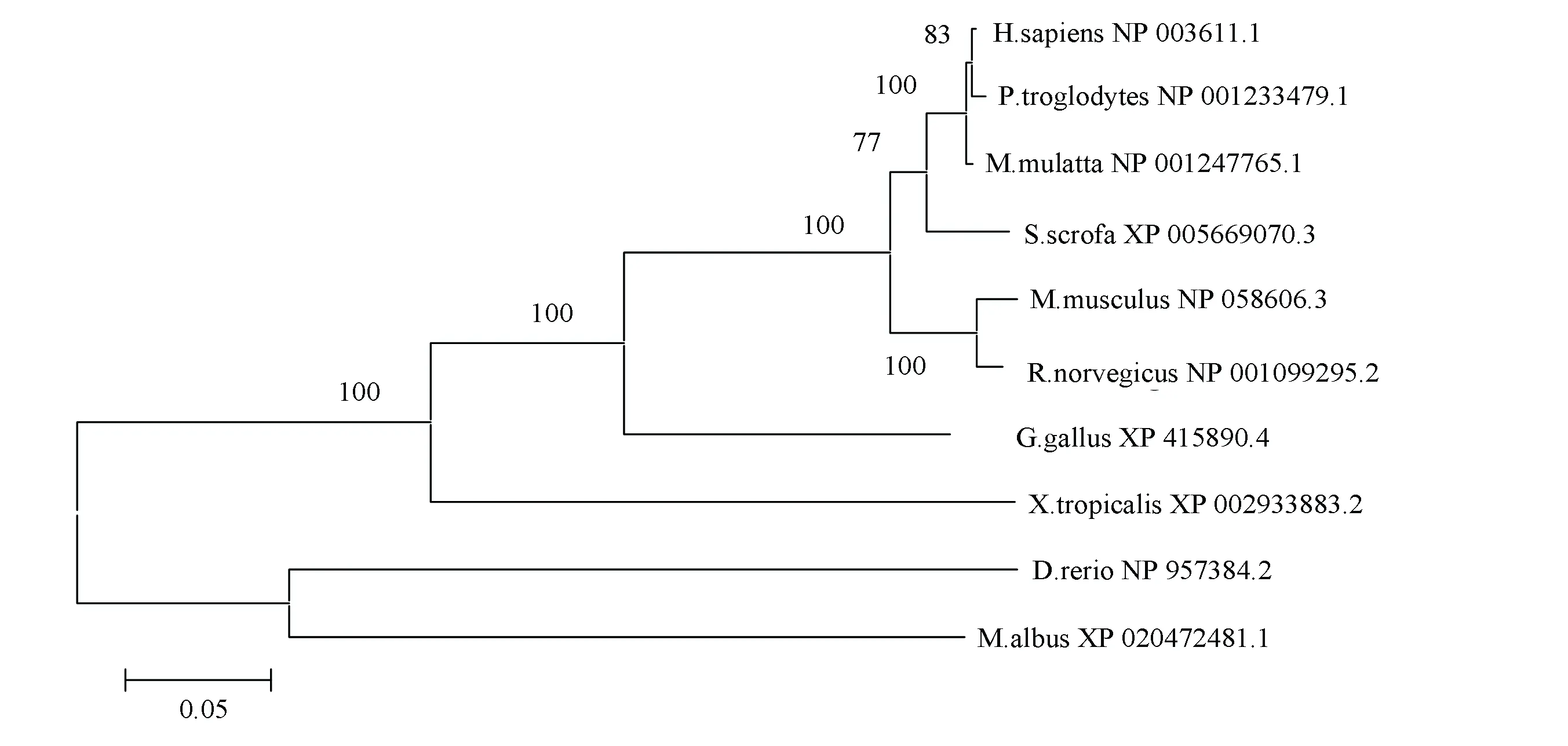
圖1 人PPM1D蛋白與其同源序列比對的系統進化樹Fig.1 The sequence alignment of human PPM1D protein and its homologous sequences
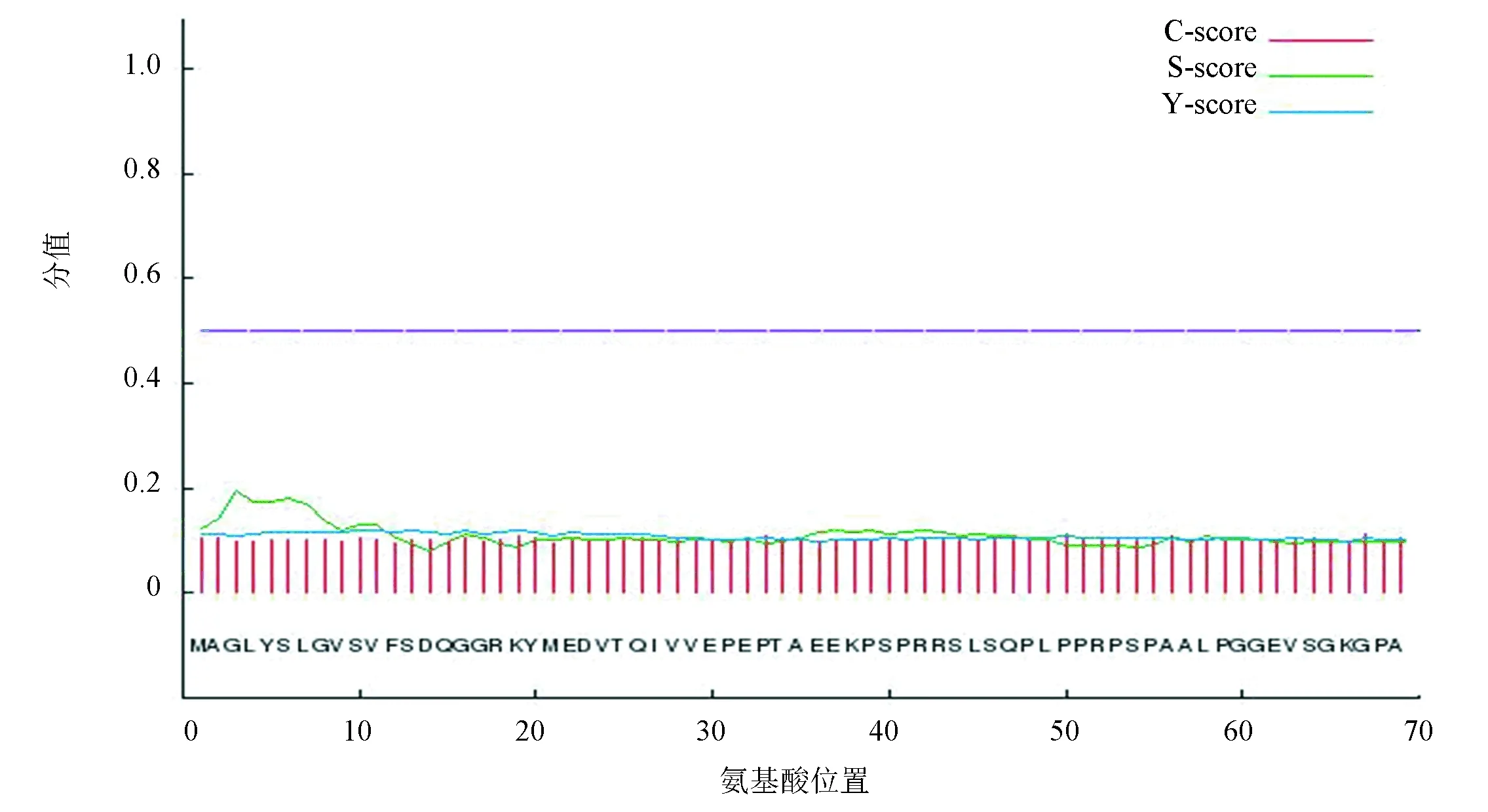
圖2 PPM1D蛋白的信號肽分析結果Fig.2 The analysis result of PPM1D signal peptide
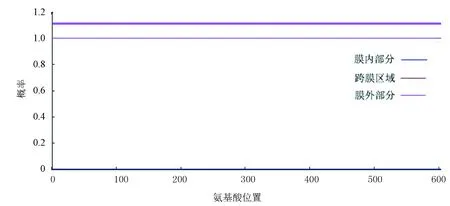
圖3 PPM1D蛋白跨膜結構分析Fig.3 Trans-membrane domain analysis of PPM1D
2.3 PPM1D蛋白質的理化性質
人PPM1D基因(NM003620.3)位于17號染色體上(17q23.2),編碼產物NP_003611.1為該基因的蛋白質共識編碼序列。PPM1D蛋白含有605個氨基酸,分子式為C2905H4669N857O880S31,分子量為66 675.1 Da,理論等電點預測為9.14,屬于堿性蛋白質。在哺乳動物網織紅細胞內半衰期為30 h,不穩定系數為56.41,屬于不穩定蛋白質。脂肪系數為72.99,總的平均親水性為-0.517。ExPASy數據庫中的ProtScale在線工具預測,PPM1D親水性最強的位點是第585位的精氨酸,分值為-2.878;疏水性最強的位點是第372位的纈氨酸,分值為2.189。由圖4可知,PPM1D蛋白的親水區域多于疏水區域,屬于親水蛋白質。
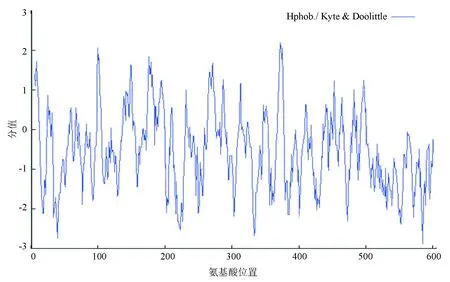
圖4 ProtScale分析PPM1D蛋白的親疏水性Fig.4 Hydrophobicity profile of the PPM1D protein analyzed by ProtScale
2.4 PPM1D蛋白質二級結構、三維結構預測及翻譯后修飾分析
由圖5知,在PPM1D蛋白質的二級結構中,隨機卷曲(圖中橘色)占47.6 %,α-螺旋(圖中藍色)占23.8 %,延伸鏈(圖中紅色)占21.16 %,β-轉角(圖中綠色)占7.44 %。NCBI的Conserved Domain數據庫預測PPM1D蛋白屬于蛋白磷酸酶2C(Protein phosphatase 2C, PP2C)超家族的一員(如圖6所示),PP2C是一類絲氨酸/蘇氨酸蛋白磷酸酶。PPM1D含有一個PP2Cc(Complementary DNA encoding the isoform of protein phosphatase 2C)結構域,PP2Cc是約42 kDa的單體酶,含有約390個氨基酸,與PP2C1異構體相似性達76%,其底物特異性不強,活性依賴于二價陽離子(主要是錳和鎂),確切的生理作用尚不清楚[7]。使用SWISS-MODEL 建模服務器預測PPM1D蛋白三維結構(如圖7所示),序列與模板相似度為30.09 %,三維結構預測表明其符合PP2C結構域模型特點。
使用NetPhosK 3.1和PhosphoSitePlus分析PPM1D翻譯后修飾情況,發現絲氨酸、蘇氨酸和酪氨酸位點能夠被磷酸化。根據PPM1D能夠使其互作蛋白發生去磷酸化,探索其磷酸化程度及動態變化能夠加深對該蛋白功能的理解。此外,賴氨酸會發生乙酰化、甲基化和泛素化修飾,針對該蛋白如何發生泛素化及降解,可以進一步探索。
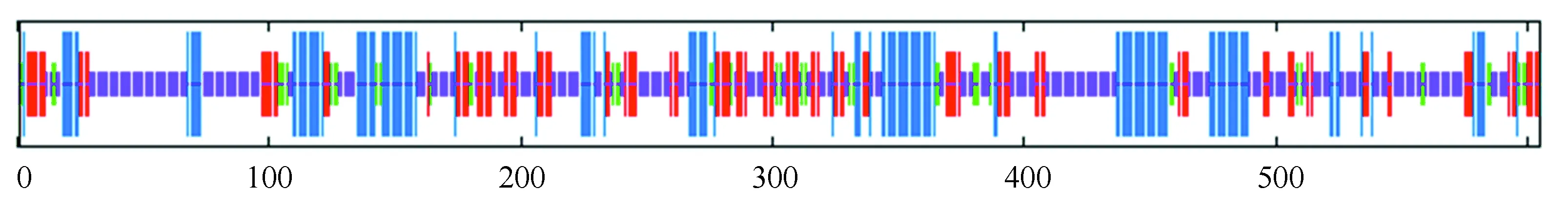
圖5 SOPMA預測PPM1D蛋白二級結構Fig.5 Predicted secondary structure of PPM1D protein by SOPMA
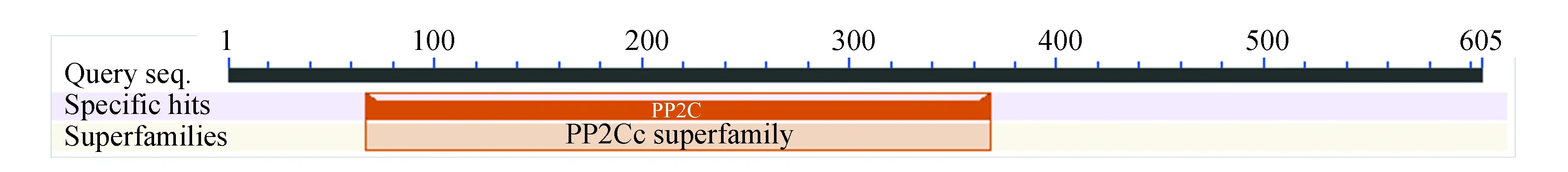
圖6 PPM1D蛋白保守結構域Fig.6 Conserved domain of PPM1D protein
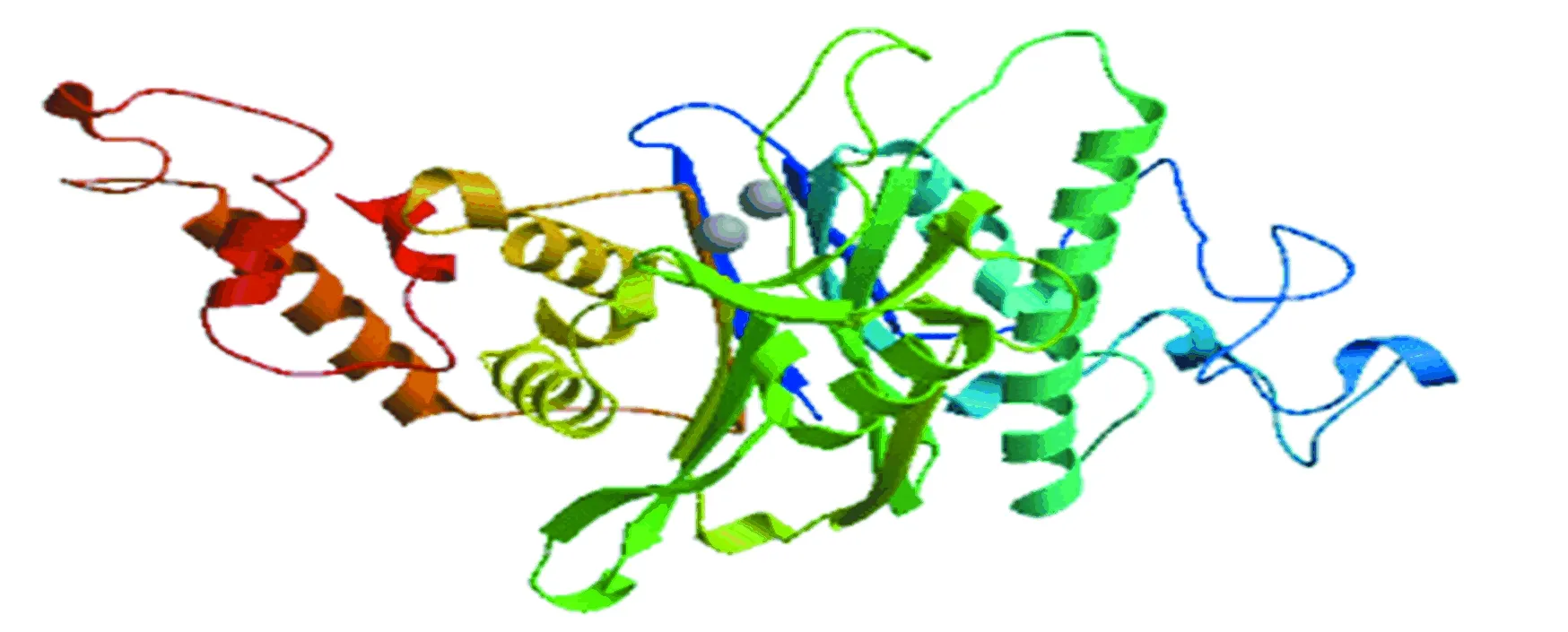
圖7 PPM1D三維結構預測Fig.7 Three dimensional structure prediction of PPM1D
2.5 PPM1D蛋白質相互作用分析
利用STRING數據庫搜索與PPM1D相互作用的蛋白質信息,設置為高置信度0.7,數量限制在10個以內,構建PPM1D蛋白相互作用網絡如圖8所示。與PPM1D相互作用的蛋白主要有TP53、ATM(ataxia telangiectasia mutated)、MDM2(murine double minute 2)、CHEK1(checkpoint kinase 1)、CHEK2(checkpoint kinase 1)、RIPK4(receptor interacting protein kinase 4)和APPBP2(Amyloid beta precursor protein (cytoplasmic tail) binding protein 2)。值得關注的是,互作蛋白中包括MDM2、RIPK4和APPBP2。
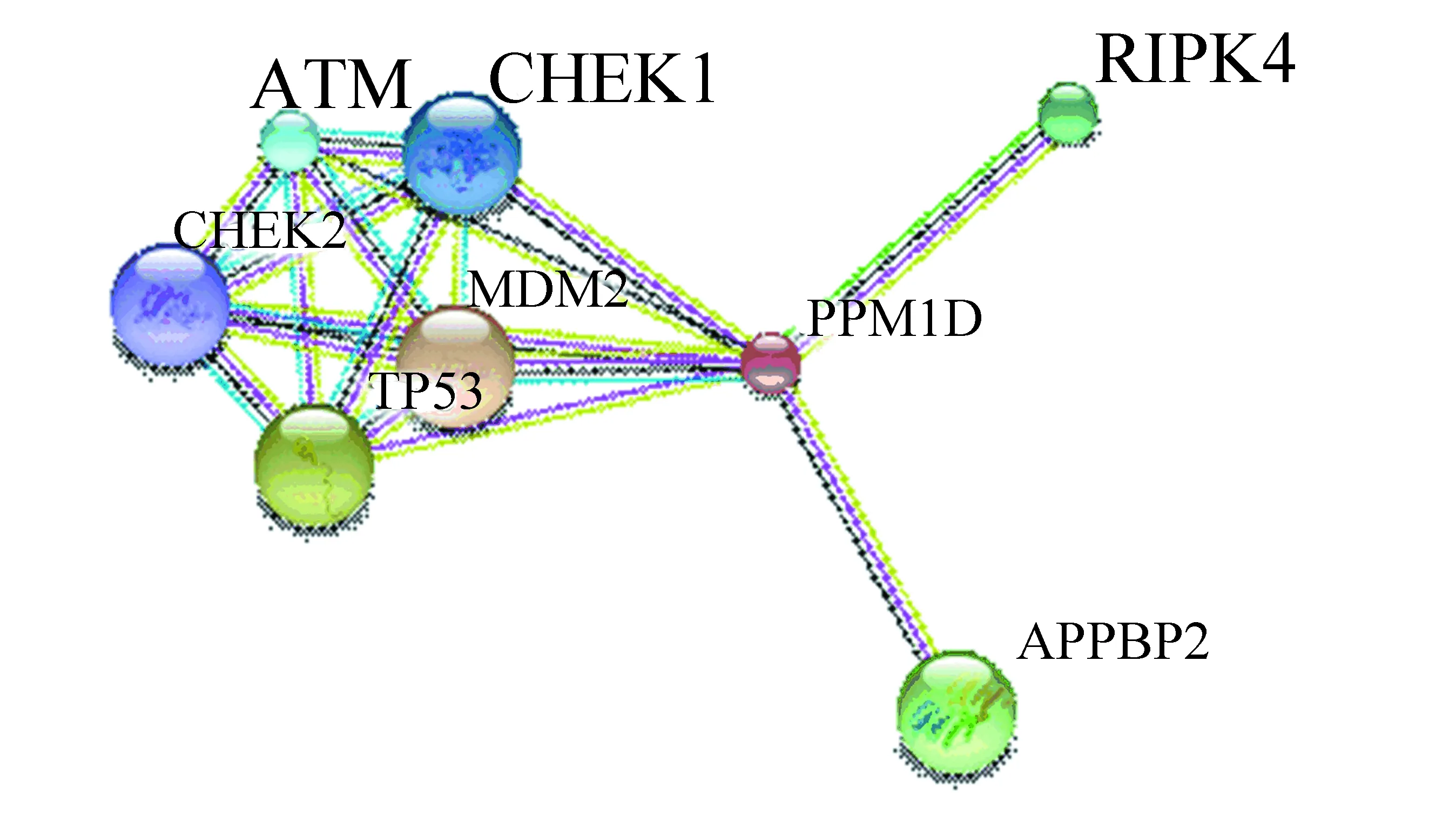
圖8 STRING預測PPM1D蛋白相互作用網絡Fig.8 Protein-protein interaction network for PPM1D predicted by STRING
3 討 論
對于腫瘤患者,腫瘤抑制基因p53通常發生突變或表達受到抑制,研究者曾一度嘗試通過逆轉p53的腫瘤抑制活性進行癌癥治療。PPM1D能夠由p53激活表達,其產物作為一種絲氨酸/蘇氨酸磷酸酶,是細胞生長和應激反應的重要調控分子,能夠使關鍵的細胞周期檢查點蛋白和細胞損傷修復相關蛋白(如:p53、ATM、p38MAPK等)去磷酸化,從而抑制相關蛋白表達,在腫瘤發生發展過程中發揮作用。PPM1D能夠以p53依賴的方式,在電離輻射和紫外線等脅迫環境下表達[8]。通過使p38 MAPK第180位蘇氨酸殘基去磷酸化,PPM1D能夠調節p38 MAPK信號通路,抑制p38 MAPK的激酶活性和p53的腫瘤抑制活性[9-10]。另外,PPM1D能夠抑制p16INK4A和p19ARF等腫瘤抑制因子的活性[5],也能夠與RAS、MYC和ERBB2等致癌基因協同作用[11-12]。由此可知,PPM1D能夠負反饋調節p53,PPM1D受p53激活后,其產物又能使p53去磷酸化,發揮拮抗作用[9]。在腫瘤組織中,PPM1D通常過量表達。但是,若PPMD1的3’端編碼區發生截短突變,其負調控活性會受到影響[13-14]。
本文通過STRING預測知PPM1D與MDM2存在相互作用。除PPM1D以外,MDM2也能由p53激活表達,作為一種負調控因子的MDM2是一種E3泛素連接酶,能夠導致p53泛素化,蛋白酶體發生降解[15-16]。在多種惡性腫瘤中都發現MDM2過量表達。Sriraman等[17]認為MDM2和PPM1D擁有不同的拮抗機制,單獨靶向其一都不足以完全激活p53。研究發現,同時使用這兩種分子各自的靶向藥物(Nutlin-3a和GSK2830371)處理腫瘤細胞,能夠顯著增強p53活性,抑制或阻滯腫瘤進程。目前,聯合用藥已成為腫瘤藥物治療的研究熱點。若兩種或藥物協同作用,使用聯合治療法能夠增強療效,降低每種藥物的副作用。針對PPM1D與MDM2聯合用藥的顯著療效,有望為下一步開發聯合用藥策略提供思路。
STRING預測知APPBP2能夠與PPM1D相互作用。Hirasawa等[18]發現APPBP2和PPM1D在卵巢透明細胞癌中都過量表達,可作為潛在靶點和預后標志物。因此,PPM1D與相互作用蛋白之間的關系及參與的具體生理生化過程具有一定的研究價值,有助于闡明PPM1D的作用機制和生理功能。
4 結 論
1)PPM1D的理論分子量為66.6751 kDa,理論等電點為9.14,預測為堿性蛋白質。不穩定系數為56.41,預測為不穩定蛋白質。脂肪系數為72.99,總平均親水性為-0.517,預測為親水蛋白質。
2)PPM1D的二級結構主要為隨機卷曲,屬于PP2C超家族,含有一個PP2Cc結構域。無信號肽和跨膜結構域,含有磷酸化、乙酰化、甲基化和泛素化修飾位點。該蛋白表達的組織特異性不強,定位于細胞核的可能性較大。系統進化樹顯示,人PPM1D蛋白與哺乳動物(如:黑猩猩、獼猴)序列相似性較大,組成一支,而與兩棲類和魚類(如:非洲爪蟾、斑馬魚)的序列相似性較小,該蛋白的同源性與物種間親緣關系呈正相關。與PPM1D相互作用的蛋白主要是細胞周期檢查點蛋白(如:CHEK1、CHEK2)和細胞損傷修復相關蛋白(如:p53、ATM、p38MAPK)。
3)本文通過生物信息學方法,構建PPM1D的系統進化樹,分析PPM1D蛋白的理化性質、組織特異性、亞細胞定位、結構域及相互作用蛋白質,為全面認識PPM1D,研究其功能及參與的具體信號通路提供一定的參考。
References)
[1]LI Guangbing, ZHANG Xueli, YUAN Li, et al. Protein phosphatase magnesium-dependent 1d (PPM1D) mRNA expression is a prognosis marker for hepatocellular carcinoma[J]. PLoS One, 2013, 8(3): e60775. DOI: 10.1371/journal.pone.0060775.
[2]XU Zhi, CAO Chunxiang, XIA Haiyan, et al. Protein phosphatase magnesium-dependent 1δis a novel tumor marker and target in hepatocellular carcinoma[J]. Frontiers of Medicine, 2016, 10(1): 52-60. DOI:10.1007/s11684-016-0433-3.
[3]BIEGING K T, MELLO S S, ATTARDI L D. Unravelling mechanisms of p53-mediated tumor suppression[J]. Nature Reviews Cancer, 2014, 14(5): 359-370. DOI: 10.1038/nrc3711.
[4]KOOM W S, PARK S Y, KIM W, et al. Combination of radiotherapy and adenovirus-mediated p53 gene therapy for MDM2-overexpressing hepatocellular carcinoma[J].Journal of Radiation Research, 2012, 53(2): 202-210.DOI: 10.1269/jrr.11110.
[5]BULAVIN D V, PHILLIPS C, NANNENGA B, et al. Inactivation of the Wip1 phosphatase inhibits mammary tumorigenesis through p38 MAPK-mediated activation of the p16(Ink4a)-p19(Arf) pathway[J]. Nature Genetics, 2004, 36(4): 343-350. DOI: 10.1038/ng1317.
[6]TAMURA K, DUDLEY J, NEI M, et al. MEGA4: molecular evolutionary genetics analysis(MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI: 10.1093/molbev/msm092.
[7]WENK J, TROMPETER H I, PETTRICH K G, et al. Molecular cloning and primary structure of a protein phosphatase 2C isoform[J]. FEBS Letters, 1992, 297(1/2): 135-138. DOI: 10.1016/0014-5793(92)80344-G.
[8]FUKAMI S, RIEMENSCHNEIDER M J, KOHNO M, et al. Expression and gene doses changes of the p53-regulator PPM1D in meningiomas: a role in meningioma progression?[J]. Brain Tumor Pathology, 2016, 33(3):191-199. DOI: 10.1007/s10014-016-0252-x.
[9]TAKEKAWA M, ADACHI M, NAKAHATA A, et al. p53-inducible wip1 phosphatase mediates a negative feedback regulation of p38 MAPK-p53 signaling in response to UV radiation[J].EMBO Journal, 2000, 19(23): 6517-6526. DOI: 10.1093/emboj/19.23.6517.
[10]BULAVIN D V, DEMIDOV O N, SAITO S, et al. Amplication of PPM1D in human tumors abrogates p53 tumor-suppressor activity[J]. Nature Genetics, 2002, 31(2): 210-215. DOI: 10.1038/ng894.
[11]DUDGEON C, SHREERAM S, TANOUE K, et al. Genetic variants and mutations of PPM1D control the response to DNA damage[J]. Cell Cycle, 2013, 12(16):2656-2664. DOI: 10.4161/cc.25694.
[12]MA Dan, ZHANG Chaojun, CHEN Zulin, et al. Prognostic value of PPM1D in 800 gastric cancer patients[J]. Molecular Medicine Reports, 2014, 10(1):191-194. DOI: 10.3892/mmr.2014.2165.
[13]KLEIBLOVA P, SHALTIEL I A, BENADA J, et al. Gain-of-function mutations of PPM1D/Wip1 impair the p53-dependent G1 checkpoint[J]. The Journal of Cell Biology, 2013, 201(4): 511-521. DOI: 10.1083/jcb.201210031.
[14]RUARK E, SNAPE K, HUMBURG P, et al. Mosaic PPM1D mutations are associated with predisposition to breast and ovarian cancer[J]. Nature, 2013, 493(7432): 406-410. DOI: 10.1038/nature11725.
[15]WADE M, LI Yaocheng, WAHL G M. MDM2, MDMX and p53 in oncogenesis and cancer therapy[J]. Nature Reviews Cancer, 2013, 13(2): 83-96. DOI: 10.1038/nrc3430.
[16]KHOO K H, VERMA C S, LANE D P. Drugging the p53 pathway: understanding the route to clinical efficacy[J]. Nature Reviews Drug Discovery, 2014, 13(3): 217-236. DOI: 10.1038/nrd4236.
[17]SRIRAMAN A, RADOVANOVIC M, WIENKEN M, et al. Cooperation of Nutlin-3a and a Wip1 inhibitor to induce p53 activity[J]. Oncotarget, 2016, 7(22): 31623-31638. DOI: 10.18632/oncotarget.9302.
[18]HIRASAWA A, SAITO-OHAR F, INOUE J, et al. Association of 17q21-q24 gain in ovarian clear cell adenocarcinomas with poor prognosis and identification of PPM1D and APPBP2 as likely amplification targets[J]. Clinical Cancer Research, 2003, 9(6): 1995-2004.

