抗矮縮病小麥產量及其關鍵性狀遺傳模型分析
范紹強,武銀玉,王全亮,王紅梅,曹亞萍
(1.山西省農業科學院小麥研究所,山西 臨汾 041000;2.襄汾縣農業委員會,山西 襄汾 041500;3.洪洞縣農村經營管理中心,山西洪洞041600)
小麥矮縮病是一種由小麥矮縮病毒(Wheat dwarf virus,WDV)引起、由介體異沙葉蟬(Psammotettix alienus L.)以持久非增殖方式傳播的病毒病[1],癥狀表現為嚴重矮縮、黃化、條斑和分蘗增多等,對小麥生產造成嚴重威脅,重病地塊甚至絕收。該病害于1961年被發現[2],隨后逐漸蔓延到歐洲、亞洲、非洲和大洋洲,成為小麥重要病毒病害之一[3-4],并造成嚴重經濟損失[5-6],我國在山西、陜西、河北等地采集的樣本中檢測到該病毒[7-8]。目前,國內外學者對該病毒的研究主要集中在病毒的傳播機制以及病毒與傳毒介體昆蟲蛋白的互作機制[9-13],沒有從小麥抗WDV遺傳資源方面進行過研究。
小麥種質資源豐富,不同種質抗耐矮縮病性存在差異,而抗病種質資源是培育抗病品種的重要材料基礎。為了從根本上降低WDV對小麥生產的為害,本研究對國外引進的一些抗矮縮病資源材料的產量及其關鍵性狀進行了遺傳參數估算和聯合尺度檢驗[14-15],旨在認知其遺傳規律、明確遺傳模型、確定各性狀的最佳選擇時機,為小麥抗矮縮病育種提供理論和科學依據。
1 材料和方法
1.1 試驗材料
抗矮縮病材料2個,由中國農業科學院植物保護研究所提供,其中,Mv-Vekni為高抗矮縮病,引自匈牙利;Bohemia為中抗矮縮病,引自捷克。
高產品種3個,分別為濟麥22、煙農19、臨K6190(自育高代品系),由山西省農業科學院小麥研究所提供。
1.2 試驗設計
試驗于2015—2017年在山西省農業科學院小麥研究所進行。2015年以2個抗矮縮病材料為母本(PF),分別與 3 個高產品種(父本,PM)雜交,配制6個雜交組合,收獲F1;2016年度種植親本及F1,重復配制雜交組合,并以F1植株為母本進行回交;2017年度種植各組合的2個親本世代PF(母本)和PM(父本)各2行、2個回交世代BCF(與母本回交)和BCM(與父本回交)各2行、雜交世代F12行、F220行,田間順序排列,行長4 m,行距0.21 m,基本苗225萬/hm2,試驗四周設保護行。
1.3 數據分析
2017年收獲時在各組合各世代中間順序取樣,取樣數列于表1,調查每個單株的成穗數、總質量和總粒數,取其平均值,計算出公頃穗數、公頃產量和穗粒數,稱量千粒質量,作為遺傳分析的原始數據。運用Excel 2003進行數據統計和整理,根據聯合尺度檢驗程序(JOINT·BAS)[14]分析各性狀值的遺傳效應參數并進行遺傳模型檢驗[15]。
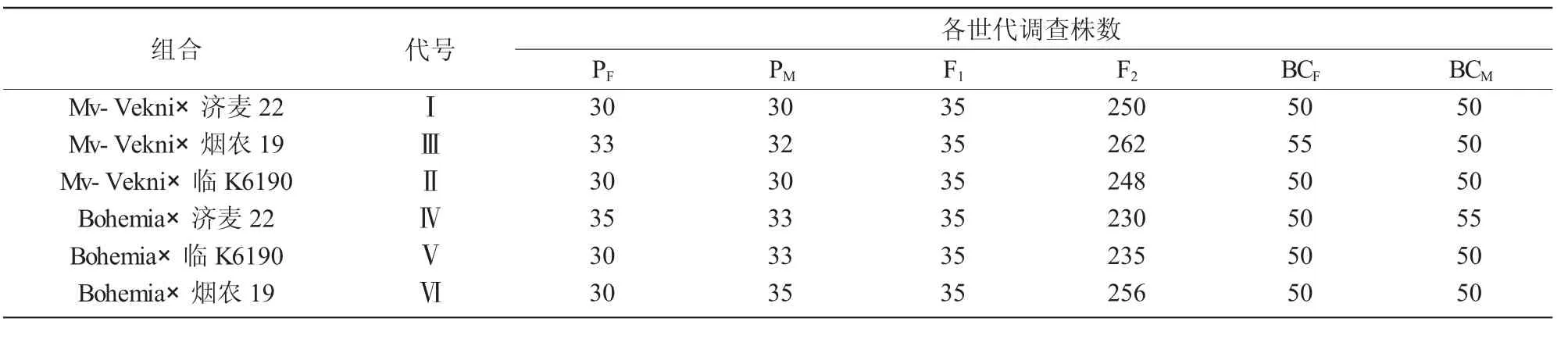
表1 參試材料情況
遺傳模型x2檢驗公式如下。

其中,O為實測世代均值,E為期望世代均值,Wi為世代加權值,自由度v=3。
2 結果與分析
2.1 產量性狀遺傳模型分析
利用聯合尺度檢驗對產量性狀作加性-顯性遺傳模型分析(表2),從各世代平均數(O)、期望值(E)、總x2及x2的概率P(自由度v=3)等統計值可以看出,該性狀對加性-顯性模型的符合程度在70%左右,只有組合Ⅲ不符合加性-顯性遺傳模型(P值25%~50%),組合Ⅴ的符合程度也較低(50%~75%)。平均數與期望值相差較大的世代主要表現在回交世代,如組合Ⅲ和組合Ⅳ的BCF世代、組合Ⅴ和組合Ⅵ的BCM世代,說明回交親本控制產量性狀的基因導致上位性效應加強。回交世代檢驗結果進一步說明,抗矮縮病材料與高產品種產量性狀基因作用結果不同,用抗矮縮病材料回交,其產量結果與預期值一致或高于預期標準,如組合Ⅲ和組合Ⅳ的BCF世代產量實測值分別較預期值高3.00和2.91;而用高產品種回交其產量結果在預期值附近上下波動,如組合Ⅴ和組合Ⅵ的BCM世代產量實測值分別較預期值低2.37和2.12,組合Ⅲ則較預期值高1.87。

表2 產量性狀的聯合尺度檢驗
2.2 產量性狀基因效應分析
為了對控制產量性狀的基因作用進行更深入了解,需測定各遺傳效應值。利用Gamble模式分析6個組合產量的遺傳效應,從表3可以看出,在不同組合中,除加性×顯性上位效應外,其余遺傳參數均達顯著或極顯著水平;6個組合產量性狀的顯性效應都大于加性效應,尤其是組合Ⅳ的顯性效應極大,為加性效應的13.6倍,因而,該性狀的個體選擇不宜在早期世代進行,可根據其遺傳力大小適當推遲至較高世代;3類上位性基因效應中,aa與dd較為重要,而ad效應相對次要,說明產量性狀加性、顯性互作較小,不足以影響其他互作的表達;公頃產量的d與dd效應比a與aa效應變化要大,說明該性狀遺傳基礎比較復雜,顯性效應及其相互間的上位性效應對于遺傳的貢獻更加重要。

表3 產量性狀遺傳參數值
2.3 產量關鍵性狀遺傳效應分析
由于產量性狀的早期不可選擇性,需對其關鍵構成因素作進一步分析,結果列于表4。從聯合尺度檢驗的x2值看,公頃穗數屬于加性-顯性遺傳模型,6個組合的符合概率均在50%以上,大于90%概率的組合占67%,并且顯性效應大于加性效應(組合Ⅴ例外),而且從該性狀各世代平均值來看,顯性應為表現公頃穗數較多的基因,因此,證明該性狀應從早代開始選擇,直至品系穩定;穗粒數x2值的概率在10%~98%之間,分布均勻,不符合加性-顯性遺傳模型,具有上位性效應,遺傳基礎較為復雜,不宜進行早期選擇;千粒質量的x2值概率雖有高有低,但呈明顯兩極分化,證明其遺傳基礎相對簡單,對其加以選擇會有良好收效。
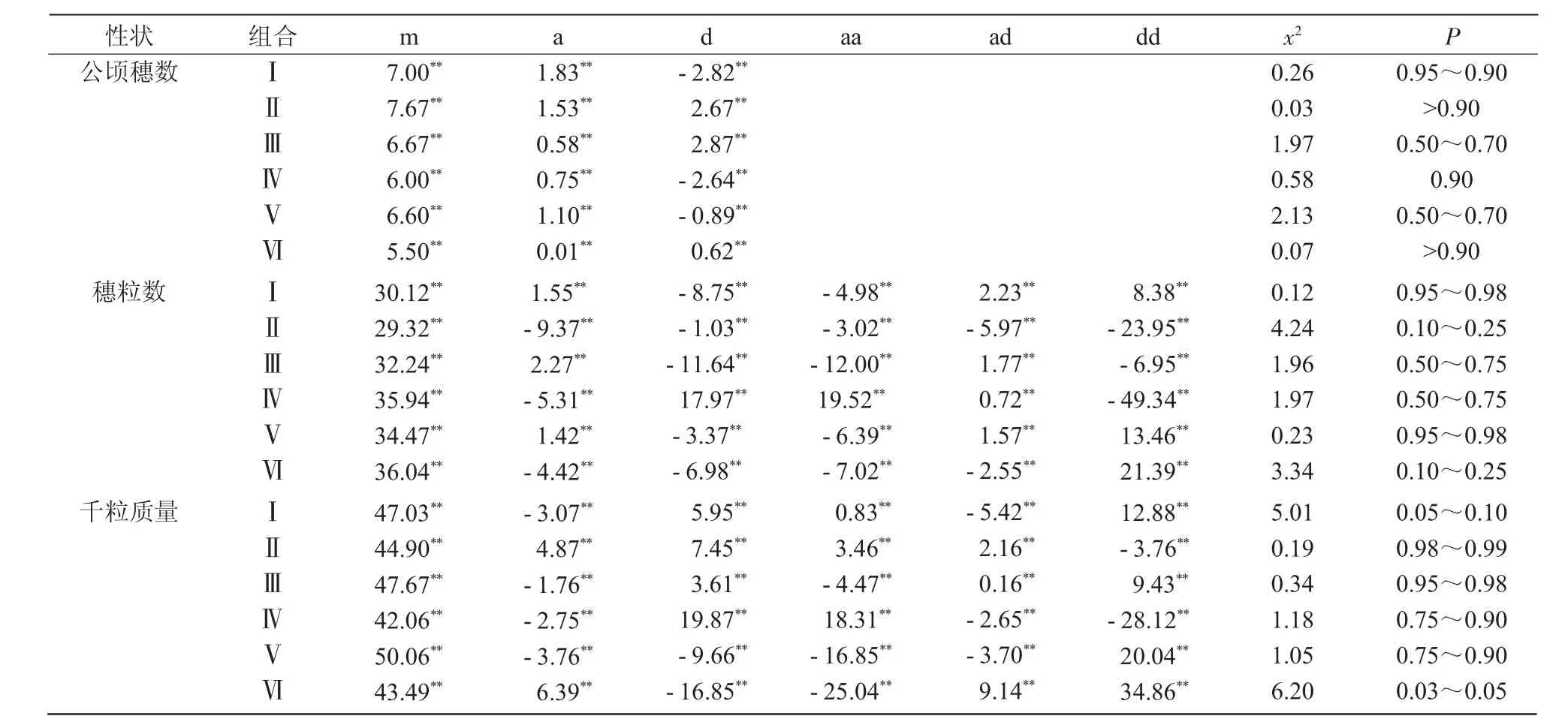
表4 產量三因素遺傳模型及參數估值
3個產量關鍵性狀各遺傳參數均達顯著水平,首先表現為顯性效應大于加性效應,且ad互作效應較弱,只有組合Ⅰ的千粒質量和組合Ⅱ的穗粒數的ad上位效應較aa上位效應大,但卻明顯低于dd上位效應。其次,穗粒數的dd效應明顯高于aa效應,使雜合體中加性基因的表達受到抑制(組合Ⅲ例外),因而,無法進行早期世代選擇;而千粒質量的aa效應雖然也較dd效應值小,但多數組合表現差異不大(組合Ⅵ除外),因而,在雜合體中得以表現,可于早代選擇。
3 結論與討論
近年來,小麥多種性狀及其各種遺傳標記廣泛應用于遺傳育種研究[16-19],但產量性狀仍是育種的目標性狀,其遺傳研究多是采用雙列雜交方法分析配合力和遺傳力[20-23],少有針對產量性狀進行多世代遺傳模型的研究,更無針對抗矮縮病材料而進行的產量性狀遺傳研究。另外,不同試驗材料和研究方法其結果也不盡一致。盧翔等[24]對小麥-冰草衍生后代3558-2采用主基因+多基因混合遺傳模型進行分析,結果表明,穗粒數符合數量性狀特征。王健勝等[25]對小麥-冰草衍生系3228進行遺傳分析,結果表明,穗粒數具有極顯著的加性和顯性效應。姚金保等[20]用8個小麥品種采用雙列雜交方法研究小麥穗粒數和粒質量的遺傳特性,結果表明,穗粒數和粒質量的遺傳均符合加性-顯性模型,基因作用方式以加性效應為主,顯性程度為部分顯性至完全顯性。
聯合尺度檢驗能充分利用全部試驗資料的信息,并考慮到由于方差不同而產生的世代平均數作用的差異,同時又能估算各遺傳效應的具體值,不失為一種評價性狀繼代遺傳的良好方法。本試驗以國外引進抗矮縮病資源為基礎,用抗矮縮病小麥材料與高產品種配制雜交組合,分析后代產量及其關鍵性狀遺傳,結果表明,小麥公頃產量符合加性-顯性遺傳模型的概率占70%左右,顯性效應極顯著地大于加性效應;產量性狀上位效應也占有相當大的比例,主要來源于回交親本,且抗病親本與高產親本回交效應表現差異,用抗矮縮病材料回交其產量結果與預期值一致或高于預期標準,而用高產品種回交其產量結果在預期值附近上下波動;另外,產量性狀上位性效應表現為加性×加性、顯性×顯性,且顯性間的上位效應顯著大于加性。
在3個產量關鍵性狀中,公頃穗數符合加性-顯性遺傳模型,且顯性大于加性,又由于顯性控制目標性狀,因而,育種上應從低代開始選擇分蘗成穗多的單株,直至純合;穗粒數和千粒質量的遺傳不符合加性-顯性模型,二者的遺傳差異表現在:穗粒數x2測驗的概率自低而高循序漸進,表現復雜的遺傳基礎,而千粒質量的x2概率卻呈明顯的兩極分化,因而,推斷其遺傳基礎相對簡單,早期選擇千粒質量會有良好收效,這與抗黃矮病小麥品系研究結論[26]一致。
[1]HOGENHOUT S A,AMMAR E D,WHITFIELD A E,et al.Insect vector interactions with persistently transmitted viruses[J].Annu Rev Phytopathol,2008,46:327-359.
[2]VACKE J.Wheat dwarf virus disease[J].Biol Plantarum,1961,3(3):228-233.
[3] LIU Y,WANG B,VIDA G,et al.Genomic analysis of the natural population of Wheat dwarf virus in wheat from China and Hungary[J].J Integr Agr,2012,11(12):2020-2027.
[4]LIU Y,JIN W,WANG L,et al.Replication-associated proteins encoded by Wheat dwarf virus act as RNA silencing suppressors[J].Virus Res,2014,190:34-39.
[5] KVARNHEDEN A,LINDBLAD M,LINDSTEN K,et al.Genetic diversity of WDV[J].Arch Virol Brief Report,2002,147:205-216.
[6]LEMMETTY A,HUUSELA-VEISTOLA E.First report of WDV in winter wheat in Finland[J].Plant Dis,2005,89:912.
[7]XIE J,WANGX,LIUY,et al.First report of the occurrence of WDV in wheat in China[J].Plant Dis,2007,91:111.
[8]王江飛,柳樹賓,吳蓓蕾,等.陜西韓城嚴重發生的小麥矮縮病病原鑒定與原因分析[J].植物保護,2008(2):17-21.
[9]王亞嬌,任堂雨,劉艷,等.小麥矮縮病毒外殼蛋白基因的原核表達、抗體制備及應用 [J].植物病理學報,2013,43(4):362-367.
[10]賈東升,馬元元,杜雪,等.水稻黑條矮縮病毒在灰飛虱消化系統的侵染和擴散過程 [J].植物病理學報,2014,44(2):188-194.
[11]WANG Y,MAO Q,LIU W,et al.Localization and distribution of Wheat dwarf virus in its vector leafhopper,Psammotettix alienus[J].Phytopathology,2014,104(8):897-904.
[12] HUO Y,LIU W,ZHANG F,et al.Transovarial transmission of a plant virus is mediated by vitellogenin of its insect vector[J].Plos Pathog,2014,10(3):e1003949.
[13]趙藝澤,劉艷,王錫鋒.利用酵母雙雜交系統篩選介體異沙葉蟬中與小麥矮縮病毒外殼蛋白互作的蛋白質 [J].中國農業科學,2015,48(12):2354-2363.
[14]黃金龍,孫其信,張愛民,等.電子計算機在遺傳育種中的應用[M].北京:中國農業出版社,1991:70-94.
[15]孔繁玲.植物數量遺傳學 [M].北京:中國農業大學出版社,2006:86-114.
[16]許陶瑜,唐朝暉,王長彪,等.SNP標記在小麥遺傳育種中的應用研究進展[J].山西農業科學,2017,45(9):1549-1552.
[17]馬原麗,暢志堅,郭慧娟,等.小麥新種質CH09W80抗白粉病基因遺傳分析及分子定位 [J].山西農業科學,2015,43(9):1069-1072.
[18]張麗,張建剛,潘登奎.黃淮麥區小麥品種F2籽粒中HMW-GS的遺傳表現[J].山西農業科學,2011,39(4):307-309.
[19]常柳,張蘭萍,逯成芳,等.小麥面粉谷蛋白溶漲指數的遺傳方式及 QTL定位[J].山西農業科學,2011,39(3):221-224.
[20]姚金保,王書文,姚國才,等.小麥產量構成因素的遺傳分析[J].上海農業學報,2004,20(1):45-48.
[21]張定一,曹亞萍,張明義,等.冬小麥抗大麥黃矮病毒與豐產性遺傳研究[J].中國生態農業學報,2005,13(1):68-71.
[22]范紹強,鄭王義,謝咸升,等.小麥抗黃矮病材料產量性狀遺傳分析[J].華北農學報,2005,20(2):89-92.
[23]鄒少奎,殷貴鴻,唐建衛,等.黃淮主推小麥品種主要農藝性狀配合力及遺傳效應分析 [J].麥類作物學報,2017,37(6):730-738.
[24]盧翔,張錦鵬,王化俊,等.小麥-冰草衍生后代3558-2穗部相關性狀的遺傳分析和QTL定位 [J].植物遺傳資源學報,2011,12(1):86-91.
[25]王健勝,劉偉華,王輝,等.小麥-冰草衍生系3228主要產量性狀的遺傳分析 [J].植物遺傳資源學報,2010,11(2):147-151,156.
[26]曹亞萍,張明義,范紹強,等.抗黃矮病小麥品系質量遺傳特性研究[J].中國生態農業學報,2004,12(1):33-35.

