潰瘍性結腸炎患者腸道菌群變化與細胞因子、TLRs分子表達的相關性研究
李 琳,鐘 青
潰瘍性結腸炎患者腸道菌群變化與細胞因子、TLRs分子表達的相關性研究
李 琳,鐘 青
目的探討潰瘍性結腸炎患者腸道菌群變化與細胞因子、TOLL樣受體(Toll-like receptors,TLRs)分子表達的相關性。方法將2015年6月—2016年12月在山東省醫學科學院第三附屬醫院確診并接受治療的潰瘍性結腸炎患者78例作為試驗組,同時選擇未患潰瘍性結腸炎的80例健康者作為對照組。分別對試驗組和對照組進行腸道菌群檢測,腸黏膜TLR2、TLR4、TLR5、TLR9分子表達檢測和外周血IL-4、IL-6、IL-17、IL-23、TNF-α等炎性細胞因子表達檢測,分析炎性細胞因子和TLRs表達與腸道菌群變化的關系。結果試驗組雙歧桿菌、乳桿菌含量明顯低于對照組(P均<0.05),擬桿菌、腸桿菌、腸球菌、梭桿菌含量明顯高于對照組(P均<0.05);試驗組腸黏膜組織中TLR2、TLR4、TLR5、TLR9表達明顯高于對照組(P均<0.05);試驗組外周血IL-4表達低于對照組,IL-6、IL-17、IL-23、TNF-α等炎性細胞因子表達高于對照組(P均<0.05)。Pearson相關性分析顯示,TLR2、TLR4、TLR5、TLR9表達與擬桿菌、腸桿菌、腸球菌含量呈正相關,與雙歧桿菌、乳桿菌含量呈負相關;與IL-6、IL-17、IL-23、TNF-α表達呈正相關,與IL-4表達呈負相關。結論潰瘍性結腸炎患者正常腸道菌群平衡被打破,促炎因子表達增加,抑炎因子表達減少,TLRs分子表達增加。腸道菌群紊亂可能通過增強TLRs分子表達來促進促炎因子的分泌,介導腸黏膜炎性反應。
潰瘍性結腸炎;腸道菌群;炎性細胞因子;炎癥反應
潰瘍性結腸炎(ulcerative colitis,UC)是一種慢性炎癥性腸道疾病,主要臨床特征有腹痛、腹瀉和黏液膿血便,大腸黏膜和黏膜下層是主要病變區域,病情遷延不愈、反復發作,給患者造成巨大的痛苦和心理壓力。UC發病機制尚未完全闡明,但有研究證實其發作與環境、遺傳、免疫功能及腸道菌群密切相關[1]。腸道菌群數量巨大、種類繁多,在正常情況下主要參與腸道內物質的分解和代謝,能夠維持腸道正常的生理功能和抑制疾病的發生。一旦發生慢性疾病,腸道菌群的數量和種類都會發生改變,在內源性腸道感染和抑制免疫系統中發揮作用[2]。免疫應答紊亂和細胞炎性反應是造成UC的關鍵病理環節[3],而腸道菌群的失調是造成免疫應答紊亂和細胞炎性反應的關鍵因素。因此,許多研究認為腸道菌群的改變與UC的發生息息相關[4]。關于腸道菌群失調導致腸黏膜損傷的機制尚未明確。本次研究就UC患者腸道菌群變化與細胞因子、TOLL樣受體(Tolllike receptors,TLRs)表達的相關性展開研究,為臨床治療提供新思路。
1 對象與方法
1.1 對象 2015年6月—2016年12月在山東省醫學科學院第三附屬醫院確診并接受治療的UC患者78例為試驗組,同時選擇80例未患UC的健康者為對照組。對照組男43例,女37例,年齡18~70歲,平均年齡(48.7±13.5)歲,經腸鏡檢查確認排除腸道疾病,臨床體征證實身體健康,3個月內無抗生素服用記錄。試驗組男42例,女36例,年齡20~70歲,平均年齡(49.1±12.8)歲,經腸鏡檢查和病理學檢查確診為UC,排除3個月內有抗生素、激素和免疫抑制劑服用記錄的患者,以及腸結核、寄生蟲感染等感染性結腸炎患者。試驗組與對照組在性別、年齡方面差異無統計學意義(P>0.05),見表1。
表1 2組患者基本情況比較(±s)Table 1 Comparison of general information between 2 groups(±s)
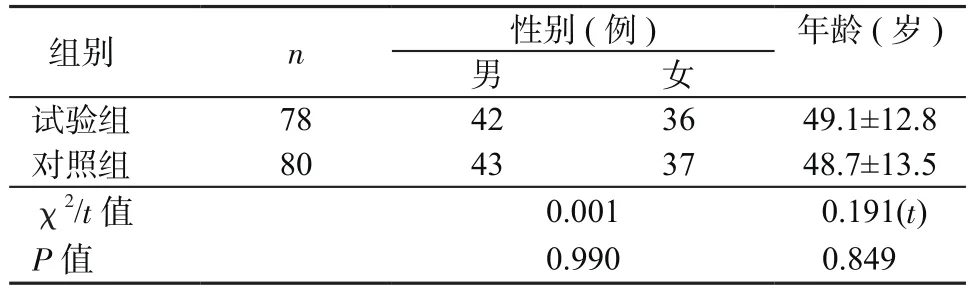
表1 2組患者基本情況比較(±s)Table 1 Comparison of general information between 2 groups(±s)
組別 n 性別(例) 年齡(歲)男女試驗組 78 42 36 49.1±12.8對照組 80 43 37 48.7±13.5 χ2/t值 0.001 0.191(t)P值 0.990 0.849
1.2 診斷標準 根據《炎癥性腸病診斷與治療的共識意見(2012年·廣州)》[5]中UC診斷部分中相關標準。臨床表現:腹瀉、腹痛、黏液膿血便持續反復發作,伴有不同程度的全身癥狀,病程4周以上。結腸鏡輔助檢查:①多發性、彌漫性潰瘍或糜爛;②黏膜血管紋理不清晰,有充血、水腫、紊亂等;③結腸袋囊變鈍、變淺甚至消失,假息肉或橋形黏膜。
1.3 方法
1.3.1 腸道菌群檢測 2組研究對象均隨機挑取0.5 g新鮮糞便,電子稱重后加入4.5 ml稀釋液稀釋,取10 μl接種于相應的培養基上。根據不同菌種使用培養基,37℃溫箱內培養48 h后,細菌革蘭染色,計算菌落平均數,計算每克糞便中含有的菌群數目。使用MALDI Biotyper系統(德國BRUKER公司)進行細菌質譜鑒定。采用鱟試劑三肽顯色基質偶氮法檢測內毒素。
1.3.2 細胞因子檢測 采用ELISA法對人體外周血IL-4、IL-6、IL-17、IL-23和TNF-α細胞因子含量進行測定。所有研究對象均取清晨空腹外周靜脈血5 ml,血清分離后于-70℃保存待檢。使用ELISA試劑盒(美國Genzyme公司)檢測血清,嚴格遵循試劑盒操作說明書執行。
1.3.3 TLRs分子表達檢測 進行腸鏡檢查時,取適量試驗組患者病變腸黏膜組織和對照組健康者正常腸黏膜組織,加入RIPA裂解液(上海基爾頓生物有限公司)后充分勻漿,離心分離上清,使用ELISA試劑盒(上海酶聯生物公司)測定TLR2、TLR4、TLR5以及TLR9蛋白表達量,抗體購于英國abcam公司。采用BCA試劑盒(美國Thermo Fisher Scientific公司)測定總蛋白含量,并計算每毫克蛋白中TLRs蛋白含量。
1.4 統計學處理 將所得數據輸入SPSS 17.0統計學軟件,采用 Shapiro-Wilk 進行正態性檢驗,樣本均滿足正態分布,用±s表示,2組比較用獨立樣本t檢驗(方差齊)。相關性分析采用 Person相關分析。P<0.05表示差異有統計學意義。
2 結 果
2.1 2 組腸道菌群含量比較 2組雙歧桿菌、乳桿菌、擬桿菌、腸桿菌、腸球菌、梭桿菌含量差異有統計學意義(P均<0.05),其中試驗組雙歧桿菌、乳桿菌含量明顯低于對照組,擬桿菌、腸桿菌、腸球菌、梭桿菌含量明顯高于對照組,見表2。
表2 2組腸道菌群含量比較(CFU/g,±s)Table 2 Comparison of intestinal microflora contents between 2 groups(CFU/g,±s)
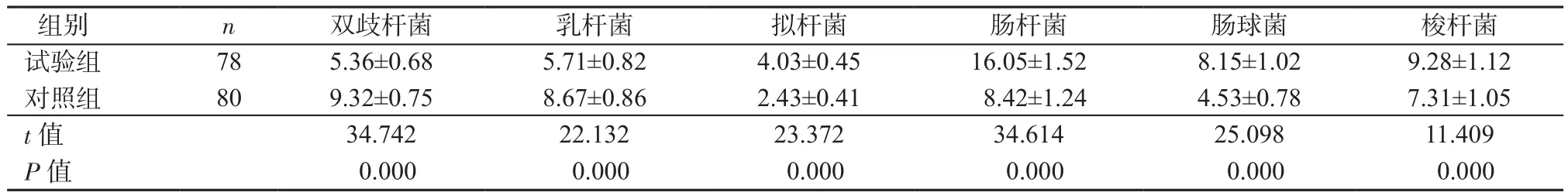
表2 2組腸道菌群含量比較(CFU/g,±s)Table 2 Comparison of intestinal microflora contents between 2 groups(CFU/g,±s)
組別 n 雙歧桿菌 乳桿菌 擬桿菌 腸桿菌 腸球菌 梭桿菌試驗組 78 5.36±0.68 5.71±0.82 4.03±0.45 16.05±1.52 8.15±1.02 9.28±1.12對照組 80 9.32±0.75 8.67±0.86 2.43±0.41 8.42±1.24 4.53±0.78 7.31±1.05 t值 34.742 22.132 23.372 34.614 25.098 11.409 P值 0.000 0.000 0.000 0.000 0.000 0.000
2.2 2組腸黏膜中TLRs表達比較 試驗組腸黏膜組織中TLR2、TLR4、TLR5、TLR9表達均明顯高于對照組(P均<0.05),見表3。Pearson相關性分析顯示,病變黏膜中TLR2、TLR4、TLR5、TLR9表達與擬桿菌(r=0.623,P=0.015)、腸桿菌(r=0.634,P=0.013)、腸球菌(r=0.652,P=0.010)、梭桿菌(r=0.545,P=0.024)含量呈正相關,與雙歧桿菌(r=-0.681,P=0.015)、乳桿菌(r=-0.652,P=0.018)含量呈負相關。
表3 2組腸黏膜中TLR2、TLR4、TLR5、TLR9表達比較(μg/mg,±s)Table 3 Comparison of TLR2,TLR4,TLR5,TLR9 expressions in intestinal mucosa between 2 groups(μg/mg,±s)
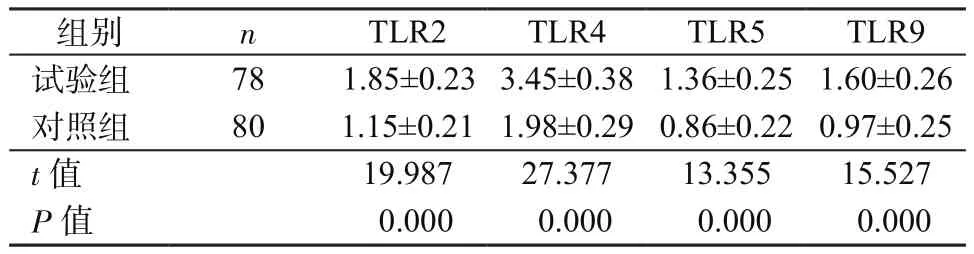
表3 2組腸黏膜中TLR2、TLR4、TLR5、TLR9表達比較(μg/mg,±s)Table 3 Comparison of TLR2,TLR4,TLR5,TLR9 expressions in intestinal mucosa between 2 groups(μg/mg,±s)
組別 n TLR2 TLR4 TLR5 TLR9試驗組 78 1.85±0.233.45±0.381.36±0.25 1.60±0.26對照組 80 1.15±0.21 1.98±0.290.86±0.22 0.97±0.25 t值 19.987 27.377 13.355 15.527 P值 0.000 0.000 0.000 0.000
2.3 2組外周血細胞因子表達比較 2組外周血IL-4、IL-6、IL-17、IL-23及 TNF-α表達差異有統計學意義(P均<0.05),其中試驗組IL-4表達明顯低于對照組(P<0.05),IL-6、IL-17、IL-23及TNF-α表達明顯高于對照組(P均<0.05),見表4。Pearson相關性分析顯示,病變黏膜中TLR2、TLR4、TLR5、TLR9表達與IL-6(r=0.478,P=0.028)、IL-17(r=0.511,P=0.011)、IL-23(r=0.605,P=0.008)及 TNF-α(r=0.658,P=0.006)表達呈正相關,與IL-4(r=-0.687,P=0.013)表達呈負相關。
表4 2組外周血L-4、IL-6、IL-17、IL-23、TNF-α表達比較(ng/ml,±s)Table 4 Comparison of IL-4,IL-6,IL-17,IL-23,TNF-α expressions in peripheral blood between 2 groups(ng/ml,±s)
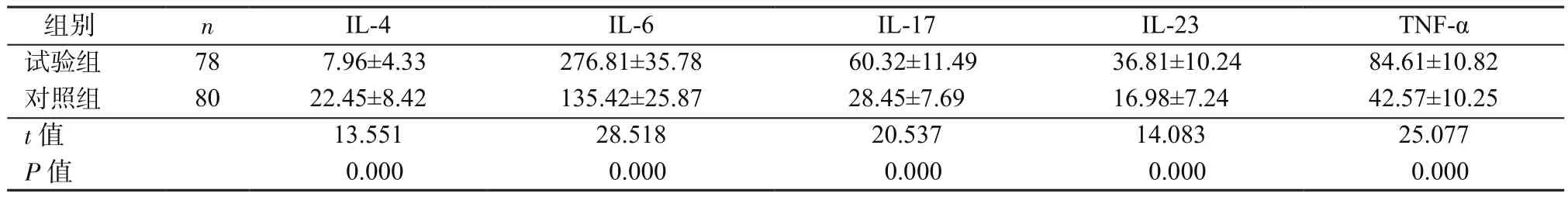
表4 2組外周血L-4、IL-6、IL-17、IL-23、TNF-α表達比較(ng/ml,±s)Table 4 Comparison of IL-4,IL-6,IL-17,IL-23,TNF-α expressions in peripheral blood between 2 groups(ng/ml,±s)
組別 n IL-4 IL-6 IL-17 IL-23 TNF-α試驗組 78 7.96±4.33 276.81±35.78 60.32±11.49 36.81±10.24 84.61±10.82對照組 80 22.45±8.42 135.42±25.87 28.45±7.69 16.98±7.24 42.57±10.25 t值 13.551 28.518 20.537 14.083 25.077 P值 0.000 0.000 0.000 0.000 0.000
3 討 論
正常人體腸道內含有大量細胞,且種類繁多,數量巨大,主要集中在結腸和小腸末端。腸道菌群按照一定的比例組合,各菌種之間互相依存、互相制約,在質量和數量上形成一個總體的生態平衡[6]。按照種類劃分,腸道菌群可以分為以下3種[7]:①與人體共生細菌。此類細菌能夠參與到分解、代謝,調節免疫力等作用中來,被稱為腸道優勢菌群,主要代表有雙歧桿菌、擬桿菌等。②機會致病菌。此類細菌正常情況下在腸道內數量較少,一旦機體免疫功能下降就會大量增殖,引起炎癥反應等,被稱為非優勢菌群,主要有腸桿菌和腸球菌等。③病原菌。此類細菌不在腸道內長期定植,大部分為過路菌,如變形桿菌等。各組細菌相互依存,共同維系著消化道的穩定與平衡。一旦發生菌群失調,就會引發多種消化道疾病。大腸桿菌等致病菌在菌群失調時侵襲能力增強,對腸黏膜造成損傷[8]。雙歧桿菌和乳桿菌則能對抗致病菌的侵襲。在本次研究中發現,與對照組相較,試驗組UC患者的雙歧桿菌、乳桿菌含量明顯降低(P均<0.05),擬桿菌、腸桿菌、腸球菌含量明顯提高(P均>0.05)。腸道菌群在物質代謝和免疫功能維持方面發揮著重要的作用[9],腸道內致病菌和病原菌較少,在正常范圍時不會致病,一旦數量超過正常范圍就會致病。UC的發生、遷延不愈以及反復發作與腸道菌群失調有密切的關系[10]。
腸道菌群失調和UC發展之間的相關性研究開展較多,但其引起腸黏膜炎癥性損傷的分子機制尚不能明確。眾多研究結果均顯示TLRs對UC的發生與發展都有著重要的影響[11]。TLRs是一種先天形成的免疫蛋白,對細菌和病毒進行識別是其主要功能,同時也在機體免疫系統中發揮重要作用。TLR4是較早發現的TLRs之一,主要功能是識別脂多糖,同時能夠產生傳通信號穿過細胞膜加快炎癥因子的增殖[12]。為了明確UC發展過程中TLRs發揮的作用,本研究就試驗組病變腸黏膜組織和對照組正常腸黏膜組織內TLRs的表達進行了對比分析,結果顯示:試驗組患者病變腸黏膜組織中TLR2、TLR4、TLR5以及TLR9表達均明顯高于對照組(P均<0.05)。通過相關性分析發現,TLR2、TLR4、TLR5以及TLR9蛋白的表達與擬桿菌、腸桿菌以及腸球菌的含量呈正相關,與雙歧桿菌和乳桿菌的含量呈負相關。本次研究結果表明,TLRs的高表達可能與UC的發生關系密切,UC患者腸道菌群失調能夠增強腸黏膜中TLR2、TLR4、TLR5以及TLR9蛋白的表達,介導炎性反應。
TNF-α是炎癥啟動因子,在炎癥發生發展過程中必不可少。IL-4為抗炎因子,可以下調炎癥細胞因子基因的轉錄和分泌,具有抗炎和免疫調節的作用,是腸道免疫的重要因子[13]。IL-6是一種促炎細胞因子,可以介導炎性反應,具有多重免疫調節功能,對機體生理平衡的維持至關重要。IL-17由Th17細胞分泌得到的促炎因子,對腸黏膜的炎癥性損傷具有直接介導作用[14]。IL-23是由B淋巴細胞和單核巨噬細胞分泌得到的促炎因子,對Th17細胞具有激活作用,可加劇腸黏膜的炎性反應[15]。在本研究中,試驗組外周血IL-4表達明顯低于對照組(P<0.05),IL-6、IL-17、IL-23以及TNF-α表達明顯高于對照組(P均<0.05)。通過相關性分析發現,TLR2、TLR4、TLR5以及TLR9蛋白的表達與IL-4表達呈負相關,與IL-6、IL-17、IL-23及TNF-α表達呈正相關。研究結果表明,TLRs的高表達促進IL-4等抑炎因子水平下降,促進IL-6、IL-17、IL-23及TNF-α等促炎因子水平提高,通過其來介導炎性反應。
綜上所述,UC患者正常腸道菌群平衡被打破,促炎因子表達增加,抑炎因子表達減少,TLRs分子表達增加。腸道菌群紊亂可能會通過增強TLRs分子表達來促進促炎因子的分泌,介導腸黏膜炎性反應。
[1]張瑩,熊晶晶,黃永坤,等.美沙拉秦、蒙脫石散和酪酸梭菌對潰瘍性結腸炎大鼠血細胞因子的影響[J].中國免疫學雜志,2015,31(2):240-246,249.
[2]Li SQ.Detection of intestinal flora levels as well as cytokine and TLRs molecule expression in patients with ulcerative colitis[J].海南醫科大學學報(英文版),2017,23(5):95-98.
[3]閆曙光.烏梅丸及其拆方對潰瘍性結腸炎大鼠細胞因子、炎性介質及TLR4/NF-κB信號通路影響的實驗研究[D].成都:成都中醫藥大學,2012.
[4]劉淑清.TLR2介導TB10.4激活RAW264.7通路及細胞因子表達的研究[D].北京:中國農業科學院,2014.
[5]中華醫學會消化病學分會炎癥性腸病學組.炎癥性腸病診斷與治療的共識意見(2012年·廣州)[J].中華內科雜志,2012,51(10):818-831.
[6]黃坤,吳麗麗,楊云生.腸道微生態與人類疾病關系的研究進展[J].傳染病信息,2017,30(3):133-137.
[7]Fernandes P,MacSharry J,Darby T,et al.Differential expression of key regulators of Toll-like receptors in ulcerative colitis and Crohn's disease:a role for Tollip and peroxisome proliferatoractivated receptor gamma?[J].Clin Exp Immunol,2016,183(3):358-368.
[8]Tan Y,Zou KF,Qian W,et al.Expression and implication of tolllike receptors TLR2,TLR4 and TLR9 in colonic mucosa of patients with ulcerative colitis[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(5):785-790.
[9]鄒穎,遲宏罡,歐陽霖芮,等.黃芩苷對實驗性結腸炎小鼠TLRs/MyD88通路的作用研究[J].天然產物研究與開發,2014,26(6):952-956.
[10]崔路佳,王裕宣.潰瘍性結腸炎患者腸道菌群改變與炎性指標的相關性研究[J].海南醫學,2014,25(20):3014-3016.
[11]劉偉,劉翔,林漫鵬,等.潰瘍性結腸炎患者正常與病變腸段腸道菌群比較[J].湖北民族學院學報(醫學版),2011,28(1):4-6.
[12]劉志威,王學群,李甜甜.潰瘍性結腸炎患者腸道菌群變化的臨床意義[J].胃腸病學和肝病學雜志,2016,25(5):554-556.
[13]安婷婷,朱西杰,張薔,等.復方蜥蜴散不同微粒組合劑干預大鼠潰瘍性結腸炎模型TLRs/MyD88信號通路及下游炎癥因子的實驗研究[J].上海中醫藥雜志,2016,50(11):82-88.
[14]蔣曼,姚萍,楊濤,等.實時熒光定量PCR法研究潰瘍性結腸炎患者腸道雙歧桿菌屬、柔嫩梭菌屬及擬桿菌屬量的變化[J].中國微生態學雜志,2013,25(11):1245-1249,1254.
[15]單佩英.潰瘍性結腸炎患者腸道菌群多樣性及炎癥細胞因子變化的研究[D].大連,大連醫科大學,2012.
Correlation of intestinal microflora with cytokines and Toll-like receptors expression in patients with ulcerative colitis
Li Lin,ZHONG Qing*
Digestive System Department, Shandong Institule of Parasitical Disease,Shandong Academy of Medical Science,Jining 272033,China
*Corresponding author,E-mail:o1r1tp@163.com
ObjectiveTo investigate the correlation of the changes of intestinal flora with the expression of cytokines and Tolllike receptors (TLRs) molecules in patients with ulcerative colitis.MethodsFrom June 2015 to December 2016,78 patients with ulcerative colitis diagnosed and treated in the Third Affiliated Hospital of Shandong Academy of Medical Sciences were selected as the experimental group,and 80 healthy subjects were chosen as the control group.The intestinal flora detection,expression of TLR2,TLR4,TLR5,TLR9 molecules in intestinal mucosa, expression of IL-4,IL-6,IL-17,IL-23,TNF-α and other inflammatory cytokines in peripheral blood in the experimental group and control group were analyzed respectively.The correlation of inflammatory cytokines and the expression of TLRs with the change of intestinal flora was also analyzed.ResultsThe contents of bifidobacterium and lactobacillus in the experimental group were significantly lower than those in the control group (P<0.05),while the contents of bacteroides,enterobacter,enterococcus and fusobacterium were significantly higher (P<0.05).The expressions of TLR2,TLR4,TLR5 and TLR9 in intestinal mucosa of the experimental group were significantly higher than those of the control group (P<0.05).The expression of IL-4 in peripheral blood of the experimental group was lower than that of the control group,and the expressions of IL-6,IL-17,IL-23,TNF-α and other inflammatory cytokines were higher than that of the control group (P<0.05).Pearson correlation analysis showed that TLR2,TLR4,TLR5,TLR9 expressions were positively correlated with the contents of bacteroides,enterobacter and enterococcus,and negatively correlated with bifidobacterium and lactobacillus; it was also positively correlated with IL-6,IL-17,IL-23,TNF-α expression and negatively correlated with IL-4 expression.ConclusionsNormal intestinal flora balance of ulcerative colitis patients is broken,the expression of proinflammatory cytokines increases,the expression of proinflammatory factors decreases,and the expression of TLRs molecules increases.The disorder of intestinal flora promotes the secretion of proinflammatory cytokines by enhancing the expression of TLRs molecules and mediates the inflammatory response of the intestinal mucosa.
ulcerative colitis; intestinal flora; inflammatory cytokines; inflammatory response
R574.62;R378
A
1007-8134(2017)06-0361-04
10.3969/j.issn.1007-8134.2017.06.012
272033 濟寧,山東省醫學科學院 山東省寄生蟲病防治研究所消化內科(李琳);650041,昆明市第三人民醫院肝病二科(鐘青)
鐘青,E-mail:o1r1tp@163.com
(2017-11-20 收稿 2017-12-14 修回)
(本文編輯 趙雅琳)

