食管鱗狀細胞癌組織中miRNA-29a、miRNA-29b、miRNA-29c、VEGF-A表達變化及其相關性
宋雷雷,徐廣峰,謝暉,張乃鍵,邵啟祥
(1江蘇大學醫學院,江蘇鎮江212013;2中國人民解放軍第82醫院)
·論著·
食管鱗狀細胞癌組織中miRNA-29a、miRNA-29b、miRNA-29c、VEGF-A表達變化及其相關性
宋雷雷1,2,徐廣峰2,謝暉2,張乃鍵2,邵啟祥1
(1江蘇大學醫學院,江蘇鎮江212013;2中國人民解放軍第82醫院)
目的觀察食管鱗狀細胞癌(ESCC)癌組織及癌旁組織中miRNA-29家族(miRNA-29a、miRNA-29b、miRNA-29c)及血管內皮生長因子A(VEGF-A)的相對表達量變化,并探討他們之間的關系。方法收集手術切除并經病理檢查確診的ESCC癌組織及癌旁組織,應用qRT-PCR及免疫組織化學染色技術分別檢測miRNA-29a、miRNA-29b、miRNA-29c、VEGF-A的相對表達量,并分析其相關關系;進一步應用生物信息學方法和雙熒光素酶報告基因系統推測和驗證miRNA-29a、miRNA-29b、miRNA-29c共同調控同一靶基因VEGF-A的分子調節機制。結果與癌旁組織比較,ESCC癌組織中miRNA-29a、miRNA-29b、miRNA-29c呈低表達(P均<0.05);VEGF-A呈高表達(P<0.05),且其之間呈負相關關系(miRNA-29a:r=-0.955;miRNA-29b:r=-0.950;miRNA-29c:r=-0.893,P均<0.01)。生物信息學分析結果發現,VEGF-A能夠與miRNA-29a、miRNA-29b、miRNA-29c進行特異性結合,可能為miRNA-29a、miRNA-29b、miRNA-29c共同的靶基因。雙熒光素酶報告基因系統驗證了VEGF-A是miRNA-29a、miRNA-29b、miRNA-29c共同的靶基因。結論ESCC癌組織中miRNA-29a、miRNA-29b、miRNA-29c低表達,VEGF-A高表達;且他們之間具有負相關關系。VEGF-A為miRNA-29a、miRNA-29b、miRNA-29c共同的靶向調節基因。
食管鱗狀細胞癌;微小RNA-29a;微小RNA-29b;微小RNA-29c;血管內皮生長因子A
食管鱗狀細胞癌(ESCC)是我國最常見惡性腫瘤[1]。ESCC具有高度轉移和侵襲性特點,其5年存活率僅為18%[2]。現階段,關于ESCC發生發展過程中的具體分子調節機制尚未明確。近年,大量研究表明,微小RNA(miRNA)作為一類含有18~25個核苷酸的內源性非編碼單鏈小分子RNA在ESCC的發生發展過程中發揮了重要調節作用。隨著miRNA研究的不斷深入,研究人員發現異常表達的miRNA可以導致下游靶基因的異常表達可能是ESCC疾病重要的調節機制。2015年5月~2016年5月,本研究通過檢測ESCC癌組織及癌旁組織中miRNA-29家族(miRNA-29a、miRNA-29b、miRNA-29c)、VEGF-A的相對表達量變化情況,分析其之間的相關關系。然后進一步應用生物信息學分析方法和實驗技術對miRNA-29家族可以共同調控靶基因VEGF-A這一分子調節機制進行了推測與實驗驗證。
1 材料與方法
1.1 細胞、組織、試劑、儀器及其來源 細胞系HEK-293T購自中科院上海細胞庫。ESCC患者的癌組織及癌旁組織各55例份,患者中男35例、女20例,年齡30~80歲。根據世界衛生組織和國際抗癌聯盟的標準,高分化22例份、中分化28例份、低分化5例份;Ⅰ~Ⅱ期18例份、Ⅲ~Ⅳ期37例份;有淋巴結轉移42例份、無淋巴結轉移13例份。組織化學染色試劑購自北京中杉金橋公司;has-miR-29a、miRNA-29b、miRNA-29c引物和載體(psiCHECK-2)購自美國Sigma公司;熒光定量PCR儀(ABI7500)購自美國Applied Biosystems 公司。
1.2 ESCC癌組織及癌旁組織中miRNA-29a、miRNA-29b、miRNA-29c表達的檢測 首先選取3組配對的ESCC樣本進行預實驗,應用微陣列芯片檢測技術篩選ESCC癌組織及癌旁組織中具有顯著差異性表達的miRNAs。應用qRT-PCR驗證,所有操作嚴格按說明書進行,并以U6為內參照,實驗重復3次,取平均值。采用U6來校對樣本中miRNA-29a、miRNA-29b、miRNA-29c的相對表達量。以2-ΔΔCt計算miRNA-29a、miRNA-29b、miRNA-29c的相對表達量。ΔCt=miRNA-29a、miRNA-29b、miRNA-29c的Ct值-U6的Ct值,ΔΔCt=癌組織ΔCt-癌旁組織ΔCt。
1.3 ESCC癌組織及癌旁組織中VEGF-A mRNA及蛋白相對表達量的檢測 分別采用qRT-PCR法和免疫組織化學染色法。qRT-PCR法:所有操作嚴格按照說明書進行,并以U6為內參照,實驗重復3次,取平均值,以2-ΔΔCt計算目的基因相對表達量。免疫組織化學染色法:石蠟切片脫蠟至水,3% H2O2室溫孵育;抗原微波熱修復,5%~10%正常山羊血清封閉非特異性位點;傾去血清,滴加VEGF-A一抗工作液,37 ℃孵育過夜;滴加生物素標記的二抗工作液和辣根過氧化物酶標記的鏈酶卵白素工作液;DAB染色,蘇木素復染細胞核,封片,用中山橋公司提供的已知大腸癌陽性標本作為陽性對照;以PBS代替一抗作為陰性對照,所有操作嚴格按照說明書進行。結果判斷:VEGF-A蛋白陽性表達定位于細胞膜或細胞質內,呈棕黃色顆粒。在低倍鏡(40倍)下選取陽性細胞最密集區域,然后在100倍視野下計數1 000個細胞,計算陽性細胞占腫瘤細胞的百分率,在高倍鏡下(400倍)觀察細胞染色程度、定位及形態。不著色計為陰性(-),陽性細胞數< 25%計為弱陽性(+),25%~50%計為陽性表達(+ +),>50%計為強陽性(+ + +)。具體實驗步驟及結果判斷由兩位臨床病理醫生操作及按雙盲法進行計數,計數差異超過10%,需重新計數。
1.4 miRNA-29a、miRNA-29b、miRNA-29c共同靶基因的預測分析 應用 mirtarbase數據庫(http://mirtarbase.mbc.nctu.edu.tw/)篩選miRNA-29a、miRNA-29b、miRNA-29c共同的靶基因。應用STRING蛋白質相互作用數據庫(http://string-db.org/)構建蛋白質相互作用網絡。應用DAVID數據庫(http://david.abcc.ncifcff.gov/home.jsp)進行信號轉導通路的富集分析。
1.5 miRNA-29a、miRNA-29b、miRNA-29c與VEGF-A靶向關系的驗證 采用雙熒光素酶試驗。將HEK-293細胞接種在96孔板中,培養24 h后,分別共轉染質粒、VEGF-A野生型3′-UTR(未突變組)、VEGF-A突變型3′-UTR(突變組)。細胞培養48 h后,應用Dual-Glo熒光素酶測定系統(Promega公司)測量螢火蟲熒光素酶活性和海腎熒光素酶活性,實驗檢測結果用相對熒光素酶活性表示。計算公式:相對熒光素酶活性=螢火蟲熒光素酶活性值/海腎熒光素酶活性值,每組實驗重復3次。
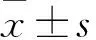
2 結果
2.1 ESCC癌組織及癌旁組織中miRNA-29a、miRNA-29b、miRNA-29c的相對表達量 ESCC癌組織中miRNA-29a、miRNA-29b、miRNA-29c的相對表達量分別為0.83±0.049、0.69±0.280、0.42±0.140,癌旁組織中分別為0.98±0.011、0.96±0.008、0.94±0.014。與癌旁組織比較,ESCC癌組織中miRNA-29a、miRNA-29b、miRNA-29c的相對表達量低(P均<0.05),與預實驗里的芯片篩選結果一致。
2.2 ESCC癌組織及癌旁組織中VEGF-A的相對表達量比較 ESCC癌組織與癌旁組織中VEGF-A mRNA的相對表達量分別為4.84±0.152、0.98±0.012。ESCC癌組織中VEGF-A mRNA的相對表達量高于癌旁組織(P<0.05)。VEGF-A免疫組化陽性表達主要位于細胞質,部分表達于細胞膜,陽性表達為棕黃色顆粒。55例份ESCC癌組織中, VEGF-A染色陽性39例份,陽性率為70.9%。55例ESCC癌旁組織中, VEGF-A染色陽性9例,陽性率為16.4%。ESCC癌組織中的VEGF-A陽性率高于癌旁組織(P<0.05)。
2.3 ESCC癌組織中VEGF-A與miRNA-29a、miRNA-29b、miRNA-29c的相關性 VEGF-A mRNA的相對表達量與miRNA-29a、miRNA-29b、miRNA-29c的相對表達量呈負相關(miRNA-29a:r=-0.955;miRNA-29b:r=-0.950;miRNA-29c:r=-0.893,P均<0.05)。
2.4 miRNA-29a、miRNA-29b、miRNA-29c共同靶基因的預測分析 miRNA-29a靶基因97個,miRNA-29b靶基因88個,miRNA-29c靶基因66個,三者取交集得到它們共同的靶基因42個。富集分析結果發現:VEGF-A位于所構建網絡的中心位置,參與了多數網絡途徑的調節過程。miRNA-29a、miRNA-29b、miRNA-29c共同靶基因的信號調節通路顯著富集于黏著斑、PI3K-AKT、癌癥、小細胞肺癌等信號通路;VEGF-A參與其中的黏著斑、PI3K-AKT、癌癥、癌癥miRNAs信號調節通路途徑。
2.5 miRNA-29a、miRNA-29b、miRNA-29c與VEGF-A的靶向關系 生物信息學分析發現,VEGF-A的3′非翻譯區的序列(TGGTGCT)與miRNA-29a、miRNA-29b、miRNA-29c的序列之間可以進行互補結合。突變組和未突變組中miRNA-29a熒光素酶活性分別為0.978±0.056,0.549±0.097;miRNA-29b分別為0.967±0.075,0.675±0.086;miRNA-29c分別為0.975±0.081,0.732±0.092。與未突變組比較,突變組miRNA-29a、miRNA-29b、miRNA-29c熒光素酶活性升高(P均<0.01)。
3 討論
miRNA-29家族包括miRNA-29a、miRNA-29b-1、miRNA-29b-2、miRNA-29c,各家族成員之間具有相似的種子序列。其中miRNA-29a和miRNA-29b-1基因位于染色體7q3.2;miRNA-29b-2、miRNA-29c位于染色體1q3.2[3]。在腫瘤疾病中,miRNA-29a、miRNA-29b、miRNA-29c既可作為致癌基因也可作為抑癌基因而發揮重要的調控作用。已有研究表明,在多數腫瘤疾病中miRNA-29a、miRNA-29b、miRNA-29c呈現出低表達現象,其可以通過抑制其靶基因的途徑,而作為抑癌基因抑制腫瘤細胞的轉移和浸潤,如惡性膠質瘤[4]、前列腺癌[5]、腎癌[6]、套細胞淋巴瘤[7]、鼻咽癌[8]等。但同時也有相關研究表明,在少數腫瘤疾病中miRNA-29a、miRNA-29b、miRNA-29c又可作為致癌基因,呈現出高表達的現象,如乳腺癌[9]、惡性胸膜間皮瘤[10]、彌漫性大B淋巴瘤[11]。本研究結果發現,在ESCC癌組織中miRNA-29a、miRNA-29b、miRNA-29c呈現出低表達的現象。由此我們推測,在ESCC的發生發展過程miRNA-29a、miRNA-29b、miRNA-29c可能作為抑癌基因發揮抑制癌癥的作用。但現階段,在ESCC疾病過程中miRNA-29a、miRNA-29b、miRNA-29c發揮作用的具體分子機制尚未見詳細報道。
近年來,生物信息學方法已經廣泛地應用于miRNA相關分子調節機制的研究。為進一步深入探討在ESCC疾病中miRNA-29a、miRNA-29b、miRNA-29c具體的分子調節機制,我們采用生物信息學分析方法,通過在線miRNA靶基因預測軟件對人miRNA-29a、miRNA-29b、miRNA-29c共同的靶基因進行了預測,并對其共同的靶基因進行功能富集分析。研究結果發現miRNA-29a、miRNA-29b、miRNA-29c共同的靶基因在功能方面主要集中在細胞基質黏附調節、蛋白質的細胞外基質、器官的形態發生、血管發育途徑等方面;在信號調節途徑方面主要集中于癌癥miRNAs、黏著斑、PI3K-Akt等信號調節途徑。與此同時,我們發現VEGF-A作為miRNA-29a、miRNA-29b、miRNA-29c共同的預測靶基因參與了多條信號調節途徑。據此我們推斷VEGF-A可能是miRNA-29a、miRNA-29b、miRNA-29c共同的靶基因。
VEGF-A是一類血管內皮生長刺激因子,具有促進血管形成和再生的功能。研究表明,在腫瘤疾病的發生發展過程中,VEGF-A能促進內皮細胞增殖,增加血管通透性,促進新血管形成,從而促進腫瘤細胞的侵襲及轉移。VEGF-A能夠通過其受體VEGFR-1和VEGFR-2促進腫瘤細胞增殖、轉移及淋巴管生成[12]。已有研究表明,VEGF-A在多種腫瘤發生發展過程中發揮重要作用,如腎癌[13]、肺癌[14]、食管癌。然而,目前為止,關于miRNA-29a、miRNA-29b、miRNA-29c與VEGF-A參與ESCC疾病發生發展的相關性研究尚未見報道。本實驗結果表明,在ESCC癌組織中VEGF-A呈現出高表達。同時我們也發現,miRNA-29a、miRNA-29b、miRNA-29c與VEGF-A的相對表達量之間存在負相關關系。我們進一步應用雙熒光素酶試驗證明了VEGF-A的3′非翻譯區能夠特異性與miRNA-29a、miRNA-29b、miRNA-29c結合,是其共同的靶基因。以上實驗結果表明,在ESCC疾病中miRNA-29a、miRNA-29b、miRNA-29c能夠與VEGF-A的3′非翻譯區進行特異性結合,從而共同調控同一靶基因VEGF-A的表達,參與調節多條涉及VEGF-A的信號調節途徑,最終影響ESCC的發生發展。
綜上所述,在ESCC癌組織中,同時存在低表達量的miRNA-29a、miRNA-29b、miRNA-29c和高表達量的VEGF-A,且它們之間存在負相關關系,VEGF-A是miRNA-29a、miRNA-29b、miRNA-29c共同的靶基因。本研究首次闡明了ESCC中miR-29a、miRNA-29b、miRNA-29c-VEGF-A分子調節機制,為ESCC的診斷和治療提供了新的思路和線索。
[1] 王海燕,王立東.遺傳因素對食管鱗狀細胞癌、賁門腺癌的影響[J].山東醫藥,2010,50(37):71-72.
[2] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005,55(2):74-108.
[3] Jiang H, Zhang G, Wu JH, et al. Diverse roles of miR-29 in cancer (review)[J]. Oncol Rep, 2014,31(4):1509-1516.
[4] Cortez MA, Nicoloso MS, Shimizu M, et al. miR-29b and miR-125a regulate podoplanin and suppress invasion in glioblastoma[J]. Gene Chromosome Canc, 2010,49(11):981-990.
[5] Ru P, Steele R, Newhall P, et al. miRNA-29b suppresses prostate cancer metastasis by regulating epithelial-mesenchymal transition signaling[J]. Mol Cancer Ther, 2012,11(5):1166-1173.
[6] Heinzelmann J, Henning B, Sanjmyatav J, et al. Specific miRNA signatures are associated with metastasis and poor prognosis in clear cell renal cell carcinoma[J]. World J Urol, 2011,29(3):367-373.
[7] Zhao JJ, Lin J, Lwin T, et al. microRNA expression profile and identification of miR-29 as a prognostic marker and pathogenetic factor by targeting CDK6 in mantle cell lymphoma[J]. Blood, 2010,115(13):2630-2639.
[8] Zeng X, Xiang J, Wu M, et al. Circulating miR-17, miR-20a, miR-29c, and miR-223 combined as non-invasive biomarkers in nasopharyngeal carcinoma[J]. PLoS One, 2012,7(10):e46367.
[9] Pass HI, Goparaju C, Ivanov S, et al. Hsa-miR-29c* is linked to the prognosis of malignant pleural mesothelioma[J]. Cancer Res, 2010,70(5):1916-1924.
[10] Fang C, Zhu DX, Dong HJ, et al. Serum microRNAs are promising novel biomarkers for diffuse large B cell lymphoma[J]. Ann Hematol, 2012,91(4):553-559.
[11] Costache MI, Ioana M, Iordache S, et al. VEGF expression in pancreatic cancer and other malignancies: a review of the literature[J]. Rom J Intern Med, 2015,53(3):199-208.
[12] Frezzetti D, Gallo M, Roma C, et al. Vascular endothelial growth factor a regulates the secretion of different angiogenic factors in lung cancer cells[J]. J Cell Physiol, 2016,231(7):1514-1521.
[13] Yang SM, Huang CY, Shiue HS, et al. Joint effect of urinary total arsenic level and vegf-a genetic polymorphisms on the recurrence of renal cell carcinoma[J]. PLoS One, 2015,10(12):e145410.
[14] Wei W, Wang Y, Yu X, et al. Expression of TP53, BCL-2, and VEGFA genes in esophagus carcinoma and its biological significance[J]. Med Sci Monit, 2015,21(1):3016-3022.
ExpressionchangesofmiRNA-29a/b/candVEGF-Ainesophagealsquamouscellcarcinomaandthecorrelationsbetweenthem
SONGLeilei1,XUGuangfeng,XIEHui,ZHANGNaijian,SHAOQixiang
(1SchoolofMedicine,JiangsuUniversity,Zhenjiang212013,China)
ObjectiveTo observe the expression changes of miRNA-29 family (miRNA-29a, miRNA-29b, and miRNA-29c) and vascular endothelial growth factor-A (VEGF-A) in the esophageal squamous cell carcinoma (ESCC) tissues and to investigate the relationships between them.MethodsThe expression levels of miRNA-29a/b/c and VEGF-A were detected by qRT-PCR and immunohistochemistry (IHC), respectively, in the ESCC tissues and para-carcinoma tissues. The relationship between the expression of miRNA-29a/b/c and VEGF-A was further analyzed. We used the bioinformatics method and dual luciferase reporter gene system experiment to predict and verify that miRNA-29a/b/c could co-regulate the same target gene VEGF-A.ResultsThe higher expression of VEGF-A and the lower expression of miRNA-29a/b/c were detected in the ESCC tissues as compared with that of the para-carcinoma tissues. There was a significant negative correlation between the expression levels of miRNA-29a/b/c and VEGF-A in ESCC tissues (miRNA-29a:r=-0.955, miRNA-29b:r=-0.950, miRNA-29c:r=-0.893; allP<0.01). Bioinformatics analysis showed that VEGF-A could specifically bind with miRNA-29a/b/c, which could be the common target gene of miRNA-29a/b/c. The dual luciferase reporter system validated that VEGF-A was a common target gene of miRNA-29a/b/c.ConclusionsThe miRNA-29a/b/c is low expressed, and VEGF-A is highly expressed in the ESCC tissues, and they are negatively correlated with each other. VEGF-A is a common target regulator gene of miRNA-29a/b/c.
esophageal squamous cell carcinoma; miRNA-29a; miRNA-29b; miRNA-29c; vascular endothelial growth factor-A
10.3969/j.issn.1002-266X.2017.45.001
R735.1
A
1002-266X(2017)45-0001-04
國家自然科學基金資助項目(81600689)。
宋雷雷(1984-),男,主管技師,主要從事食管癌分子機制的相關研究。E-mail:songleileiyouxiang@163.com
邵啟祥(1965-),男,教授,博士生導師,主要從事免疫調節與移植免疫的相關研究。E-mail:shao_qx@ujs.edu.cn
2017-04-20)

