含精氨酰-甘氨酰-天冬氨酰環兩親性肽自組裝凝膠與骨髓間充質干細胞相容性研究*
肖仁順,阮 宏,蔣星海,吳 凱,王曉梅,宋玉林
(南昌大學第二附屬醫院骨科,南昌 330006)
論著·基礎研究
含精氨酰-甘氨酰-天冬氨酰環兩親性肽自組裝凝膠與骨髓間充質干細胞相容性研究*
肖仁順,阮 宏,蔣星海,吳 凱,王曉梅,宋玉林△
(南昌大學第二附屬醫院骨科,南昌 330006)
目的分析骨髓間充質干細胞(BMSCs)與兩親性肽三維凝膠的相容性。方法取3周齡SD健康大鼠3只,分離股骨、脛骨獲取BMSCs,采用流式細胞術檢測BMSCs表面抗原;將10 mg/mL含精氨酰-甘氨酰-天冬氨酰(RGD)環兩親性肽溶液加入等體積 DMEM/F12培養基數秒后自組裝成三維凝膠,透射電鏡顯微鏡(TEM)下觀察三維凝膠結構;1×106cells/mL BMSCs懸液與RGD環兩性親肽混合形成三維培養體系,1×106cells/mL BMSCs懸液與多聚賴氨酸混合形成二維培養體系,無血清培養;CCK-8法觀察細胞生長情況,鈣黃綠素乙酰氧基甲酯/碘化丙啶(PI)雙標染色,熒光顯微鏡觀察RGD環兩性親肽對BMSCs增殖的影響。結果分離培養的細胞高表達CD29、CD90,不表達或低表達CD34、CD45;TEM顯示凝膠由多空納米纖維構成,納米纖維直徑2~5 nm,長度100~1 000 nm;質譜測得合成多肽相對分子質量為1 256.37,與理論值一致;高效液相色譜分析兩性親肽純度為95.88%;鈣黃綠素乙酰氧基甲酯/PI雙標染色顯示,三維培養體系中,30 min后少數BMSCs出現死亡,12 h后細胞開始增殖,增殖較二維培養活躍,差異有統計學意義(P<0.05);CCK-8細胞計數顯示,三維培養體系細胞增殖活力高于二維培養體系,差異有統計學意義(P<0.05)。結論RGD兩性親肽與BMSCs有良好的生物相容性,可能成為組織工程支架材料。
精氨酰-甘氨酰-天冬氨酰;間質干細胞;兩親性肽;細胞相容性
材料的生物相容性和細胞親和性可以通過固定的某些生物活性分子在聚合物或生物材料表面改進,為種子細胞黏附、增殖、擴展和分化提供良好的界面,促進細胞外基質的生產,是構建組織工程產品的重要措施。組織工程的快速發展,給神經組織修復和再生帶來新的希望。組織工程的三要素為支架材料、種子細胞和細胞因子,其中神經支架材料用以恢復神經的三維結構,利于細胞的黏附、生長、分化、增殖,并提供足夠大的表面積和容積,從而達到對神經細胞的支持、營養作用,最終有利于血管的生成。支架最佳生長模型具有很高的生物相容性和生物降解性,易于細胞附著、生長,以及及時地攝入營養和排出廢物[1]。自組裝肽納米纖維支架高度模擬細胞外基質并支撐細胞生長,同時具有良好的生物相容性,已成為神經組織工程材料的首要選擇[2]。骨髓間充質干細胞(bone mesenchymal stem cells,BMSCs)具有多向分化的潛能、低免疫原性等優點,成為神經組織工程理想的種子細胞[3]。本實驗通過設計與合成精氨酰-甘氨酰-天冬氨酰(Arg-Gly-Asp,RGD)環兩性親肽,自組裝形成多孔三維兩性親肽凝膠支架,研究SD大鼠BMSCs與含RGD環兩性親肽的相容性。
1 材料與方法
1.1材料
1.1.1實驗動物 健康3周齡SD大鼠3只,由南昌大學醫學院動物中心提供。
1.1.2主要儀器與試劑 RGD環兩性親肽結構分子式為C16H31OA3G4D2RGD,委托上海波肽公司合成,用高效液相色譜儀和質譜儀進行純化和分析,相對分子質量為1 256.37,純度為95.88%。DMEM/F12培養基(美國Gibco公司),堿性成纖維細胞生長因子(bFGF)、表皮生長因子(EGF)、B27(美國Gibco-BRL公司),碘化丙啶(PI),鈣黃綠素乙酰氧基甲酯(美國Invitrogen 公司),CCK-8細胞計數試劑盒(日本DOjindo公司)。0.1 mol/L氫氧化鈉(NaOH)、0.1 mol/L鹽酸(HCl,國藥集團化學試劑有限公司),兔抗大鼠CD29、CD45、CD90多克隆抗體(英國Abcam公司)。倒置相差顯微鏡、熒光倒置顯微鏡(日本Olymous公司),JEM-1230型透射電子顯微鏡(日本JEOL公司),流式細胞儀(美國BD公司),細胞培養孵培養箱、多功能酶標儀(美國Thermo公司)。
1.2方法
1.2.1BMSCs分離獲取 腹腔注射麻醉后脊髓脫臼處死大鼠,放入75%乙醇浸泡30 min,無菌環境下去除股骨、脛骨上的肌肉組織,取出股骨及脛骨,用磷酸鹽緩沖液(PBS)沖洗2次,剪刀剪去股骨及脛骨兩端骨骺,用5 mL注射器吸入含20 μg/L bFGF、20 μg/L EGF、 2% B27的無血清DMEM/F12培養基沖洗骨髓腔,直到骨髓腔變白,將沖洗液移入25 cm2細胞培養瓶中,置于37 ℃、5%二氧化氮(CO2)細胞培養箱中培養。48 h后僅將瓶子中培養液倒出更換新鮮培養液,不用PBS清洗瓶底。之后每隔2天更換新鮮培養液,待細胞鋪滿培養瓶底90%以上,加入胰蛋白酶消化,傳代培養,細胞第3代進行細胞流式分析。
1.2.2BMSCs表面抗原流式鑒定 取培養至第3代的BMSCs,用0.25%胰蛋白酶消化后加入等體積含胎牛血清培養基終止消化,1 000 r/min離心5 min后去除培養基。加入少量PBS 后用移液管均勻吹打,將細胞水平調整至 1×109cells/L。取1 mL 1×109cells/L細胞懸液分別移入4支流式管中,PBS清洗細胞懸浮液2遍,再加入緩沖液重懸。每管分別加入藻紅蛋白(PE)標記的單克隆抗體5 μL,同型非特異性IgG-PE為陰性對照,避光室溫反應30 min。流式細胞儀上檢測。
1.2.3RGD環兩性親肽自組裝制備 取10 mg RGD環兩性親肽放入2 mL小管,加入0.1 mol/L NaOH溶液400 μL充分振蕩混勻溶解,加入400 μL無菌雙蒸水,再以每次滴加0.1 mol/L HCl 10 μL的方式緩慢調節多肽溶液至pH 8,繼續滴入無菌雙蒸水至體積為1 ml,此時多肽濃度為10 mg/mL,多肽溶液呈黏稠狀態。取200 μL黏稠狀多肽溶液滴入等體積含鈣離子(Ca2+)等二價陽離子無酚紅的DMEM/F12自組裝成凝膠。取10 μL兩性親肽凝膠滴入金屬網格中,脫水,晾干,磷鎢酸染色,進行透射電鏡顯微鏡(TEM)觀察。
1.2.4RGD環兩性親肽凝膠與BMSCs的復合性培養 將蓋玻片放入24孔板內,取10 mg/mL RGD兩性親肽溶液200 μL滴加到蓋玻片,包被蓋玻片,將培養至第3代密度為 1×106cells/mL的BMSCs等體積接種于RGD環兩性親肽包被的蓋玻片上,數秒后形成三維凝膠細胞體系;凝膠內部pH值為7.35,將凝膠細胞培養體系置于37 ℃ 5% CO2孵箱中無血清培養,取200 μL密度為1×106cells/mL的BMSCs懸液滴在多聚賴氨酸包被的蓋玻片上,37 ℃ 5% CO2孵箱中無血清培養(二維培養體系)。培養6、12、24 h的蓋玻片以PBS清洗3次,在蓋玻片上滴入配好的終濃度為2 μmol/L的鈣黃綠素乙酰氧基甲酯,終濃度為4 μmol/L的PI,37 ℃孵育15 min,熒光顯微鏡下觀察黃綠色的活細胞,紅色的死細胞。
1.2.5RGD環肽對BMSCs增殖/毒性的作用 取96孔板,將1×105cells/mL BMSCs懸液100 μL接種于96孔板中,10 mg/mL環肽溶液100 μL加入40孔(三維細胞培養體系),每組8孔;10 mg/mL環肽溶液100 μL加入余下的40孔(二維細胞培養體系),每組8孔,每天分別向三維細胞培養體系1組8孔和二維細胞培養體系1組8孔中加入10 μL CCK-8試劑,避光置于37 ℃、5% CO2孵箱2 h,調整到460 nm上機測量吸光度值(A值),連續測量5 d。計算每天每組A值的平均數,以時間為橫軸,A值為縱軸繪制BMSCs的生長曲線。

2 結 果
2.1倒置顯微鏡觀察原代BMSCs形態及生長情況 沖洗骨髓腔出來的細胞,在第2、3天BMSCs開始貼壁,細胞兩端成梭形,細胞核成卵圓形,細胞生長呈克隆式,細胞呈大小不一放射狀的集落,開始生長較慢,2周左右細胞鋪滿培養瓶90%以上,細胞呈漩渦式、魚狀排列,胰酶消化后細胞貼壁均勻生長,形態為長梭形,傳代后3 d左右細胞鋪滿培養瓶,見圖1。

A:原代第6天BMSCs;B:第2代BMSCs;C:第3代BMSCs
圖1 BMSCs原代及傳代培養的細胞(×100)
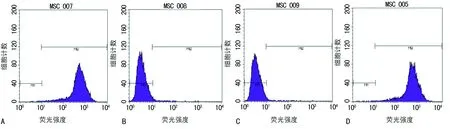
A:CD29;B:CD34;C:CD45;D:CD90
圖2 BMSCs流式細胞檢測
2.2BMSCs流式細胞鑒定 選取第3代BMSCs與CD29、CD34、CD45、CD90抗體結合后上機檢測,結果顯示BMSCs高表達CD29(陽性率為99.88%)、CD90(陽性率為99.88%),不表達或低表達CD34(陽性率為1.64%)、CD45(陽性率為1.59%),證明所培養的細胞為BMSCs,見圖2。
2.3兩性親肽RGD環肽自組裝成凝膠納米支架 10 mg RGD環兩性親肽溶于400 μL 0.1 mol/L NAOH,加入400 μL雙蒸水,用0.1 mol/L HCl調節至pH 8,繼續加入雙蒸水至1 mL,此時肽溶液為黏稠狀態,加入等體積的無酚紅DEME/F12,數秒后成凝膠狀態,TEM觀察凝膠由納米纖維構成,納米纖維直徑 2~5 nm,長度 100~1 000 nm,納米纖維相互交織成三維網絡結構,見圖3。

A:2 mL小管瓶口倒置,凝膠緊貼瓶底,凝膠有較強的黏附力;B:TEM下觀察凝膠由納米纖維交叉編織,納米纖維之間存在間隙
圖3兩性親肽RGD環肽自組裝成凝膠納米支架
2.4RGD環兩性親肽的檢測結果 質譜結果顯示,RGD環兩性親肽相對分子質量為1256.0,與目標肽相對分子質量的理論設計一致(圖4A);高效液相色譜分析顯示,合成的RGD環兩性親肽純度為95.88%(圖4B、C),表明合成的RGD環兩性親肽是本研究的目標肽。
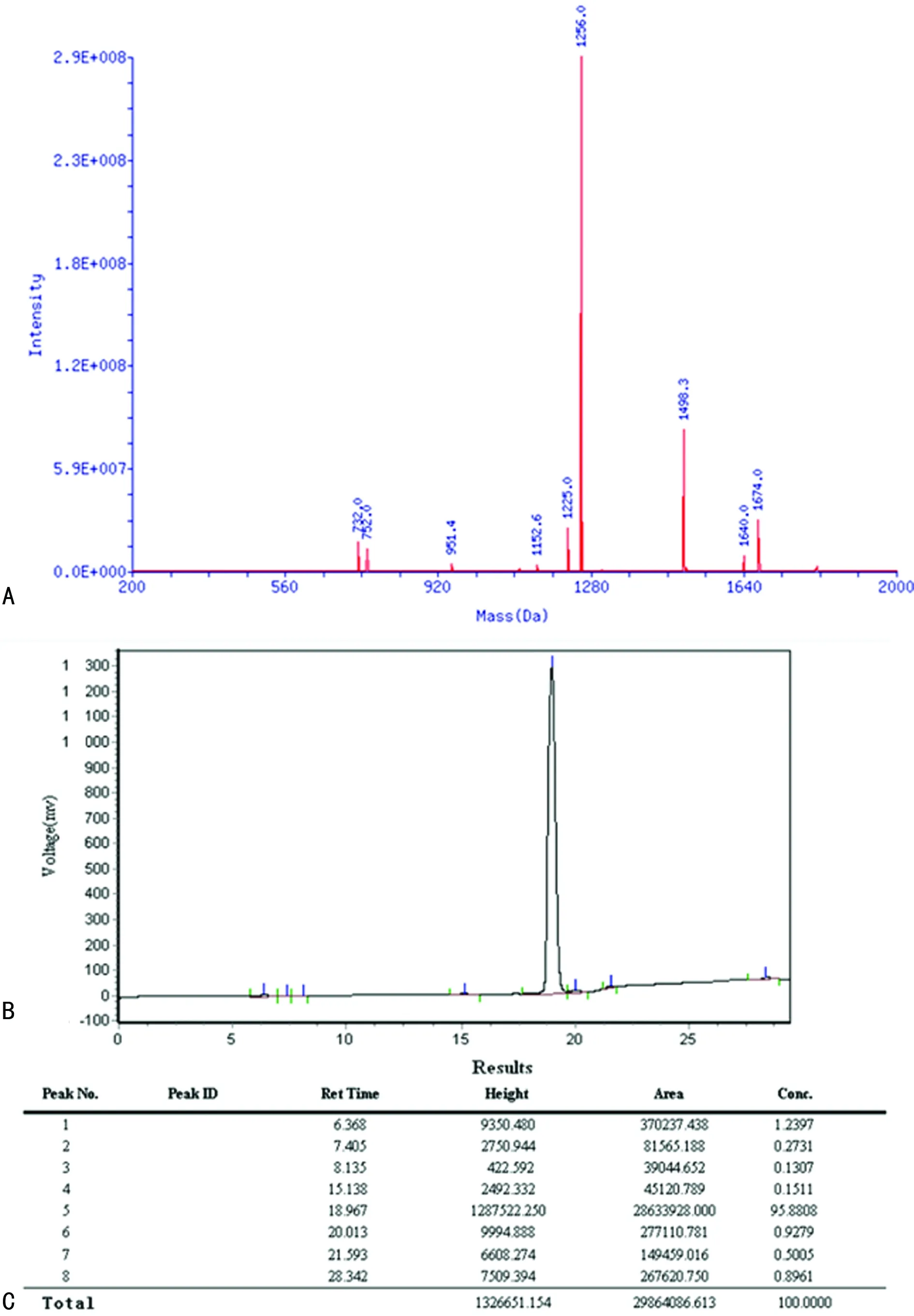
A:質譜檢測合成目標肽相對分子質量為1256.0;B、C:高效液相色譜檢測合成目標肽的純度為95.88%,已達到目標肽濃度
圖4 RGD環兩性親肽的檢測結果
2.5RGD環兩性親肽納米凝膠與BMSCs復合性培養結果 細胞分別在二維培養體系與三維細胞培養體系中培養6、12、24 h后分別進行鈣黃綠素乙酰氧基甲酯和PI染色,細胞點計數活細胞與死細胞,隨著細胞培養時間增加三維細胞培養體系活細胞數明顯比二維細胞培養體系中多,差異有統計學意義(P<0.05),三維細胞培養體系中6、12、24 h活細胞數,見圖5A、B、C;二維細胞培養體系中6、12、24 h活細胞數,見圖5D、E、F;三維細胞培養體系死細胞(圖6A、B、C)與二維細胞培養體系死細胞(圖6D、E、F)未見增多。
2.6CCK-8測量兩性肽對BMSCs增殖的影響 BMSCs在三維細胞培養體系中增殖曲線與在二維細胞培養體系中增殖曲線見圖7,在三維細胞培養體系中BMSCs增殖速度比在二維細胞培養體系中BMSCs增殖速度快,差異有統計學意義(P<0.05)。
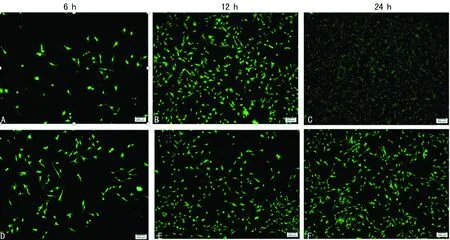
A、B、C:三維細胞培養體系; D、E、F:二維細胞培養體系
圖5三維與二維細胞培養體系活細胞
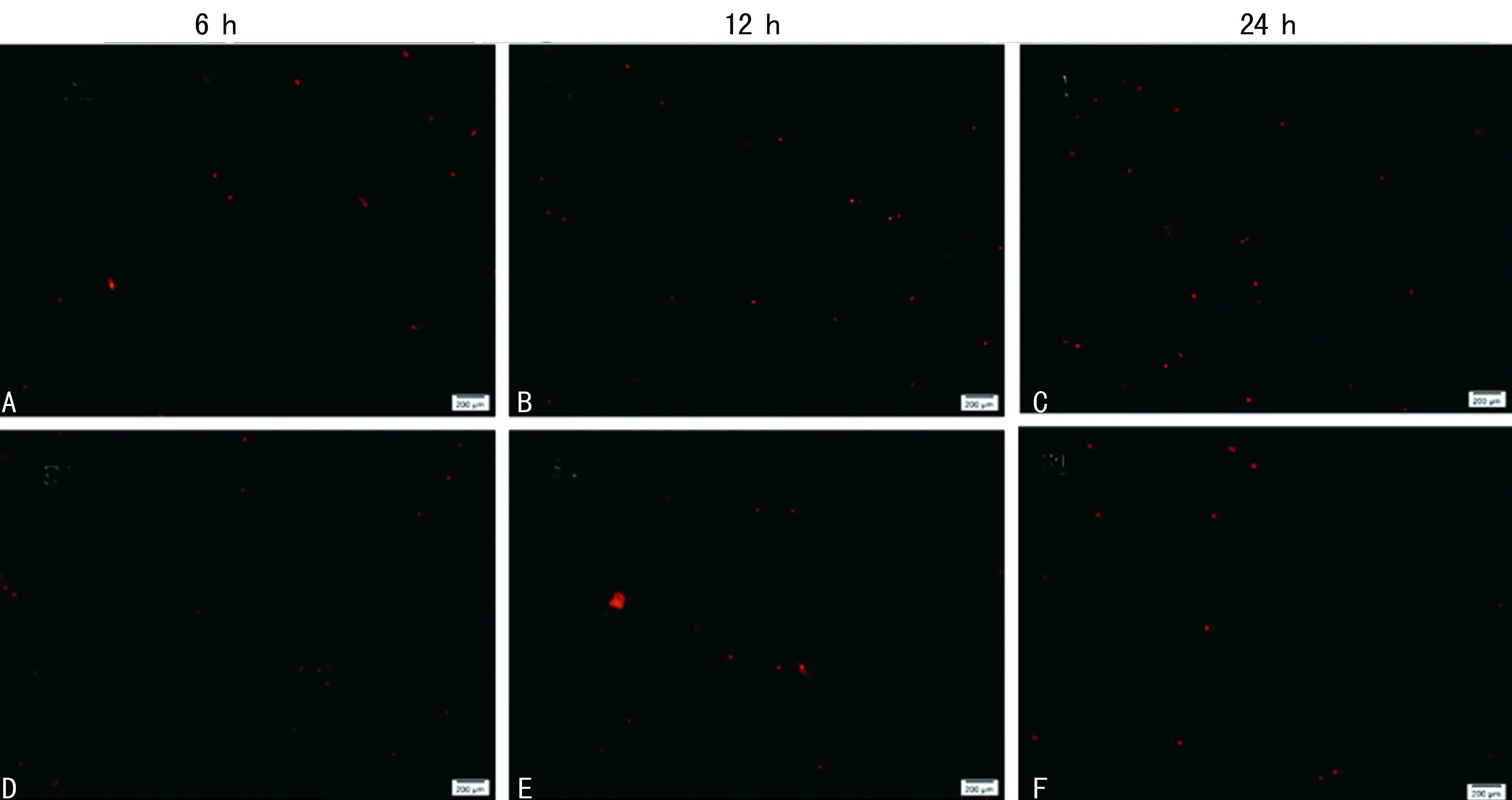
A、B、C:三維細胞培養體系; D、E、F:二維細胞培養體系
圖6三維與二維細胞培養體系死細胞

圖7 兩性肽對BMSCs增殖的影響
3 討 論
脊髓損傷主要為機械直接對脊髓造成的傷害,通常導致完全或不完全的神經功能喪失,如運動功能和感覺功能喪失[4]。脊髓損傷給患者帶來心理和生理傷害,造成家庭巨大的經濟負擔,因此,迫切需要尋求一種有效的治療脊髓損傷的方法。目前,神經組織工程是治療脊髓損傷的有效方法。
生物材料包括有機材料、無機材料、金屬材料三大類。由于無機材料及金屬材料具有硬度大、韌性低、彈性差、可塑性差等特點,不適合用于神經組織工程;有機高分子材料具有在體內不易降解,或降解產物不能被機體利用且難以清除,以及其生物相容性差等缺點,也不宜作為神經組織工程的支架材料。利用兩親性肽自組裝構建神經組織工程支架是較好的方法,其基本原理:肽分子在酸或細胞培養液(含鈣、鎂或氫等離子)作用下,通過分子內非共價鍵(氫鍵、疏水鍵、范德華力)等,自組裝為三維多孔納米纖維凝膠,形成納米纖維直徑較小,凝膠黏彈性可調控到與脊髓黏彈性一致,生物相容性好,降解產物為氨基酸可被細胞利用。這種肽在細胞培養液促發下可自組裝為納米纖維凝膠,反應溫和,條件簡單,與其他材料相比具有明顯優勢,是構建神經組織工程較好的基質支架材料。
目前許多研究者通過改變氨基酸序列,設計出具有特定功能的肽鏈[5],可模擬培養細胞所需要的生存環境,通過改變肽鏈的長短序列及帶電性質,在pH 7.35~7.45發生自組裝成多肽納米凝膠結構,此納米凝膠與細胞外基質相類似。由于多肽凝膠含水量較高且存在著間隙,為營養物質及細胞排泄物的運送提供了通道。多肽由天然的氨基酸合成,在體內不會進行排斥反應和炎性反應,凝膠在體內酶的作用下降解,給細胞提供生存養料。RGD環肽序列為C16H31OA3G4D2RGD,環肽具有的特性為:(1)C16H31O序列提高對酸的敏感度,同時烷基尾可以調節納米纖維之間的間隙[6-7];(2)A3G4(AAAGGGG)與C16H31O烷基尾有協同作用[8],同時能讓活性RGD環表位暴露出來;(3)D2(DD)具有調節帶電離子作用,當RGD環肽在自組裝成凝膠時,凝膠的pH范圍在7.35~7.45之間,正好適合細胞生長、增殖、分化[8];(4)RGD序列能促進細胞對凝膠的黏附、生長及分化[1]。
本研究通過用高效液相色譜儀和質譜儀進行純化和分析,結果證明所合成的RGD環肽為所需的目的肽。用0.1 mol/L NaOH溶液、0.1 mol/L HCl溶液及無菌雙蒸水將多肽調整濃度為10 mg/mL,此時的多肽溶液呈黏稠狀態,加入等體積含Ca2+等二價陽離子無酚紅的DMEM/F12,數秒鐘后多肽成凝膠狀態,小管瓶口倒置,凝膠緊貼瓶底,有較強的黏附力,經電子顯微鏡觀察凝膠發現凝膠由直徑2~5 nm,長度100~1 000 nm的納米纖維構成,納米纖維相互交織成三維網絡結構。此類似凝膠含水量95.0%,對細胞有良好的骨架支持作用;營養物質、氧氣及細胞所需要的活性因子可通過凝膠間隙到達細胞內,細胞內排泄物可通過間隙排出凝膠外。本實驗采用全骨髓細胞差異貼壁法獲取大鼠骨髓間充質干細胞[9],通過細胞形態學觀察,流式細胞儀檢測細胞表面抗原,培養2周后的細胞呈漩渦式、魚狀排列,細胞表面CD29、CD90高表達,而CD34、CD45不表達,驗證所取的細胞為骨髓間充質干細胞。
BMSCs有許多優點,包括來源豐富、高活性、低免疫原性、分化潛能和分泌養分,在移植研究中已得到廣泛的應用[10]。BMSCs可以分泌多種趨化因子、免疫調節因子和生長因子,這些因子可以進一步聚集其他細胞(包括炎性細胞),調節免疫應答,參與組織修復,影響病理進展[11]。因此,BMSCs為組織工程修復神經損傷較理想的種子細胞。
RGD環兩性親肽納米凝膠與BMSCs混合形成三維細胞培養體系,凝膠的三維結構具有良好的骨架結構,為細胞的生長提供支持作用;同時RGD環活性表位促進細胞對凝膠的黏附、生長及分化。本研究CCK-8結果顯示,在三維細胞培養體系中BMSCs增殖速度比在二維細胞培養體系中快。由鈣黃綠素乙酰氧基甲酯和PI構成的DEAD/LIVE試劑可通過熒光顯微鏡顯色,觀察細胞在二維及三維細胞培養體系的活力和增殖情況,活細胞染成綠色,死細胞染成紅色[12]。本研究結果顯示,隨著培養時間的增加,三維細胞培養體系中的活細胞數較二維細胞培養體系中多。
綜上所述,RGD環肽與BMSCs具有很好的細胞相容性,可為以后在仿生材料涉及的神經組織工程中進行轉基因改造奠定基礎。
[1]Breymann C,Schmidt D,Hoerstrup SP.Umbilical cord cells as a source of cardiovascular tissue engineering[J].Stem Cell Rev,2006,2(2):87-92.
[2]元亮亮,梁鵬.自組裝多肽納米纖維支架的結構特點及應用優勢[J].中國組織工程研究,2013,17(29):5379-5386.
[3]陳睿,宋玉林,汪文玉,等.大鼠骨髓間充質干細胞與樹枝狀兩親性多肽自組裝凝膠支架的生物相容性[J].西安交通大學學報(醫學版),2016,37(6):803-809.
[4]Yip PK,Malaspina A.Spinal cord trauma and the molecular point of no return[J].Mol Neurodegener,2012,7:6.
[5]Ruan L,Zhang H,Luo H,et al.Designed amphiphilic peptide forms stable nanoweb,slowly releases encapsulated hydrophobic drug,and accelerates animal hemostasis[J].Proc Natl Acad Sci U S A,2009,106(13):5105-5110.
[6]Sargeant TD,Guler MO,Oppenheimer SM,et al.Hybrid bone implants:self-assembly of peptide amphiphilic nanofibers within porous titanium[J].Biomaterials,2008,29(2):161-171.
[7]Hartgerink JD,Beniash E,Stupp SI.Self-assembly and mineralization of peptide-amphiphile nanofibers[J].Science,2001,294(5547):1684-1688.
[8]宋玉林,鄭啟新,鄭劍鋒,等.兩親性肽自組裝凝膠與神經干細胞相容性研究[J].組織工程與重建外科雜志,2008,4(4):192-195.
[9]李雙月,戚媛,陳若琳,等.全骨髓貼壁法分離培養大鼠骨髓間充質干細胞的生物學特性及優勢[J].中國組織工程研究,2014,18(10):1484-1489.
[10]Hu J,Deng G,Tian Y,et al.An in vitro investigation into the role of bone marrowderived mesenchymal stem cells in the control of disc degeneration[J].Mol Med Rep,2015,12(4):5701-5708.
[11]Han X,Yang Q,Lin L,et al.Interleukin-17 enhances immunosuppression by mesenchymal stem cells[J].Cell Death Differ,2014,21(11):1758-1768.
[12]桑江瑋,王素雅,張杰,等.豬小腸黏膜下層細胞外基質促進肝細胞活力和功能基因表達的研究[J].中國修復重建外科雜志,2017,31(5):607-613.
Studyoncompatibilityofself-assembledgelcontainingRGDamphipathicpeptidewithbonemarrowmesenchymalstemcells*
XiaoRenshun,RuanHong,JiangXinghai,WuKai,WangXiaomei,SongYulin△
(DepartmentofOrthopedics,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
ObjectiveTo analyze the compatibility of bone marrow mesenchymal stem cells (BMSCs) with amphiphilic peptide three-dimensional gel.MethodsThree healthy 3-week-old SD rats were taken for separating femur and tibia to obtain BMSCs,the BMSCs surface antigen was detected by flow cytometry;the 10 mg/mL RGD-cyclic amphiphilic peptide solution was added into the same volume of DMEM/F12 culture medium,after a few seconds,which was self assemble into three-dimensional gel.Three dimensional gel structure was observed by transmission electron microscope (TEM).1×106cells/mL BMSCs suspension and RGD-cyclic amphiphilic peptide were mixed to form a 3D culture system,1×106cells/mL BMSCs suspension was mixed with polylysine to form a 2D culture system,the serum-free culture was conducted;the CCK-8 method was used to observe the cell growth situation,calcein acetoxy methyl ester/propidium iodide (PI) double standard staining was performed.The effect of RGD-cyclic amphiphilic peptide on the proliferation of BMSCs was observed by fluorescence microscopy.ResultsThe separated and cultured BMSCs highly expressed CD29 and CD90,but lowly expressed or did not express CD34 and CD45;TEM showed that the gel was composed of multiple empty nanofibers with the nanofiber diameter of 2-5 nm and length of 100-1 000 nm;the molecular weight of synthetic peptides detected by mass spectrometry (MS) was 1 256.37,which was consistent with the theoretical value;the HPLC analysis showed that RGD-amphiphilic peptide purity was 95.88%;the calcein acetoxyl methyl ester/PI double staining showed that in the 3D culture system,a few BMSCs died after 30 min and the cells began to proliferate after 12 h,the proliferation was more active than that of 2D culture,and the difference was statistically significant (P<0.05);CCK-8 cell count showed that the proliferation activity of 3D culture system was higher than that of 2D culture system,and the difference was statistically significant (P<0.05).ConclusionRGD amphiphilic peptide has a good biocompatibility with BMSCs,and may become the tissue engineering scaffold material.
Arg-Gly-Asp;mesenchymal stem cells;amphiphilic peptide;cytocompatibility
10.3969/j.issn.1671-8348.2017.35.005
國家自然科學基金資助項目(81360271,30801158);江西省教育廳課題(GJJ14054);江西省自然科學基金計劃項目(20151BAB205051);南昌大學研究生創新專項基金(CX2016326)。
肖仁順(1991-),住院醫師,碩士,主要從事脊髓損傷、兩性肽組織模塊方面的研究。△
,E-mail:songyulin2001@163.com。
R318
A
1671-8348(2017)35-4912-05
2017-07-12
2017-09-15)

