過敏性紫癜患者中性粒細胞及其IgA Fc受體對血管內皮細胞凋亡的影響及機制
陳靜思 孫晨 陽海平 甘立強 譚春花 王華 羅曉燕
400014重慶醫科大學附屬兒童醫院皮膚科(陳靜思、甘立強、譚春花、王華、羅曉燕),兒童發育疾病研究教育部重點實驗室 兒科學重慶市重點實驗室(孫晨),兒童發育重大疾病國家國際科技合作基地(陽海平)
·論著·
過敏性紫癜患者中性粒細胞及其IgA Fc受體對血管內皮細胞凋亡的影響及機制
陳靜思 孫晨 陽海平 甘立強 譚春花 王華 羅曉燕
400014重慶醫科大學附屬兒童醫院皮膚科(陳靜思、甘立強、譚春花、王華、羅曉燕),兒童發育疾病研究教育部重點實驗室 兒科學重慶市重點實驗室(孫晨),兒童發育重大疾病國家國際科技合作基地(陽海平)
目的研究中性粒細胞及其IgA Fc受體(CD89)在過敏性紫癜(HSP)發病中的作用和對血管內皮細胞的損傷效應及調控機制。方法入組30例急性期HSP患兒及9例健康對照兒童,分離外周血中性粒細胞;Jacalin親和層析分離HSP患者血清IgA后,采用聚丙烯葡聚糖凝膠純化IgA。實時定量PCR(qPCR)、Western印跡分別檢測中性粒細胞CD89 mRNA和蛋白表達,流式細胞儀分析中性粒細胞活化標志分子CD11b的表達。分別將HSP患兒中性粒細胞、健康對照中性粒細胞與血管內皮細胞HUVEC共培養,以HSP患兒血清分離的IgA(HSP IgA)、單體IgA(mIgA)、磷酸鹽緩沖液(空白對照組)分別處理,流式細胞儀檢測HUVEC細胞凋亡,ELISA檢測上清液中白細胞介素8(IL?8)、腫瘤壞死因子α(TNF?α)水平。結果HSP患兒組中性粒細胞CD89 mRNA表達與健康對照組差異無統計學意義(P=0.98),但蛋白表達(0.60±0.16)低于健康對照組(0.83±0.24,P=0.03)。HSP患者中性粒細胞CD11b表達(1 880.25±388.29)顯著高于健康對照組(1 109.25±364.25,P<0.01)。與HSP患者中性粒細胞共培養組HUVEC凋亡率(37.44%±5.49%)高于與健康對照中性粒細胞共培養組(17.14%±4.45%,P<0.01)。HSP IgA處理組HUVEC凋亡率明顯高于mIgA處理組(均P<0.01)和空白對照組(P<0.01),且上清液中IL?8、TNF?α濃度明顯高于mIgA處理組(均P<0.01)和空白對照組(P值分別為0.01、0.02)。結論HSP患者外周血中性粒細胞活化,并可誘導血管內皮細胞凋亡。而且HSP IgA能促進中性粒細胞介導的血管內皮細胞凋亡和炎癥因子IL?8、TNF?α分泌,而mIgA則可能具有一定抑制效應。
紫癜,過敏性;免疫球蛋白A;受體,Fc;中性白細胞;人臍靜脈內皮細胞;凋亡;白細胞介素8;腫瘤壞死因子α
過敏性紫癜(Henoch Sch?nlein purpura,HSP)在組織病理上是一種累及小血管、以中性粒細胞浸潤為主的白細胞碎裂性血管炎,其發病機制尚不完全清楚。有研究表明,氧化應激、脂質過氧化、中性粒細胞激活在發病中起重要作用[1]。中性粒細胞激活后可誘發氧化應激反應,釋放髓過氧化物酶(myeloperoxidase,MPO),產 生 活 性 氧 自 由 基(reactive oxygen species,ROS)等,參與對小血管的損傷[2]。中性粒細胞表面表達多種免疫識別受體,包括Toll樣受體、補體受體、IgG Fc受體(FcγR)、IgA Fc受體(FcαR I/CD89)等,其中 IgA Fc受體(FcαR I/CD89)能通過2個胞外結合域與IgA的Fc段發生特異性高親和力結合。IgA與Fc受體結合后吸引循環中抗IgA自身抗體(包括IgG與IgA)是循環免疫復合物形成的基礎,并可激發吞噬、抗體依賴的細胞介導的細胞毒性作用(ADCC)等[3]。目前中性粒細胞在HSP發病中的具體作用及機制仍不清楚。本研究擬觀察急性HSP患兒外周血中性粒細胞活化及其IgA Fc受體CD89表達水平,構建HSP患者中性粒細胞與血管內皮細胞即人臍靜脈內皮細胞(HUVEC)共培養模型,評估IgA及Fc受體對共培養HUVEC細胞凋亡的影響,以闡明中性粒細胞參與HSP發病及其損傷血管內皮細胞的機制。
對象與方法
1.病例收集:2014年2月至2015年6月重慶醫科大學附屬兒童醫院皮膚科門診就診的初發急性期HSP患兒30例,其中男19例,女11例,年齡(7.42±2.22)歲,均符合2006年歐洲風濕聯合會(EULAR)HSP診斷標準[4]。9例健康體檢兒童作為對照,其中男4例,女5例,年齡(8.46±2.36)歲,兩組性別構成及年齡差異均無統計學意義(P>0.05)。30例HSP患兒各取外周血3~5 ml,采用Percoll密度梯度離心法分離,每例約收獲4×106~1×107中性粒細胞,其純度>90%,臺盼藍染色示細胞活力>92%。其中,8例用于分離中性粒細胞檢測CD11b及CD89表達,5例用于分離中性粒細胞與HUVEC共培養檢測HUVEC凋亡,12例分離血清提取IgA,5例與HUVEC共培養并用不同類型IgA處理。健康對照組中,8例外周血分離中性粒細胞檢測CD11b及CD89表達,5例分離的中性粒細胞與HUVEC共培養。本研究通過重慶醫科大學倫理委員會批準,所有研究對象均簽署知情同意書。
2.材料:Nycoprep分離液(挪威Axis?shield公司),Jacalin親和層析柱(美國Thermo公司),人單體IgA(mIgA,美國Abcam公司),胎牛血清(美國Gibco公司),HUVEC細胞株、異硫氰酸熒光素/碘化丙錠標記的膜聯蛋白V(Annexin V?FITC/PI)、細胞凋亡檢測試劑盒(南京凱基公司),反轉錄試劑盒、熒光實時定量試劑盒(日本TakaRa公司),蛋白提取試劑盒、鼠抗人β肌動蛋白單克隆抗體(美國Santa Cruz公司),鼠抗人CD11b單克隆抗體(美國BD公司),鼠抗人CD89單克隆抗體(美國AbD Serotec公司),FITC-羊抗鼠IgG二抗(美國Abcam公司),辣根過氧化物酶(HRP)-羊抗鼠IgG二抗(北京中山金橋公司),人白細胞介素8(IL-8)、腫瘤壞死因子α(TNF-α)ELISA試劑盒(美國R&D公司)。實時定量PCR儀(美國Bio?Rad公司),Western印跡凝膠成像儀(日本Fujifilm公司),BD FACS CantoⅡ流式分析儀(美國BD公司)。
3.實時定量PCR(qPCR)檢測中性粒細胞CD89 mRNA表達:提取外周血中性粒細胞總RNA,反轉錄成 cDNA,行 qPCR,反應體積 20 μl,反應條件:95℃ 2 min,94 ℃ 1 min,60℃ 1 min,72℃ 2 min,共30個循環。CD89:正向引物5′?GAGCACAGTCAGT AGACTTC?3′,反向引物5′?GATTCCGAGCGTGAGT CCA?3′;內參照β肌動蛋白:正向引物5′?TGGCACC CAGCACAATGAA?3′,反向引物5′?TGGAAGGTGGA CAGCGAGGC?3′。結果采用2?ΔΔCt表示,每個樣本重復3次取平均值。
4.Western印跡檢測中性粒細胞CD89蛋白表達:提取外周血中性粒細胞蛋白,BCA法測定蛋白濃度,十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS?PAGE),轉膜并加入抗體反應,顯影、定影,用凝膠圖像處理系統分析目標條帶的分子量和靜吸光度。以CD89蛋白與β肌動蛋白的比值表示蛋白相對表達水平。
5.流式細胞儀檢測中性粒細胞活化標志CD11b:分離外周血中性粒細胞,鼠抗人CD11b單克隆流式抗體染色后上機檢測,藻紅蛋白標記的鼠IgG1為陰性對照,每個樣本設1個復孔,以平均熒光強度(MFI)表示CD11b表達量。
6.HSP患兒血清IgA(HSP IgA)提取和純化[5]:采用Jacalin親和層析柱法分離患者血清IgA,將洗脫液過聚丙烯葡聚糖凝膠Sephacryl 200層析柱,并收集第1峰洗脫液,BCA法測定濃度后備用。
7.中性粒細胞與血管內皮細胞共培養模型的構建及分組:取HUVEC鋪6孔板(1.7×106細胞/孔),分別加入5例HSP患兒或5例健康對照外周血分離的中性粒細胞(5×105/孔),每個樣本設1個復孔,于37℃孵箱共培養24 h后流式檢測HUVEC凋亡率。再分別取5例HSP患兒、5例健康對照外周血中性粒細胞與HUVEC同上建立共培養模型,分為3組,每個樣本設復孔,①空白對照組:向共培養體系中加入等體積PBS;②mIgA組:加入最適濃度mIgA;③HSP IgA組:加入最適濃度HSP IgA。IgA最適濃度確定:配制20、30、40、50 mg/L mIgA以及25、50、100、200 mg/L HSP IgA,分別加入共培養模型干預24 h,流式細胞儀檢測HUVEC凋亡,經5次預實驗確定mIgA最適濃度為40 mg/L,此時HUVEC早期凋亡率最低,HSP IgA最適濃度為100 mg/L,此時HUVEC早期凋亡率最高。
8.HUVEC凋亡檢測:采用流式細胞儀分析。收集共培養的HUVEC和HSP中性粒細胞,以中性粒細胞CD11b為標記,采用陰選圈定HUVEC,Annexin V?FITC/PI Q4象限(Annexin V?FITC陽性,PI陰性)代表早期凋亡細胞。
9.ELISA法檢測共培養模型上清液中IL?8、TNF?α水平:按試劑盒說明書進行。
10.統計學處理:Flowjo軟件分析流式細胞儀檢測數據,采用SPSS17.0軟件進行統計分析,符合正態分布的計量資料以±s表示。計量資料兩組間比較采用t檢驗,3組及以上組間比較用單因素方差分析,兩兩比較采用最小顯著性差異(LSD)法。計數資料比較采用卡方檢驗。P<0.05為差異有統計學意義。
結 果
1.CD89 mRNA及蛋白表達:急性HSP患兒外周血中性粒細胞CD89 mRNA表達與健康對照組比較差異無統計學意義(P=0.98),而CD89蛋白表達顯著低于健康對照組(P=0.03),見圖1、表1。
2.CD11b表達:HSP患兒中性粒細胞CD11b MFI顯著高于健康對照組(P<0.01),見表1。
3.中性粒細胞對HUVEC凋亡的影響:與HSP患者中性粒細胞共培養的HUVEC凋亡率高于與健康對照中性粒細胞共培養組(P<0.01),見表1。
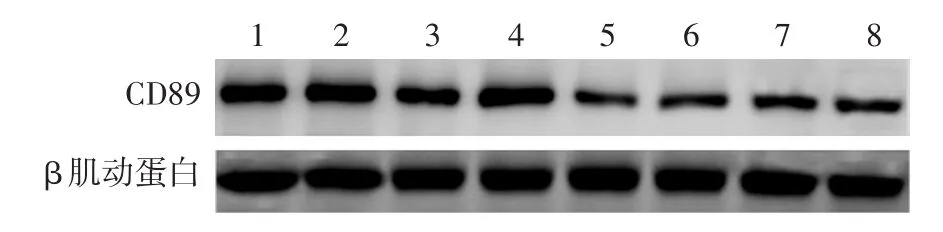
圖1 Western印跡檢測中性粒細胞CD89蛋白表達 1~4:健康對照;5~8:過敏性紫癜患兒
表1 過敏性紫癜(HSP)患兒中性粒細胞CD89、CD11b表達水平及對人臍靜脈內皮細胞(HUVEC)凋亡的影響(±s)
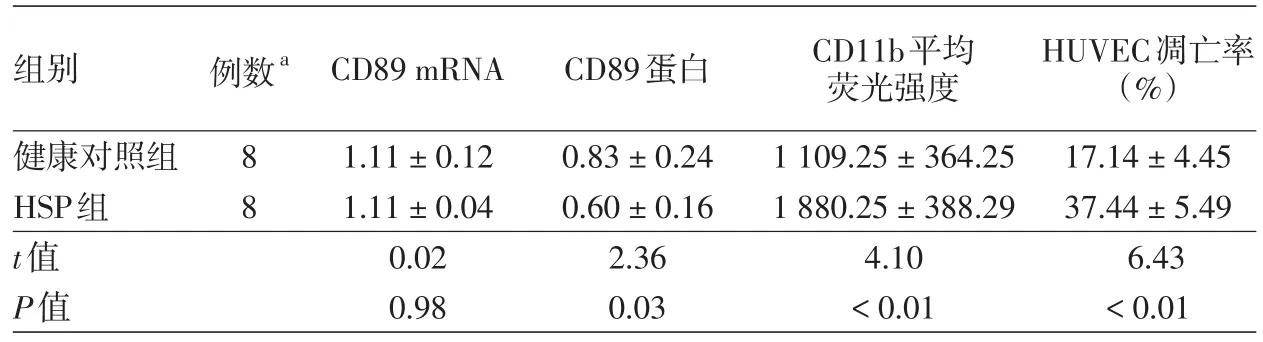
表1 過敏性紫癜(HSP)患兒中性粒細胞CD89、CD11b表達水平及對人臍靜脈內皮細胞(HUVEC)凋亡的影響(±s)
注:aHUVEC凋亡率檢測中兩組例數均為5
組別健康對照組HSP組t值P值例數a 88 CD89 mRNA 1.11±0.12 1.11±0.04 0.02 0.98 CD89蛋白0.83±0.24 0.60±0.16 2.36 0.03 CD11b平均熒光強度1 109.25±364.25 1 880.25±388.29 4.10<0.01 HUVEC凋亡率(%)17.14±4.45 37.44±5.49 6.43<0.01
表2 HSP患者IgA和mIgA對共培養的血管內皮細胞凋亡及上清液中IL?8、TNF?α水平的影響(±s)
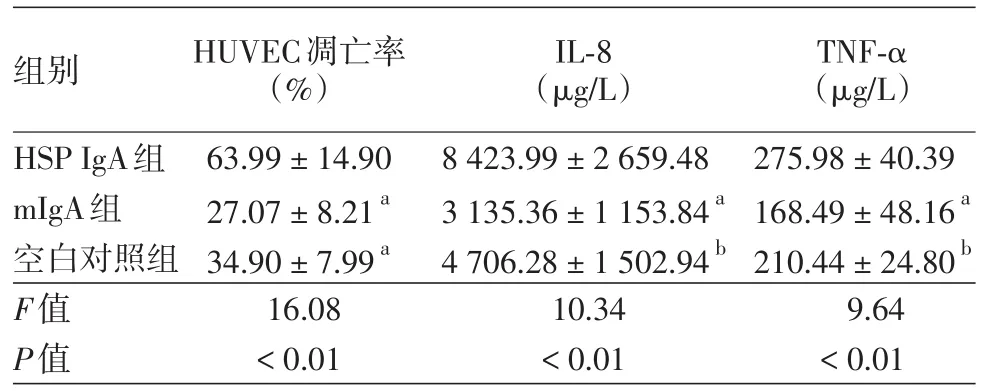
表2 HSP患者IgA和mIgA對共培養的血管內皮細胞凋亡及上清液中IL?8、TNF?α水平的影響(±s)
注:n=5。與HSP IgA組比較,aP <0.01,bP <0.05。HSP:過敏性紫癜;HUVEC:人臍靜脈內皮細胞;IL?8:白細胞介素8;TNF?α:腫瘤壞死因子α
組別HSP IgA組mIgA組空白對照組F值P值HUVEC凋亡率(%)63.99±14.90 27.07±8.21a 34.90±7.99a 16.08<0.01 IL?8(μg/L)8 423.99±2 659.48 3 135.36±1 153.84a 4 706.28±1 502.94b 10.34<0.01 TNF?α(μg/L)275.98±40.39 168.49±48.16a 210.44±24.80b 9.64<0.01
4.不同IgA處理對中性粒細胞與HUVEC共培養模型中HUVEC凋亡及上清液中IL?8、TNF?α水平的影響:HSP IgA組HUVEC平均凋亡率高于mIgA組(P<0.01)及空白對照組(P<0.01),mIgA組凋亡率低于空白對照組,但兩組間差異無統計學意義(P=0.28)。HSP IgA組上清液中IL?8、TNF?α濃度均顯著高于mIgA組(均P<0.01)及空白對照組(P值分別為0.01、0.02),mIgA與空白對照組之間比較差異無統計學意義。見表2。
討 論
中性粒細胞在HSP發病機制中具有重要意義。首先,HSP的病理基礎是以中性粒細胞浸潤為主的白細胞碎裂性血管炎,其次在免疫復合物介導的血管炎模型Arthus反應中,免疫復合物沉積導致補體活化和炎癥細胞募集,而中性粒細胞活化和聚集是免疫復合物致血管損傷所必需的條件[6]。另外有研究發現,HSP患兒急性期皮損處趨化中性粒細胞黏附的細胞間黏附分子1(ICAM?1)、E選擇素、P選擇素水平明顯上調,而ICAM?1、E選擇素、P選擇素配體下調可使中性粒細胞浸潤明顯減少,從而減輕水腫、出血等血管炎表現[7]。CD11b是中性粒細胞活化后表達的黏附分子,在靜息狀態下貯存于中性粒細胞胞質的三級顆粒中,在炎癥狀態下CD11b表達持續增加且分子活性增高,是中性粒細胞早期活化的特異性指標和HSP血管炎癥產生的始動環節[8]。本研究證實,急性期HSP患兒中性粒細胞CD11b表達明顯增高。我們還發現急性期HSP患兒外周血中性粒細胞CD89 mRNA表達正常,而蛋白水平較健康對照組降低。體外研究及多項疾病動物模型表明,CD89在介導血管炎癥反應、組織免疫損傷中起重要作用,可通過配體IgA調控其在體內的功能[3]。在與HSP發病機制相似的IgA腎病患者中,中性粒細胞表面及胞質內CD89表達下調,推測可能與CD89在IgA作用下胞外段脫落至循環中導致效應細胞表面表達降低有關[9]。中性粒細胞表面CD89的持續下調可導致循環中IgA免疫復合物降解障礙,加劇循環中IgA免疫復合物的沉積[10]。
IgA是HSP重要的致病因素,血清IgA以mIgA、多聚IgA(pIgA)等多種形式共存,IgA受體CD89可能作為雙功能受體發揮不同生理效應[11]。mIgA在無抗原刺激下能抑制多種炎癥應答過程,而pIgA及免疫復合物則發揮促炎作用[12?14]。為進一步探討不同類型IgA對HSP中性粒細胞介導的HUVEC凋亡的作用及可能機制,我們構建HSP中性粒細胞-HUVEC共培養炎癥模型,分別用自HSP患兒分離的IgA(以pIgA為主)及mIgA干預,結果發現,pIgA可誘導中性粒細胞介導的HUVEC凋亡,而mIgA對凋亡顯示出一定的抑制效應。中性粒細胞損傷血管內皮細胞可經由以下幾種途徑:血管內皮細胞激活,細胞因子、趨化因子、抗中性粒細胞胞質抗體、抗血管內皮細胞抗體,免疫復合物沉積及補體激活[15?16]。本研究發現,不同類型IgA對促炎癥細胞因子IL?8、TNF?α的產生有不同影響:pIgA可誘導IL?8、TNF?α產生,而mIgA則顯示出一定抑制作用。IL?8作為一種促炎癥細胞因子和趨化因子能誘導骨髓中性粒細胞,并與中性粒細胞上受體結合后誘導其向血管內皮細胞移行和黏附,參與免疫復合物介導血管炎的發病[17]。
綜上所述,本研究提示,HSP患兒血清IgA可能通過與中性粒細胞表面受體CD89結合,使中性粒細胞活化,進而導致血管內皮細胞損傷,CD89可能是HSP血管炎癥調控的潛在靶點。
[1]Carlson JA,Ng BT,Chen KR.Cutaneous vasculitis update:diagnostic criteria,classification,epidemiology,etiology,patho?genesis,evaluation and prognosis[J].Am J Dermatopathol,2005,27(6):504?528.DOI:10.1097/01.dad.0000181109.54532.c5.
[2]Ece A,Kelek?i S,Hekimoglu A,et al.Neutrophil activation,protein oxidation and ceruloplasmin levels in children with Henoch ?Sch?nlein purpura[J].Pediatr Nephrol,2007,22(8):1151?1157.DOI:10.1007/s00467?007?0475?5.
[3]Monteiro RC,Van De Winkel JG.IgA Fc receptors[J].Annu Rev Immunol,2003,21:177?204.DOI:10.1146/annurev.immunol.21.120601.141011.
[4]Ortiz?Sanjuán F,Blanco R,Hernández JL,et al.Applicability of the 2006 European League Against Rheumatism (EULAR)criteria for the classification of Henoch?Sch?nlein purpura.An analysis based on 766 patients with cutaneous vasculitis[J/OL].Clin Exp Rheumatol,2015,33(2 Suppl 89):S?44?7[2017?06?10].http://www.clinexprheumatol.org/abstract.asp?a=8633.
[5]Leung JC,Chan LY,Saleem MA,et al.Combined blockade of angiotensinⅡand prorenin receptors ameliorates podocytic apoptosis induced by IgA?activated mesangial cells[J].Apoptosis,2015,20(7):907?920.DOI:10.1007/s10495?015?1117?1.
[6]Sylvestre DL,Ravetch JV.Fc receptors initiate the Arthus reaction:redefining the inflammatory cascade[J].Science,1994,265(5175):1095?1098.DOI:10.1126/science.8066448.
[7]Gok F,Ugur Y,Ozen S,et al.Pathogenesis?related adhesion molecules in Henoch ?Schonlein vasculitis[J].Rheumatol Int,2008,28(4):313?316.DOI:10.1007/s00296?007?0437?z.
[8]Kallenberg CG,Heeringa P,Stegeman CA.Mechanisms of disease:pathogenesisand treatmentofANCA?associated vasculitides[J].Nat Clin Pract Rheumatol,2006,2(12):661 ?670.DOI:10.1038/ncprheum0355.
[9]Grossetête B,Launay P,Lehuen A,et al.Down-regulation of Fc alpha receptors on blood cells of IgA nephropathy patients:evidence for a negative regulatory role of serum IgA[J].Kidney Int,1998,53(5):1321?1335.DOI:10.1046/j.1523?1755.1998.00885.x.
[10]Roccatello D,Picciotto G,Torchio M,et al.Removal systems of immunoglobulin A and immunoglobulin A containing complexes in IgA nephropathy and cirrhosis patients.The role of asialogly?coprotein receptors[J].Lab Invest,1993,69(6):714?723.
[11]Aleyd E,Heineke MH,van Egmond M.The era of the immunoglobulin A Fc receptor FcαRI;its function and potential as target in disease[J].Immunol Rev,2015,268(1):123?138.DOI:10.1111/imr.12337.
[12]Bakema JE,van Egmond M.The human immunoglobulin A Fc receptor FcαRI:a multifaceted regulator of mucosal immunity[J].MucosalImmunol,2011,4(6):612?624.DOI:10.1038/mi.2011.36.
[13]Blank U,Launay P,Benhamou M,et al.Inhibitory ITAMs as novel regulators of immunity[J].Immunol Rev,2009,232(1):59?71.DOI:10.1111/j.1600?065X.2009.00832.x.
[14]Heineke MH,van Egmond M.Immunoglobulin A:magic bullet or Trojan horse?[J].Eur J Clin Invest,2017,47(2):184?192.DOI:10.1111/eci.12716.
[15]Pitanga TN,de Arag?o Fran?a L,Rocha VC,et al.Neutrophil?derived microparticles induce myeloperoxidase?mediated damage of vascular endothelial cells[J].BMC Cell Biol,2014,15:21.DOI:10.1186/1471?2121?15?21.
[16]Bergin DA,Reeves EP,Meleady P,et al. α ?1 Antitrypsin regulates human neutrophil chemotaxis induced by soluble immune complexes and IL?8[J].J Clin Invest,2010,120(12):4236?4250.DOI:10.1172/JCI41196.
[17]Yang YH,Lai HJ,Huang CM,et al.Sera from children with active Henoch ?Sch?nlein purpura can enhance the production of interleukin 8 by human umbilical venous endothelial cells[J].Ann Rheum Dis,2004,63(11):1511 ?1513.DOI:10.1136/ard.2003.016196.
Effect of neutrophils and their IgA Fc receptor on vascular endothelial cell apoptosis in patients with Henoch ?Sch?nlein purpura and its mechanism
Chen Jingsi,Sun Chen,Yang Haiping,Gan Liqiang,Tan Chunhua,Wang Hua,Luo Xiaoyan
Department of Dermatology,Children′s Hospital of Chongqing Medical University(Chen JS,Gan LQ,Tan CH,Wang H,Luo XY);Ministry of Education Key Laboratory of Child Development and Disorders,Chongqing Key Laboratory of Pediatrics,Chongqing 400014,China(Sun C);China International Science and Technology Cooperation Base of Child Development and Critical Disorders,Chongqing 400014,China(Yang HP)
Luo Xiaoyan,Email:luoxycq@hotmail.com
ObjectiveTo investigate the role of neutrophils and their IgA Fc receptor CD89 in the occurrence of Henoch?Sch?nlein purpura(HSP),to evaluate their effects on vascular endothelial cell apoptosis,and to explore their mechanisms.MethodsPeripheral blood neutrophils were isolated from 30 children with acute HSP and 9 age?matched healthy controls separately.After isolation of serum IgA by Jacalin affinity chromatography,IgA was purified by polypropylene dextran gel chromatography.Real?time fluorescence?based quantitative PCR(qPCR)and Western blot analysis were performed to determine the mRNA and protein expression of CD89 on neutrophils respectively,and flow cytometry was conducted to measure the expression of neutrophil activation marker CD11b.Human umbilical vein endothelial cells(HUVEC)were co?cultured with neutrophils isolated from patients with HSP(HSP group)and healthy controls(healthy control group)separately.Moreover,the HSP group were divided into 3 subgroups to be treated with serum IgA isolated from the HSP patients(HSP IgA group),monomeric IgA(mIgA group)and phosphate?buffered saline(blank control group)respectively.Then,flow cytometry was conducted to detect apoptosis of co?cultured HUVEC,and enzyme?linked immunosorbent assay(ELISA)to measure levels of interleukin?8(IL?8)and tumor necrosis factor?alpha(TNF?α)in the supernatant of co?cultured cells.ResultsThere was no significant difference in the mRNA expression of CD89 on neutrophils between the patients with HSP and healthy controls(P=0.98),but the protein expression of CD89 was significantly lower in the patients with HSP than in the healthy controls(0.60± 0.16vs.0.83± 0.24,P=0.03).The expression of CD11b on neutrophils was significantly higher in the patients with HSP than in the healthy controls(1 880.25 ± 388.29vs.1 109.25 ± 364.25,P< 0.01).The apoptosis rate of co?cultured HUVEC was also significantly higher in the HSP group than in the healthy control group(37.44% ±5.49%vs.17.14% ± 4.45%,P< 0.01).In addition,the HSP IgA group showed significantly higher apoptosis rate of co?cultured HUVEC and levels of IL?8 and TNF?α in the supernatant compared with the mIgA group(allP<0.01)and blank control group(P< 0.01,=0.01,=0.02,respectively).ConclusionsPeripheral blood neutrophils in patients with HSP are activated,which can induce the apoptosis of vascular endothelial cells.HSP IgA can promote the neutrophil?mediated apoptosis of vascular endothelial cells and secretion of IL?8 and TNF?α,while mIgA may show a certain inhibitory effects.
Purpura,Schoenlein?Henoch;Immunoglobulin A;Receptors,Fc;Neutrophils;Human umbilical vein endothelial cells;Apoptosis;Interleukin?8;Tumor necrosis factor?alpha
Fund program:National Natural Science Foundation of China(81301362)
羅曉燕,Email:luoxycq@hotmail.com
10.3760/cma.j.issn.0412?4030.2017.11.005
國家自然科學基金(81301362)
2017?04?13)
尚淑賢)

