理想氣體恒溫可逆和絕熱可逆過程功的比較與應用
賀曉凌 / 天津工業大學環境與化學工程學院
理想氣體恒溫可逆和絕熱可逆過程功的比較與應用
賀曉凌 / 天津工業大學環境與化學工程學院
物理化學課程中,理想氣體恒溫可逆和絕熱可逆過程功的知識點學生較難掌握,結合例題對二者進行闡述。物理化學課程中,理想氣體恒溫可逆和絕熱可逆過程是兩個非常重要的過程,關于二者過程功的比較和應用,學生較難掌握,本文通過結合例題分析的方式,對此知識點進行闡述。
理想氣體;恒溫可逆和絕熱可逆過程功;比較;應用
1.理想氣體恒溫可逆和絕熱可逆過程功的比較[1]
由物理化學知識可知,pV=K是理想氣體恒溫可逆過程方程,pVγ=K′是理想氣體絕熱可逆過程方程,分別對兩個方程進行全微分,推導過程如下:

處理理想氣體恒溫可逆和絕熱可逆過程的相關問題,關鍵就是依據此結論,此結論更直觀通俗的理解就是:絕熱可逆線比恒溫可逆線陡,反映到功的投影圖上則如圖1所示[2]。根據此結論,從圖中p~V線下面積表示功的大小角度可得(D情況除外): 理想氣體恒溫可逆過程所作膨脹功大于絕熱可逆過程所作膨脹功;理想氣體恒溫可逆過程所作壓縮功小于絕熱可逆過程所作壓縮功。這種說法只比較做功的大小,未考慮功的符號,如果按物理化學中的規定:環境對系統做功,W>0;系統對環境做功,W<0,膨脹功為系統對環境做功,則W(膨脹) <0,若考慮功的符號,對于膨脹過程則為理想氣體恒溫可逆過程所作膨脹功小于絕熱可逆過程所作膨脹功。因此上述結論可簡化為:理想氣體恒溫可逆過程所作體積功小于絕熱可逆過程所作體積功。
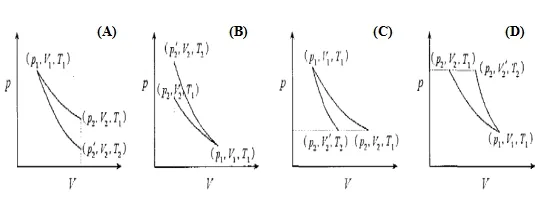
圖1 理想氣體恒溫可逆和絕熱可逆過程示意圖
(A) 從同一始態膨脹到相同終態體積
(B) 從同一始態壓縮到相同終態體積
(C) 從同一始態膨脹到相同終態壓力
(D) 從同一始態壓縮到相同終態壓力
2.理想氣體恒溫可逆和絕熱可逆過程功的應用
對理想氣體恒溫可逆和絕熱可逆過程功進行比較,得到︱絕熱可逆線斜率︱﹥︱恒溫可逆線斜率︱,即“絕熱可逆線比恒溫可逆線陡”的結論,目的在于其正確應用。下面以例題的形式,闡述此知識點的應用。
例: 理想氣體從相同始態分別經恒溫可逆膨脹和絕熱可逆膨脹到達相同的壓力,則兩種過程終態的T,V以及?H,?S,W之間的關系分別為 ( )

解析:理想氣體從相同始態分別經恒溫可逆膨脹和絕熱可逆膨脹到達相同的壓力,兩種過程的示意圖如圖1(C)情況,因為絕熱可逆線比恒溫可逆線陡,所以可知W(恒溫)< W(絕熱),V(恒溫)>V(絕熱),由此可推出下列各種結果。

3.結束語
上述問題可以進一步引申,如果題干改為壓縮過程、或末態達到相同壓力,解題思路和上述解析相同,關鍵是抓住絕熱可逆線比恒溫可逆線陡的結論,再結合p~V圖,即可獲得正確答案。由此可知,對于一個較難理解的知識點,要掌握問題的根本,抓住解決問題的關鍵,這是學好物理化學行之有效的方法。在教學過程中,要多對學生進行此方面技能的示范與引導,從而取得良好的教學效果。
[1]天津大學物理化學教研室編.物理化學(第五版).高等教育出版社.2010.
[2]陳良坦, 張來英, 吳金添.物理化學教學中的幾個問題.大學化學.2006,21(1):13-16.

