PARP-1、Caspase-3在子宮內膜癌組織中的表達變化及意義
宮瑩瑩,何玉,席玉玲
(蚌埠醫學院第一附屬醫院,安徽蚌埠233004)
PARP-1、Caspase-3在子宮內膜癌組織中的表達變化及意義
宮瑩瑩,何玉,席玉玲
(蚌埠醫學院第一附屬醫院,安徽蚌埠233004)
目的探討多聚ADP核糖聚合酶1(PARP-1)、半胱氨酸蛋白酶3(Caspase-3)在子宮內膜癌組織中的表達變化及其臨床意義。方法收集子宮內膜癌組織60例份、正常子宮內膜組織20例份、子宮內膜增生組織20例份,采用免疫組化法檢測各組織PARP-1、Caspase-3蛋白表達,分析子宮內膜癌組織PARP-1、Caspase-3表達與患者臨床病理參數的關系及二者的相關性。結果子宮內膜癌組織、正常子宮內膜組織及子宮內膜增生組織PARP-1陽性表達率分別為73.33%、15.00%、45.00%,不同組織間PARP-1陽性表達率比較P<0.05或<0.01。子宮內膜癌組織、正常子宮內膜組織及子宮內膜增生組織Caspase-3陽性表達率分別為41.67%、85.00%、45.00%,正常子宮內膜組織Caspase-3陽性表達率高于子宮內膜癌組織及子宮內膜增生組織(P均<0.01)。子宮內膜癌組織PARP-1陽性表達與患者的臨床分期、分化程度、浸潤深度均有關(P均<0.05),與淋巴結轉移無關(P>0.05)。子宮內膜癌組織Caspase-3陽性表達與患者的臨床分期、分化程度、浸潤深度及淋巴結轉移均無關(P均>0.05)。子宮內膜癌組織PARR-1、Caspase-3陽性表達率呈負相關(r=-0.64,P<0.01)。結論子宮內膜癌組織PARP-1表達升高、Caspase-3表達降低;PARP-1表達升高可能參與子宮內膜癌的發生與發展。
子宮內膜癌;多聚ADP核糖聚合酶1;半胱氨酸蛋白酶3
子宮內膜癌占女性生殖系統惡性腫瘤的20%~30%,其具體發病機制尚未研究清楚[1]。多聚ADP核糖聚合酶1( PARP-1)是一種具有多功能的蛋白質翻譯后修飾功能的核酶,在DNA突變修復尤其是DNA單鏈斷裂修復,以及維持基因組穩定性中具有至關重要的作用[3]。研究表明,PARP-1在多種惡性腫瘤組織中表達異常[4~8],其與腫瘤發生的關系也逐漸成為研究熱點。半胱氨酸蛋白酶3(Caspase-3)是引起細胞凋亡的關鍵酶,在細胞凋亡級聯反應通路中起核心作用。激活Caspase-3可降解多種酶底物,使級聯反應效應增強,從而使細胞完成凋亡的全過程。PARP-1作為Caspase最重要的酶底物,參與其介導的細胞凋亡,兩者的協同作用在凋亡機制中具有重要作用,但兩者在子宮內膜癌組織中的表達變化及其臨床意義鮮見報道。為此我們進行了如下研究。
1 資料與方法
1.1 臨床資料 選擇2010~2013年于蚌埠醫學院第一附屬醫院行手術治療的子宮內膜癌患者60例,術中收集其子宮內膜癌組織標本。患者均經術后病理證實,術前均未經放療、化療或免疫治療。年齡35~68歲,平均52歲;臨床分期參照2009年FIGO手術病理分期標準:Ⅰ期37例,Ⅱ期19例,Ⅲ期4例;分化程度按FIGO組織分化標準:高分化22例,中分化32例,低分化6例;浸潤深度:<1/2肌層21例,≥1/2肌層39例;淋巴結轉移:存在淋巴結轉移4例,無淋巴結轉移56例。選取同期經手術治療的子宮內膜增生患者20例,年齡36~55歲,平均45歲,術中取其正常子宮內膜組織及子宮內膜增生組織各20例份。本研究通過醫院倫理委員會審核,患者均知情同意。
1.2 組織PARP-1、Caspase-3檢測 采用免疫組化法。將子宮內膜癌組織、正常子宮內膜組織及子宮內膜增生組織標本采用10%中性甲醛固定,石蠟包埋,4 μm厚度連續切片。采用免疫組化法檢測組織PAPR-1、Caspase-3表達,操作步驟嚴格按試劑盒說明書進行。兔抗人PARP-1多克隆抗體工作濃度為1∶50,鼠抗人Caspase-3單克隆抗體工作濃度為1∶200, DAB顯色,蘇木素復染。采用IgG代替一抗作為陰性對照,用已知相應蛋白陽性切片作為陽性對照。PARP-1陽性染色為棕黃色或棕褐色顆粒,主要定位于細胞核;Caspase-3陽性染色為棕黃色顆粒,主要定位于細胞質,亦可見于細胞核和細胞核膜。所有切片由我院兩位有經驗的病理科醫生采用雙盲法進行觀察,在高倍鏡(×400)下隨機選取10個陽性細胞較多的視野觀察染色強度及陽性細胞百分比,每個視野計數100個細胞。染色強度評分:無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分。陽性細胞百分比評分:無陽性細胞為0分,陽性細胞數≤10%為1分,11%~50%為2分,51%~75%為3分,>75%為4分。染色強度及陽性細胞百分比評分相乘≥3為陽性表達,<3為陰性表達。
1.3 子宮內膜癌組織PARP-1、Caspase-3表達與患者臨床病理參數的關系 收集子宮內膜癌患者的臨床病理參數,包括臨床分期、分化程度、浸潤深度及淋巴結轉移情況,分析子宮內膜癌組織PARP-1、Caspase-3表達與患者臨床病理參數的關系。
1.4 統計學方法 采用SPSS20.0統計軟件。計數資料以率表示,結果比較采用χ2檢驗。PARP-1與Caspase-3的關系采用Spearman相關分析。P<0.05為差異有統計學意義。
2 結果
2.1 子宮內膜癌組織、正常子宮內膜組織及子宮內膜增生組織PARP-1、Caspase-3表達比較 子宮內膜癌組織、正常子宮內膜組織及子宮內膜增生組織PARP-1陽性表達率分別為73.33%(44/60)、15.00%(3/20)、45.00%(9/20),不同組織間PARP-1陽性表達率比較P<0.05或<0.01。子宮內膜癌組織、正常子宮內膜組織及子宮內膜增生組織Caspase-3陽性表達率分別為41.67%(25/60)、85.00%(17/20)、45.00%(9/20),正常子宮內膜組織Caspase-3陽性表達率高于子宮內膜癌組織及子宮內膜增生組織(P均<0.01)。
2.2 子宮內膜癌組織PARP-1、Caspase-3表達與患者臨床病理參數的關系 子宮內膜癌組織PARP-1陽性表達與患者的臨床分期、分化程度、浸潤深度均有關(P均<0.05),與淋巴結轉移無關(P>0.05)。子宮內膜癌組織Caspase-3陽性表達與患者的臨床分期、分化程度、浸潤深度及淋巴結轉移均無關(P均>0.05)。見表1。
2.3 子宮內膜癌組織PARP-1、Caspase-3表達的關系 子宮內膜癌組織PARR-1、Caspase-3陽性表達率呈負相關(r=-0.64,P<0.01)。
3 討論
PARP是在真核細胞中催化聚二磷酸腺苷核酸糖化產生的一種蛋白翻譯后修飾酶,參與DNA修復和轉錄、維持染色體結構、細胞凋亡等重要的生物學過程。PARP-1作為PARP家族中最重要的成員,是其中發揮主要作用的亞基。Barnett等[10]研究顯示,晚期漿液性卵巢癌細胞PARP-1表達明顯升高,且腫瘤細胞分化程度越低, PARP-1表達越高。分析原因:①腫瘤細胞增殖活躍,產生大量過氧化物如NO、氧自由基等,造成DNA損傷, DNA雙鏈出現缺口或斷裂,使得PARP-1立即活化,DNA損傷越重,產生的DNA斷端越多, PARP-1表達越高[11];②DNA斷端增多甚至出現不規則DNA斷裂,故在細胞修復過程中出現的錯配修復比例也明顯增高,PARP-1表達也隨之升高;③ 過量DNA損傷在引起PARP-1活化的同時,降低了其對DNA 的修復活性,故分化程度越低的細胞PARP-1表達越高。本研究結果顯示,子宮內膜癌組織、正常子宮內膜組織及子宮內膜增生組織PARP-1陽性表達率依次降低,子宮內膜癌組織PARP-1陽性表達率與患者的臨床分期、分化程度、浸潤深度均有關;說明子宮內膜癌組織PARP-1表達升高,并參與了子宮內膜癌的發生與發展。
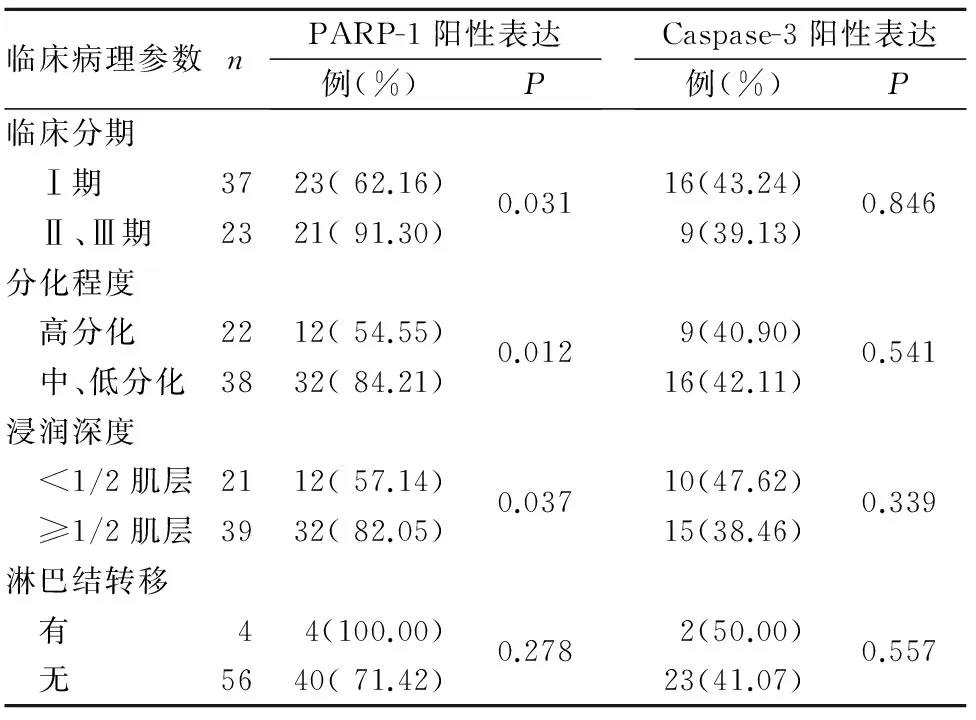
表1 子宮內膜癌組織PARP-1、Caspase-3表達與患者臨床病理參數的關系
細胞凋亡對于促進生物體進化、保證器官組織正常發育、維持生物體內環境穩定及免疫系統的正常功能均具有重要作用,細胞凋亡途徑可分為Caspase依賴途徑和非Caspase依賴途徑,其中以前者更為重要[9]。細胞凋亡可以有效預防腫瘤發生,對腫瘤細胞具有負調控作用。正常子宮內膜細胞若出現凋亡通路紊亂、促凋亡因子表達抑制、凋亡抑制因子過度表達及凋亡基因表達失控等,均可導致細胞增殖與凋亡失衡,引起腫瘤的發生。Caspase-3作為Caspase家族的重要成員之一,實質為含有半胱氨酸的蛋白酶,以無活性的酶原形式存在于多個人體器官正常組織細胞中,位于細胞凋亡信號傳導主要通路的核心位置。當Caspase-3酶原被多種凋亡刺激因子啟動不同的蛋白酶切割時,Caspase-3即被激活,活化的Caspase-3可水解相應底物,并通過蛋白酶級聯反應放大誘發凋亡。凋亡的途徑大致分為:①線粒體/細胞色素c介導的細胞凋亡通路;②Fas死亡受體介導的凋亡通路。無論哪一種凋亡途徑最終過程都是通過激活Caspase-3完成的,其為細胞凋亡中的關鍵蛋白酶,被稱為死亡蛋白酶[12]。Zanotti等[13]報道,Caspase-3在正常宮頸上皮細胞、上皮內瘤變細胞、浸潤癌細胞中的表達依次降低,提示Caspase-3表達降低可能參與宮頸上皮細胞的惡變過程。于紅麗等[14]報道,Caspase-3在卵巢癌組織中的陽性率僅為0.5%,而在良性卵巢腫瘤及交界性卵巢上皮性腫瘤的陽性表達率均為100%,提示Caspase-3激活可能抑制腫瘤細胞增殖,避免卵巢癌的發生。本研究結果顯示,子宮內膜癌組織及子宮內膜增生組織Caspase-3陽性表達率均低于正常子宮內膜組織;推測腫瘤細胞中Caspase-3表達降低,其活性缺失可能使腫瘤細胞在形成過程中逃避機體細胞凋亡的自我調節而不斷增殖,細胞凋亡與增殖之間的動態平衡失調,最終導致子宮內膜癌的發生。本研究結果顯示,子宮內膜癌組織Caspase-3陽性表達率與患者的臨床分期、分化程度、浸潤深度及淋巴結轉移均無關;說明Caspase-3可能僅參與了子宮內膜癌細胞的凋亡失衡,并沒有參與組織間質破壞和腫瘤細胞的黏附侵襲,與既往文獻報道一致[15]。
當細胞出現損傷時,PARP-1被活化后識別損傷位點,催化尼克酰胺腺嘌呤二核苷酸(NAD+)裂解為尼克酰胺和ADP核糖,進而合成為長鏈聚腺苷二磷酸核糖(PAR),與PARP-1自身、p53、DNA連接酶、組蛋白等多種核受體蛋白共價結合,使其發生聚ADP核糖化而增加其活性。此后,PARP-1從DNA上釋放,使DNA修復酶結合到DNA斷裂處進行DNA修復。但當DNA損傷嚴重時, PARP-1被過度活化,其“細胞保護”功能即發生改變,為防止核蛋白過度聚二磷酸腺苷核糖化,導致NAD+和ATP大量消耗,此時將激活Caspase-3,PARP-1就成為Caspase-3 的“死亡底物”而被裂解,保證細胞凋亡的正常進行。本研究結果顯示,子宮內膜癌組織PARR-1、Caspase-3陽性表達率呈負相關。理論上子宮內膜癌組織由于細胞損傷嚴重,PARP-1被大量激活,為避免腫瘤細胞過度增殖,Caspase-3也應被激活;但事實上子宮內膜癌細胞Caspase-3表達降低,阻斷了腫瘤細胞的凋亡過程,使腫瘤細胞數目增加。因此,子宮內膜癌組織PARR-1、Caspase-3表達呈負相關。PARP-1過度表達引起Caspase-3表達降低的具體機制仍需進一步探究。
綜上所述,子宮內膜癌組織PARP-1表達升高、Caspase-3表達降低;PARP-1表達升高可能參與了子宮內膜癌的發生與發展。
[1] American Cancer Society. Detailed guide: endometrial cancer: what are the risk factors for endometrial cancer Atlanta[M]. Ga American Cancer Society, 2005:102.
[2] 曹澤毅.中華婦產科學[M].2版.北京:人民衛生出版社,2004:2539.
[3] Takata T, Tanaka F, Yamada T, et al. Clinicalsignificance of caspase-3 expression in pathologic-stage I, nonsmall-cell lung cancer[J]. Int J Cancer, 2001,96 Suppl:54-60.
[4] Barton VN, Donson AM, Kleinschmidt-DeMasters BK, et al. PARP1 expression in pediatric central nervous system tumors[J]. Pediatr Blood Cancer, 2009,53(7):1227-1230.
[5] Nguewa PA, Fuertes MA, Cepeda V, et al. Poly (ADP-ribose) polymerase-1 inhibitor 3-aminobenzamide enhances apoptosis induction by platinum complexes in cisplatin-resistant tumor cells[J]. J Med Chem, 2006,2(1):47-53.
[6] Nosho K, Yamamoto H, Mikami M, et al. Over expression of poly (ADP-ribose) polymerase-1(PARP-1) in the early stage of colorectal carcinogenesis[J]. Eur J Cancer, 2006,42(14):2374-2381.
[7] Tentori L, Leonetti C, Scarsella M, et al. Inhibition of poly (ADP-ribose) polymerase prevents irinotecan-induced intestinal damage and enhances irinotecan/temozolomideefficacy against colon carcinoma[J]. FASEB J, 2006,20(10):1709-1711.
[8] Csete B, Lengyel Z, Kádár Z, et al. Poly(adenosine diphosphate-ribose) polymerase-1 expression in cutaneous malignant melanomas as a new molecular marker of aggressive tumor[J]. Pathol Oncol Res, 2009,15(1):47-53.
[9] 楊紹杰,孟金萍,屈祎,等.細胞凋亡信號轉導通路的研究進展[J].中國比較醫學雜志,2007,17(5):297-301.
[10] Barnett JC, Bean SM, Nakayamn JM, et al. High poly(adenosine diphosphate-ribose) polymerase expression and poor survival in sdvanced-stage serous ovatian cancer[J]. Obstet Gynecol, 2010,115(1):49-54.
[11] Zhao M, Gao FH. JAK2/STAT3 signaling pathway activation mediates tumor angiogenesis by upregu-lation of VEGF and bFGF in non-small-cell lung cancer[J]. Lung Cancer, 2011,73(3):366-374.
[12] 王淑榮,申存周.ATP、PARP、Caspase-3與細胞凋亡和脹亡[J].中國微循環,2009,13(6):638-640.
[13] Zanotti S, Fissefier-Eckhoff A. Changes in the topological expression of markers if differentiation and apoptosis in defined stages of human cervical dysplasia and carcinoma[J]. Gynecol Oncol, 2003,89(3):376-384.
[14] 于紅麗,鄭建華,趙宏敏.Survivin、caspase-3及PCNA在卵巢上皮性腫瘤中水平的臨床意義[J].中國實用婦科與產科雜志,2007,23(12):948-950.
[15] SongY, Shen K, Xu F. Synergism of antitumor effects on ovarian carcinoma using autocatalytic caspase-3 combined with flavopiridol[J].中華婦產科雜志,2010,45(10):781-786.
10.3969/j.issn.1002-266X.2017.44.030
R737.33
B
1002-266X(2017)44-0092-03
2017-02-16)

