KLF7聯合脂肪源性干細胞對脊髓損傷大鼠運動功能的影響及其機制
李文媛,王瑩,郭素芬,劉星,李智剛,劉貴波,許志鵬,張際菲
(1牡丹江醫學院,黑龍江牡丹江157011;2牡丹江醫學院紅旗醫院)
KLF7聯合脂肪源性干細胞對脊髓損傷大鼠運動功能的影響及其機制
李文媛1,王瑩1,郭素芬1,劉星1,李智剛2,劉貴波1,許志鵬1,張際菲1
(1牡丹江醫學院,黑龍江牡丹江157011;2牡丹江醫學院紅旗醫院)
目的觀察KLF樣轉錄因子7(KLF7)聯合脂肪源性干細胞(ADSC)對脊髓損傷大鼠運動功能的影響,并探討其可能的機制。方法將30只SD大鼠隨機分為KLF7聯合ADSC組、ADSC組及對照組,每組10只,均采用離斷右半脊髓的方法制備脊髓損傷模型。KLF7聯合ADSC組于脊髓損傷組織注入100 μL ADSC(ADSC均采用PKH26進行標記)及2 μL AAV2-KLF7腺病毒,ADSC組僅注入100 μL ADSC,對照組僅注入100 μL PBS。術后1天及1、2、3、4周行運動功能評分(BBB評分);術后4周,應用誘發電位儀和磁刺激器經顱磁刺激運動誘發神經電生理反應,記錄神經傳導速度、潛伏期及波幅。術后4周處死,采用Western boltting法檢測脊髓損傷組織KLF7、神經生長因子(NGF)及其受體酪氨酸激酶A(TrkA)蛋白相對表達量,計算脊髓損傷面積百分比及ADSC數量(以PKH26的光密度值表示)。結果與術后1天比較,各組術后1、2、3、4周BBB評分均升高(P均<0.05)。術后4周,KLF7聯合ADSC組與ADSC組BBB評分、神經傳導速度、波幅、ADSC數量及脊髓損傷組織NGF、TrkA蛋白相對表達量均高于對照組,潛伏期及脊髓損傷面積百分比均低于對照組,且KLF7聯合ADSC組上述變化更明顯(P均<0.05)。KLF7聯合ADSC組脊髓損傷組織KLF7蛋白相對表達量均高于ADSC組及對照組(P均<0.05)。結論KLF7聯合ADSC可減輕脊髓損傷大鼠的神經損傷,改善其運動功能;其機制可能與KLF7促進ADSC存活及提高脊髓損傷組織NGF、TrkA表達有關。
脊髓損傷;KLF樣轉錄因子7;脂肪源性干細胞;神經生長因子;酪氨酸激酶A;大鼠
脊髓損傷可導致機體感覺、運動、肌力異常等一系列病理變化,除導致機體感覺和隨意運動障礙外,還影響自主神經系統,導致多個器官功能障礙或衰竭[1,2]。KLF樣轉錄因子7(KLF7)屬于鋅指家庭成員,在斑馬魚神經系統中高表達[3],并可促進大鼠脊髓皮質束軸突再生[4]。KLF7為軸突生長促進劑, 可促進小鼠坐骨神經運動軸突再生和髓鞘形成,其基因轉錄激活可促進成人皮質脊髓束軸突再生[5]。敲除KLF7基因可引起中樞神經、視網膜和嗅覺神經軸突再生障礙[6]。研究證實,神經生長因子(NGF)及其受體酪氨酸激酶A(TrkA)是KLF7的下游靶基因[4,7],二者也是重要的神經營養因子,在神經損傷修復過程中發揮重要作用。前期研究證實,脂肪源性干細胞(ADSC)能夠促進脊髓損傷修復,但單獨應用對神經功能的恢復效果并不理想[8,9]。2015年3月~2016年11月,本研究觀察了KLF7聯合ADSC對脊髓損傷大鼠運動功能的影響,現分析結果并探討其機制,旨在為脊髓損傷的治療提供依據。
1 材料與方法
1.1 材料 實驗動物:雄性健康C57BL/6小鼠5只,6~8周齡,體質量(19±2)g,購自哈爾濱醫科大學實驗動物中心。SD大鼠30只,雌雄各半,6~8周齡,體質量(200±20)g,購自哈爾濱醫科大學實驗動物中心。主要試劑:DMEM/F12 培養液購自美國Hyclone公司,FBS、胰蛋白酶、茜素紅、多聚賴氨均購自美國Gibco公司,PKH26、兔抗NGF抗體和兔抗TrkA抗體均購自美國Sigma公司,AAV2-KLF7腺病毒購自美國Vector BioLabs公司。主要儀器:CO2培養箱購自日本三洋公司,誘發電位儀和磁刺激器購自英國Magstim公司,脊髓沖擊損傷模型儀(ModelⅡ NYU Impactor)購自美國MASCIS公司。
1.2 ADSC分離培養及標記 參照前期研究方法[9],取5只C57BL/6小鼠的腹部脂肪組織行ADSC分離、原代培養。原代培養8天,ADSC形成的細胞群落較為密集,光鏡下呈多角形或梭形伸展,有鋪路石狀特征。傳代培養2周,加入成骨誘導液(基礎培養液+0.1 μmol/L地塞米松+50 μmol/L維生素C+10 mmol/L β-甘油磷酸鈉)進行成骨誘導。成骨誘導28天茜素紅染色結果顯示,ADSC細胞質內出現鈣鹽沉積,茜素紅染色后呈紅色聚集物,證實該細胞為ADSC(具有成骨誘導分化潛能)。取傳4代的ADSC,制備單細胞懸液,調整細胞密度為1×106個/100 μL,參照Wang等[10]的方法行PKH26染色標記。
1.3 模型制備及分組處理 將30只大鼠隨機分為KLF7聯合ADSC組、ADSC組及對照組,每組10只。三組均參照Gomes-Osman等[2]的方法制備脊髓損傷模型,方法如下:10%水合氯醛溶液腹腔注射麻醉,術區備皮,常規消毒,鋪無菌單;以肋骨為定位中心,于大鼠背部棘突體表作一長約3 cm的切口,切開皮膚、皮下組織,剝離椎旁肌肉,顯露棘突、椎板及關節突。用咬骨鉗咬除T10及部分T9、T11椎板,顯露脊髓;顯微鏡下可見正中靜脈,用顯微外科剪垂直剪斷右側脊髓,鏡下可見脊髓右半部分完全離斷,大鼠雙下肢出現抽動和癱瘓,證實造模成功。KLF7聯合ADSC組于脊髓損傷組織注入100 μL ADSC及2 μL AAV2-KLF7腺病毒(含1×1011pfu/mL),ADSC組僅注入100 μL ADSC,對照組僅注入100 μL PBS。關閉切口,術后切口涂抹紅霉素軟膏預防感染。
1.4 運動功能檢測 ①BBB評分:各組均于術后1天及1、2、3、4周同一時間點(20:00)行BBB評分[11],由兩名醫師同時進行,取平均值。②神經電生理相關參數:術后4周,參照Wang等[12]的方法,將電磁線圈置于各組大鼠顱骨激活皮層下組織,應用誘發電位儀和磁刺激器經顱磁刺激運動誘發神經電生理反應,記錄神經傳導速度、潛伏期及波幅。實驗重復4次,取平均值。
1.5 脊髓損傷組織KLF7、NGF、TrkA蛋白表達檢測 采用Western boltting法。術后4周,采用10%水合氯醛溶液(350 mg/kg)腹腔注射將大鼠麻醉后迅速處死,以T10損傷灶為中心,取出約1 cm的新鮮脊髓組織,-80 ℃冰箱保存。用顯微外科手術剪刀將損傷脊髓組織剪碎,研磨器充分研磨,加入相應體積的RIPA裂解液和1% PMSF蛋白酶抑制劑,離心吸取上清液。BCA定量試劑盒測定蛋白濃度合格,進行SDS-PAGE,分離蛋白后轉至硝酸纖維素膜;緩沖液封閉后,加入KLF7一抗(1∶200)、兔抗NGF一抗(1∶200)或兔抗TrkA一抗(1∶200),4 ℃孵育過夜;加入辣根過氧化物酶標記的抗小鼠二抗(1∶2 000),孵育 2 h;TBS洗凈后經顯色液作用15 min,掃描后經Image J圖像分析軟件對印跡區進行條帶灰度分析。以目的蛋白與內參蛋白GADPH灰度值的比值作為目的蛋白相對表達量。
1.6 脊髓損傷面積檢測 取脊髓損傷組織,中性甲醛液充分固定,常規脫水制片包埋,25 μm厚度切片。常規行HE染色:將冰凍切片在空氣中干燥1~2天,蒸餾水浸泡1~2 min;蘇木素溶液中浸泡1 min,蒸餾水洗凈;1%鹽酸處理30 s,蒸餾水沖洗3 min,80%乙醇脫水1~2 min;伊紅溶液中浸泡1~2 min,蒸餾水洗凈;80%乙醇脫水1 min,95%乙醇脫水1 min,無水乙醇脫水1 min,二甲苯透明3 min。擦干后中性樹膠封片。選擇10張切片,采用Image6.0軟件計算每張切片空洞面積與正常脊髓面積的百分比,即脊髓損傷面積百分比。實驗重復3次,取平均值。
1.7 脊髓損傷組織ADSC數量檢測 取各組1.5中的脊髓損傷組織冰凍切片,根據檢測PKH26標記的熒光顯像說明書進行操作。熒光顯像參數設定如下:激發光波長450~570 nm,發射光波長570~700 nm,曝光時間1 min。熒光顯微鏡下進行觀察,PKH26標記后的ADSC呈紅色。采用Image6.0軟件分析PKH26的光密度值,以此表示ADSC數量。
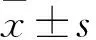
2 結果
2.1 三組BBB評分比較 見表1。
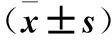
表1 三組BBB評分比較
注:與同組術后1天比較,*P<0.05;與對照組同時間點比較,#P<0.05;與ADSC組同時間點比較,△P<0.05。
2.2 三組神經電生理相關參數比較 見表2。
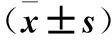
表2 三組神經電生理相關參數比較
注:與對照組比較,*P<0.05;與ADSC組比較,#P<0.05。
2.3 三組脊髓損傷組織KLF7、NGF、TrkA蛋白表達比較 見表3。
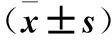
表3 三組脊髓損傷組織KLF7、NGF、TrkA蛋白相對表達量比較
注:與對照組比較,*P<0.05;與ADSC組比較,#P<0.05。
2.4 三組脊髓損傷面積及ADSC數量比較 見表4。
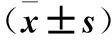
表4 三組脊髓損傷面積百分比及ADSC數量比較
注:與對照組比較,*P<0.05;與ADSC組比較,#P<0.05。
3 討論
脊髓損傷修復的機制仍然不明確,其臨床治療多以外科手術減壓及大劑量激素沖擊為主,對于脊髓炎、脊髓空洞等引起的脊髓變性目前暫無有效藥物治療[12]。ADSC不僅可以分化為中、內、外胚層細胞,而且還能夠分化為神經細胞,在中樞神經損傷恢復期發揮重要作用[13]。ADSC在脊髓損傷早期具有刺激作用,可促進多種細胞因子和神經營養因子表達,如腦源性神經營養因子、NGF、堿性成纖維細胞生長因子、胰島素樣生長因子、肝細胞生長因子、血管內皮生長因子等[14]。在神經修復過程中,上述細胞因子和神經營養因子可以通過誘導血管生成促進神經功能恢復,減少損傷周邊區神經元凋亡,重建樹突和軸突突觸,并促進神經元再生和分化。ADSC可誘導分泌可溶性因子,如骨形態發生蛋白2和骨形態發生蛋白4等,這些因子在缺血區星形膠質細胞的分化過程中具有重要作用。前期研究也發現,ADSC可合成、分泌大量神經營養因子,如神經生長因子、血管內皮生長因子等,這些促進神經生長的因子可為軸突生長提供營養,促進周圍神經軸突再生[8,9]。因此,ADSC移植被認為是一個治療脊髓損傷的具有廣闊前景的方法。
KLF屬于鋅指家庭成員,具有DNA結合域的羧基末端,由3個高度保守的Cys2/His2鋅指結構組成,其DNA結合域通過與靶基因啟動子上的C框或CACCC元件結合而發揮調控靶基因表達的作用,廣泛參與細胞增殖、凋亡、分化以及胚胎發育等多個生命活動的調控[15]。KLF7在中樞和周圍神經系統中廣泛存在,可調控多種細胞的發育、增殖和分化,對周圍神經系統軸突再生、髓鞘形成發揮重要作用,提高KLF7表達不僅可促進軸突生長,也可增加神經元營養,促進軸突生長[16]。本研究結果顯示,與術后1天比較,各組術后1、2、3、4周BBB評分均升高,說明三組治療后運動功能均有所恢復;KLF7聯合ADSC組與ADSC組術后4周BBB評分、神經傳導速度、波幅均高于對照組,潛伏期及脊髓損傷面積百分比均低于對照組,但KLF7聯合ADSC組變化更明顯,說明KLF7聯合ADSC可有效減輕脊髓損傷大鼠的神經損傷,并有助于提高其神經功能、促進其運動功能的恢復。
研究發現,KLF7能夠在周圍神經系統上調靶基因NGF和TrkA表達,激活神經營養因子信號通路;通過增強TrkA受體的穩態,促進NGF誘發神經突起生長的作用[4]。目前已明確NGF/TrkA信號通路在促進神經元生長中發揮重要作用,但KLF7在脊髓損傷中對NGF/TrkA信號通路的調控尚不清楚。本研究結果顯示,KLF7聯合ADSC組、ADSC組脊髓損傷組織NGF、TrkA蛋白相對表達量均高于對照組,但KLF7聯合ADSC組升高更明顯;說明KLF7聯合ADSC促進脊髓損傷后運動及神經功能恢復的機制可能與NGF/TrkA信號通路激活有關,與以往研究結果一致[16]。本研究結果顯示,KLF7聯合ADSC組、ADSC組ADSC數量均高于對照組,但KLF7聯合ADSC組升高更明顯,說明KLF7與ADSC聯合移植有助于促進ADSC存活及發揮神經再生功能。
綜上所述,KLF7聯合ADSC可改善脊髓損傷大鼠的運動功能,減輕其神經損傷;其機制可能與KLF7促進ADSC存活及提高脊髓損傷組織NGF、TrkA表達有關。
[1] Jackson A. Spinal-cord injury: neural interfaces take another step forward[J]. Nature, 2016,539(7628):177-178.
[2] Gomes-Osman J, Cortes M, Guest J, et al. A systematic review of experimental strategies aimed at improving motor function after acute and chronic spinal cord injury[J].J Neurotrauma, 2016,33(5):425-438.
[3] Xue Y, Gao S, Liu F. Genome-wide analysis of the zebrafish Klf family identifies two genes important for erythroid maturation[J]. Dev Biol, 2015,403(2):115-127.
[4] Blackmore MG, Wang Z, Lerch JK, et al. Krüpple-like factor 7 engineered for t ranscriptional activation promotes axon regeneration in the adult corticospinal tract[J]. Proc Natl Acad Sci U S A, 2012,109(19):7517-7522.
[5] Moore DL, Blackmore MG, Hu Y, et al. KLF family members regulate intrinsic axon regeneration ability[J]. Science, 2009,326(5950):298-301.
[6] 王瑩,李文媛,趙艷晶,等.KLF7對小鼠脫細胞異體神經支架移植后運動功能的影響[J].神經解剖學雜志,2016,32(3):385-390.
[7] Hirose M, Kuroda Y, Murata E. NGF/TrkA signaling as a therapeutic target for pain[J]. Pain Pract, 2016,16(2):175-182.
[8] 李文媛,王瑩,李智剛,等.KLF7 聯合脂肪源性干細胞對小鼠坐骨神經缺損后軸突再生的影響[J].中風與神經疾病雜志,2016,33(7):580-583.
[9] 王瑩,李文媛,劉貴波,等.黃芪皂甙Ⅳ聯合ADSC對坐骨神經缺損后大鼠運動功能的修復作用[J].山東醫藥,2013,53(39):4-6.
[10] Wang Y, Jia H, Li WY, et al. Synergistic effects of bone mesenchymal stem cells and chondroitinase ABC on nerve regeneration after acellular nerve allograft in rats[J]. Cell Mol Neurobiol, 2012,32(3):361-371.
[11] Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995,12(1):1-21.
[12] Wang Y, Jia H, Li WY, et al. Molecular examination of bone marrow stromal cells and chondroitinase ABC assisted acellular nerve allograft for peripheral nerve regeneration[J]. Exp Ther Med, 2016,12(4):1980-1992.
[13] Wu JH, Li M, Liang Y, et al.Migration of adipose-derived mesenchymal stem cells stably expressing chondroitinase ABC in vitro[J]. Chin Med J (Engl), 2016,129(13):1592-1599.
[14] Ji W, Zhang X, Ji L, et al.Effects of brain-derived neurotrophic factor and neurotrophin-3 on the neuronal differentiation of rat adipose-derived stem cells[J]. Mol Med Rep, 2015,12(4):4981-4988.
[15] Mc Connell BB, Yang VW. Mammalian Kruppel-like factors in health and diseases[J]. Physiol Rev, 2010,90(4):1337-1381.
[16] Wang Y, Li WY, Jia H, et al. KLF7-transfected Schwann cell graft transplantation promotes sciatic nerve regeneration[J]. Neuroscience, 2016(340):319-332.
EffectofKLF7andadipose-derivedstemcellsonmotorfunctionafterspinalcordinjuryinrats
LIWenyuan1,WANGYing,GUOSufen,LIUXing,LIZhigang,LIUGuibo,XUZhipeng,ZHANGJifei
(1MudanjiangMedicalCollege,Mudanjiang157011,China)
ObjectiveTo observe the effect of KLF7 and adipose-derived stem cell (ADSC) on motor function after spinal cord injury (SCI) in rats, and to probe the possible mechanism.MethodsThirty healthy SD rats were randomly divided into the KLF7+ADSC group, ADSC group, and control group, with 10 in each. SCI models were prepared by the method of transection of right half spinal cord. The 100 μL ADSC (ADSC labeled with PKH26) and 2 μL AAV2-KLF7 were injected into the SCI tissues in the KLF7+ADSC group, 100 μL ADSC was injected in the ADSC group, and 100 μL PBS was injected in the control group. At 1 day and 1, 2, 3, 4 weeks after operation, BBB was used to evaluate rats′ double lower limb functional recovery in each group. At week 4 after the operation, evoked electrophysiological responses were evoked by evoke potential instrument and tcMMEP, and the nerve conduction velocity, latency and amplitude were recorded. The rats were killed at 4 weeks after the operation, KLF7, NGF and TrkA protein in the SCI tissues were evaluated by Western blotting. The lesion area percentage of SCI and the number of ADSC were evaluated (the number of ADSC was represented by the light density value of PKH26).ResultsThe BBB scores increased at 1, 2, 3 and 4 weeks after operation as compared with that at 1 day after operation in each group (P<0.05). At 4 weeks after operation, compared with the control group, BBB score, nerve conduction velocity, amplitude, the number of ADSC, NGF and TrkA protein expression in the SCI tissues increased in the KLF7+ADSC group and ADSC group, however, the latency and the percentage of lesion area decreased, moreover, the effect of KLF7+ADSC group was more significant than that of the ADSC group (P<0.05). KLF7 relative protein expression in the SCI tissues in the KLF7+ADSC group was higher than that of the ADSC group and control group (allP<0.05).ConclusionKLF7 combined with ADSC could improve the motor function and alleviate the nerve damage, and the mechanism may be that KLF7 promotes ADSC survival and up-regulates NGF and TrkA expression in the lesion area.
spinal cord injury; KLF-like transcription factor 7; adipose-derived stem cells; nerve growth factor; tyrosine kinase A; rats
國家自然科學基金資助項目(81371362);黑龍江省科學基金資助項目(LC2017040);黑龍江省衛生廳科研課題(2016-357)。
李文媛(1980-),女,副教授,研究方向為腫瘤淋巴管的生成機制。E-mail: yuanyuan19800413@163.com
王瑩(1977-),男,副教授,研究方向為腫瘤淋巴管的生成機制。E-mail: Yingwang770224@163.com
10.3969/j.issn.1002-266X.2017.44.002
R496
A
1002-266X(2017)44-0005-04
2016-11-23)

