HIF-1α基因干擾對低氧環境下人鼻黏膜上皮細胞TGF-β1、VEGF、bFGF表達的影響及其機制
楊琳紅,張愛華,范宗憲,韓琳,王維峰
(1 佳木斯大學附屬第一醫院,黑龍江佳木斯154000;2 中國人民解放軍第二二四醫院)
HIF-1α基因干擾對低氧環境下人鼻黏膜上皮細胞TGF-β1、VEGF、bFGF表達的影響及其機制
楊琳紅1,張愛華1,范宗憲1,韓琳2,王維峰1
(1 佳木斯大學附屬第一醫院,黑龍江佳木斯154000;2 中國人民解放軍第二二四醫院)
目的觀察低氧誘導因子1α(HIF-1α)基因干擾對低氧環境下人鼻黏膜上皮細胞(HNEC)轉化生長因子β1(TGF-β1)、血管內皮生長因子(VEGF)、堿性成纖維細胞生長因子(bFGF)表達的影響,并探討其可能的作用機制。方法體外培養HNEC,取傳3代對數生長期細胞隨機分為空白對照組、NC-shRNA組、HIF-shRNA組和低氧誘導組。空白對照組不予任何處理,NC-shRNA組、HIF-shRNA組分別予NC-shRNA、HIF-shRNA轉染,并于轉染24 h后經CoCl2化學誘導模擬低氧環境;低氧誘導組僅經CoCl2化學誘導模擬低氧環境。采用實時熒光定量PCR法和Western blotting法檢測各組HIF-1α、TGF-β1、VEGF、bFGF mRNA和蛋白表達;采用Western blotting法檢測PI3K/Akt信號通路相關蛋白PI3K、p-PI3K、Akt、p-Akt表達。結果與空白對照組比較,低氧誘導組HIF-1α、VEGF、TGF-β1、bFGF mRNA和蛋白表達均明顯升高(P均<0.05);與NC-shRNA組比較,HIF-shRNA組上述指標mRNA和蛋白表達均明顯降低(P均<0.05)。與空白對照組比較,低氧誘導組p-PI3K、p-Akt蛋白表達明顯升高(P均<0.05);與NC-shRNA組比較,HIF-shRNA組p-PI3K、p-Akt蛋白表達明顯降低(P均<0.05);各組PI3K、Akt蛋白表達比較P均>0.05。結論低氧誘導HIF-1α表達可促進人鼻黏膜上皮細胞TGF-β1、VEGF、bFGF表達,干擾HIF-1α基因則抑制上述因子的表達;HIF-1α對上述因子的調控機制可能與其抑制PI3K/Akt信號通路有關。
鼻黏膜上皮細胞;低氧誘導因子1α;基因干擾;血管內皮生長因子;PI3K/Akt信號通路;低氧環境
組織重塑是多數慢性炎性疾病的病理特征之一[1,2],長期炎癥反應會持續損傷組織,而組織會針對持續性損傷啟動自我修復機制。但這種自我修復機制屬于不完全修復,會導致不可逆性組織結構異常,這也是變應性鼻炎、鼻息肉等鼻腔疾病發病的病理基礎之一。感染、炎癥等外界刺激均可引起局部組織耗氧增多,繼而導致組織缺氧。機體為適應這種缺氧狀態會激活一系列與缺氧有關的基因,以提高細胞對缺氧的適應性。低氧誘導因子1α(HIF-1α)是介導機體缺氧調控的主要轉錄因子之一[3]。HIF-1α具有廣泛的生物學功能,如缺氧適應、炎癥反應、血管新生等[4,5]。楊浩等[6]研究發現,在變應性鼻炎組織中HIF-1α表達上調,并可介導呼吸道重塑。尹文華等[7]研究認為,炎癥因子可誘導人鼻黏膜上皮細胞(HNEC)大量表達HIF-1α,并促進內皮細胞增殖和血管新生。但目前對HIF-1α調節HNEC的具體機制尚不完全清楚。2015年2月~2017年2月,本研究采用短發夾RNA(shRNA)技術干擾HNEC中HIF-1α基因表達,觀察其對轉化生長因子β1(TGF-β1)、血管內皮生長因子(VEGF)、堿性成纖維細胞生長因子(bFGF)表達的影響,并探討其可能的作用機制。
1 材料與方法
1.1 材料 HNEC,廣州吉妮歐生物科技有限公司。綠色熒光蛋白(GFP)標記的HIF-shRNA、無義寡核苷酸陰性對照(NC-shRNA),上海吉瑪制藥技術有限公司設計合成。LipofectamineTM2000脂質體,美國Invitrogen公司;TRIzol,廣州碧云天生物技術研究所;RT-PCR逆轉錄試劑盒,美國Bio-Rad公司。鼠抗人HIF-1α抗體,美國Santa Cruz公司;兔抗人TGF-β1抗體、兔抗人VEGF抗體、兔抗人bFGF抗體、鼠抗人PI3K抗體、兔抗人Akt抗體、鼠抗人p-Akt抗體、GAPDH抗體,武漢博士德生物工程有限公司;鼠抗兔IgG-辣根過氧化物酶(HRP)標記的二抗,美國Santa公司。
1.2 細胞分組處理 將HNEC接種于DEME培養基(含10% FBS、100 U/mL青霉素和100 U/mL鏈霉素),37 ℃、5% CO2細胞培養箱中孵育,當細胞貼壁且融合達75%時更換培養基,傳代培養。取傳3代對數生長期HNEC,制備細胞懸液并接種于6孔板,每孔1×104個。隨機將細胞分為空白對照組、NC-shRNA組、HIF-shRNA組和低氧誘導組。空白對照組正常培養,不予任何處理;NC-shRNA組加入NC-shRNA 4 μg和LipofectamineTM2000 10 μL;HIF-shRNA組加入HIF-shRNA 4 μg和LipofectamineTM2000 10 μL;NC-shRNA組、HIF-shRNA組于轉染24 h后加入100 μmol/L CoCl2溶液誘導低氧環境;低氧誘導組僅加入100 μmol/L CoCl2溶液模擬低氧環境。各組繼續培養2 h后更換DEME培養液。轉染48 h,取部分細胞,分別采用實時熒光定量PCR法、Western blotting法檢測HIF-1α mRNA和蛋白表達。結果見表1。低氧誘導組HIF-1α mRNA和蛋白表達明顯高于空白對照組,HIF-shRNA組HIF-1α mRNA和蛋白表達均明顯低于NC-shRNA組(P均<0.05)。表明低氧可誘導HIF-1α表達,而干擾HIF-1α基因可抑制HIF-1α表達,該方法可用于后續實驗。
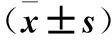
表1 各組HIF-1α mRNA和蛋白相對表達量比較
注:與空白對照組比較,*P<0.05;與NC-shRNA組比較,△P<0.05;與HIF-shRNA組比較,#P<0.05。
1.3 相關指標觀察
1.3.1 TGF-β1、VEGF、bFGF mRNA和蛋白表達 ①VEGF、TGF-β1、bFGF mRNA表達:采用實時熒光定量PCR法。取各組繼續培養48 h細胞,TRIzol法提取細胞總RNA,紫外分光光度計測定總RNA在260、280 nm波長處的吸光度(A)值,A260/A280為1.8~2.0,表明提取的總RNA純度合格。按PCR逆轉錄試劑盒說明將總RNA逆轉錄為cDNA,以cDNA為模板進行PCR擴增。引物序列:VEGF上游引物:5′-AGGGCAGAATCATGAGCAAGT-3′,下游引物:5′-AGGGTCTGCATTGGATGGCA-3′;TGF-β1上游引物:5′-CTAATGGTGGAAACCCAGAAGC-3′,下游引物:
5′-TATGCGGACGAATTGTTGCTG-3′;bFGF上游引物:5′-AGTGTCTGCTAACCGTTAGCT-3′,下游引物:5′-ACTGCCCAGTTCGTTTCAGTG-3′;GAPDH上游引物:5′-CACCATTGGCAATGAGGGGTTC-3′,下游引物:5′-AGGTCTTTGCGGATGTCCACGT-3′。PCR反應體系共20 μL:上下游引物各0.2 μL,SYBR Green Ⅰ premix 12 μL,雙蒸水5.6 μL,cDNA 2 μL;反應條件:95 ℃ 5 min,95 ℃ 30 s、60 ℃ 30 s共40個循環,最后72 ℃ 2 min。以GAPDH作為內參,按照2-ΔΔCt法計算目的基因相對表達量。②VEGF、TGF-β1、bFGF蛋白表達:采用Western blotting法。取各組繼續培養48 h細胞,RIPA裂解,4 ℃、12 000 r/min離心10 min,提取總蛋白,BCA法進行蛋白定量。將蛋白樣品與上樣緩沖液混勻,100 ℃水浴5 min變性;取變性的蛋白樣品50 μg,80 V電壓下進行SDS-PAGE,待樣品進入分離膠后改為120 V電壓,至溴酚藍跑至凝膠邊緣時終止電泳;常規濕法轉膜,5%脫脂牛奶封閉2 h;分別加入VEGF、TGF-β1、bFGF一抗,4 ℃孵育24 h;再加入辣根過氧化酶標記的鼠抗兔IgG二抗,37 ℃孵育2 h,PBS沖洗3次,洗膜、顯影、曝光。按照ECL化學發光顯影試劑盒顯影,凝膠成像系統掃描,Image Lab軟件分析蛋白電泳條帶的灰度值。以GAPDH作為內參照,以目的蛋白電泳條帶灰度值/內參蛋白電泳條帶灰度值作為目的蛋白相對表達量。
1.3.2 PI3K/Akt信號通路相關蛋白表達 采用Western blotting法。一抗分別為PI3K(1∶300)、p-PI3K(1∶300)、Akt(1:200)、p-Akt(1∶200)、GAPDH(1∶100),二抗辣根過氧化酶標記的鼠抗兔IgG(1∶100),其余步驟同上。
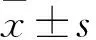
2 結果
2.1 各組VEGF、TGF-β1、bFGF mRNA和蛋白表達比較 見表2。
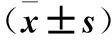
表2 各組VEGF、TGF-β1、bFGF mRNA和蛋白相對表達量比較
注:與空白對照組比較,*P<0.05;與NC-shRNA組比較,△P<0.05;與HIF-shRNA組比較,#P<0.05。
2.2 各組PI3K/Akt信號通路相關蛋白表達比較 見表3。
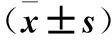
表3 各組PI3K、p-PI3K、Akt、p-Akt蛋白相對表達量比較
注:與空白對照組比較,*P<0.05;與NC-shRNA組比較,△P<0.05;與HIF-shRNA組比較,#P<0.05。
3 討論
目前已證實,HIF-1是細胞低氧反應的核心調控因子。HIF-1由兩個亞基組成,即HIF-1α、HIF-1β,HIF-1α是其活性亞基。既往研究顯示,長期呼吸道的變應性炎癥會引起呼吸道黏膜發生不可逆的組織結構重塑,導致局部缺氧加重[9,10]。靳春杰等[11]報道稱易感個體受體變應原刺激后,導致Th2細胞活化,誘發趨化因子和細胞因子釋放,肥大細胞脫顆粒和嗜酸性粒細胞聚集,氣道炎癥反應加重;而鼻腔局部的炎癥反應又會進一步刺激HIF-1誘表達上調。Watcharasit等[12]研究亦證實,在炎性因子、低氧等因素刺激下,鼻黏膜上皮細胞能夠產生HIF-1α和VEGF,促進內皮細胞增殖和血管新生。此外,HIF-1α還會誘導細胞分泌誘導型一氧化氮合酶,促進炎性組織通過血管壁進入組織,最終導致組織重塑而加重缺氧[13]。但目前對于HNEC中HIF-1α表達的調控機制,特別是其在相應信號通路中的作用鮮見報道。
生長因子如TGF-β1、VEGF、bFGF等,均與氣道重塑、炎性反應等密切相關。TGF-β1是重要的細胞外基質調控因子,在組織重塑方面發揮關鍵作用。VEGF可增加血管壁通透性,導致炎性因子滲透入血管外間隙,加重炎癥反應。bFGF參與形成細胞外基質和血管生成,在組織損傷修復、纖維化和介導炎癥反應過程中起重要作用。RNA干擾技術是近年興起的一種基因干擾技術,具有高效性、高特異性、易操作等特點,已廣泛用于基因功能研究。本研究采用RNA干擾技術干擾HNEC HIF-1α基因,結果發現缺氧模擬劑CoCl2能夠誘導HIF-1α表達,HIF-1α表達上調的HNEC中TGF-β1、VEGF、bFGF mRNA和蛋白表達明顯升高,而干擾HIF-1α基因的HNEC中TGF-β1、VEGF、bFGF mRNA和蛋白表達明顯降低。說明HIF-1α可能通過調控TGF-β1、VEGF、bFGF參與鼻黏膜細胞的炎癥反應和組織重塑。
目前,關于缺氧誘導HIF-1α表達的調控機制研究較少。有學者認為,缺氧能夠激活PI3K/Akt信號通路,誘導HIF-1α發生磷酸化,并調控下游靶基因的轉錄,提高細胞對微環境的適應性改變[14]。Wang等[15]采用LY294002(PI3K阻斷劑)抑制嗜酸性粒細胞PI3K/Akt通路,細胞HIF-1α及下游靶基因VEGF表達明顯減少,提示HIF-1α表達可能與PI3K/Akt信號通路有關。Li等[16]報道顯示,HIF-1α活化能夠誘導Akt和PI3K磷酸化,使HIF-1α降解減少和HIF-1α表達增加。此外,Akt磷酸化還能激活mTOR基因表達,從而促進VEGF轉錄。本研究結果顯示,低氧誘導HIF-1α表達上調,可以促進p-PI3K、p-Akt蛋白表達增加,從而激活PI3K/Akt信號通路;而干擾HIF-1α表達則抑制PI3K/Akt信號通路。因此認為,HIF-1α介導的VEGF、TGF-β1、bFGF表達變化可能是通過PI3K/Akt信號通路實現的。
綜上所述,低氧誘導HIF-1α表達可促進人鼻黏膜上皮細胞TGF-β1、VEGF、bFGF表達,干擾HIF-1α基因則抑制上述因子表達;HIF-1α的調控機制可能與其抑制PI3K/Akt信號通路有關。
[1] Bugdayci G, Kaymakci M, Bukan N. Matrix metalloproteinase-9 (MMP-9) in allergic nasal polyps[J]. Acta Histochem, 2010,112(1):92-95.
[2] 伯銘羽,王向東,王鴻,等.重塑相關因子在慢性鼻竇炎的表達[J].首都醫科大學學報,2013,34(6):785-789.
[3] Fujita N, Markova D, Anderson DG, et al. Expression of Prolyl Hydroxylases (PHDs) is selectively controlled by HIF-1 and HIF-2 proteins in nucleus pulposus cells of the intervertebral disc: Distinct roles of PHD2 and PHD3 proteins in controlling HIF-1α activity in hypoxia[J]. J Biol Chem, 2012,287(20):16975-16986.
[4] Thiersch M, Rimann M, Panagiotopoulou V, et al. The angiogenic response to PLL-g-PEG-mediated HIF-1α plasmid DNA delivery in healthy and diabetic rats[J]. Biomaterials, 2013,34(16):4173-4182.
[5] Maschio LB, Madallozo BB, Capellasso BA, et al. Immunohistochemical investigation of the angiogenic proteins VEGF, HIF-1α and CD34 in invasive ductal carcinoma of the breast[J]. Acta Histochem, 2014,116(1):148-157.
[6] 楊浩,張陽,范芳,等.HIF-1α、MVD及EGFR表達對鼻內翻性乳頭狀瘤惡變的診斷意義及紫杉醇干預效果分析[J].中國免疫學雜志,2015,31(12):1683-1687.
[7] 尹文華,劉素琴,陳志凌,等.缺氧誘導因子1α與黏蛋白5在慢性鼻-鼻竇炎組織中的表達與意義[J].中國耳鼻咽喉頭頸外科,2016,23(11):632-636.
[8] 中華醫學會耳鼻咽喉科學分會,中華耳鼻咽喉科雜志編輯委員會.慢性鼻竇炎鼻息肉臨床分型分期及內窺鏡鼻竇手術療效評定標準(1997年,海口)[J].中華耳鼻咽喉科雜志,1998,33(3):134-135.
[9] Park SJ, Kim TH, Jun YJ, et al. Chronic rhinosinusitis with polyps and without polyps is associated with increased expression of suppressors of cytokine signaling 1 and 3[J]. J Allergy Clin Immunol, 2013,131(3):772-780.
[10] Aksoy F, Yenigun A, Dogan R, et al. Investigation of the role of major respiratory viruses in the aetiology of nasal polyps using polymerase chain reaction technique[J]. J Laryngol Otol, 2014,128(4):356-359.
[11] 靳春杰,方貴龍,權偉,等.缺氧誘導因子-1α對創傷性腦損傷大鼠炎性反應和血管生成因子表達的影響[J].中華創傷雜志,2016,32(9):835-842.
[12] Watcharasit P, Suntararuks S, Visitnonthachai D, et al. β-catenin involvement in arsenite-induced VEGF expression in neuroblastoma SH-SY5Y cells[J]. Environ Toxicol, 2014,29(6):672-678.
[13] 祁蕾,苑博,傅強,等.缺氧/再復氧與脂多糖激活腸上皮細胞核轉錄因子-κB和低氧誘導因子-1α信號通路以及大黃素對其的干預作用[J].中華危重病急救醫學,2014,26(6):409-414.
[14] Fagani F, Jiang BH. Oxygen-independent regulation of HIF-1: novel involvement of PI3K/ AKT/mTOR pathway in cancer[J]. Curr Cancer Drug Targets, 2013,13(3):245-251.
[15] Wang F, Liu S, Xi S, et al. Arsenic induces the expressions of angiogenesis-related factors through PI3K and MAPK pathways in SV-HUC-1 human uroepithelial cells[J]. Toxicol Lett, 2013,222(3):303-311.
[16] Li GQ, Zhang Y, Liu D, et al. PI3 kinase/Akt/HIF-1α pathway is associated with hypoxia-induced epithelial-mesenchymal transition in fibroblast-like synoviocytes of rheumatoid arthritis[J]. Mol Cell Biochem, 2013,372(1-2):221-231.
黑龍江省自然科學基金青年基金資助項目(QC2010076)。
王維峰(E-mail: dr_wwf@163.com)
10.3969/j.issn.1002-266X.2017.44.012
R765.2
A
1002-266X(2017)44-0042-04
2017-06-24)

