羊水干細胞移植對單側輸尿管梗阻小鼠腎臟微血管損傷的影響及其機制
高芳,厲書林,孫東
(徐州醫科大學附屬醫院,江蘇徐州221002)
·基礎研究·
羊水干細胞移植對單側輸尿管梗阻小鼠腎臟微血管損傷的影響及其機制
高芳,厲書林,孫東
(徐州醫科大學附屬醫院,江蘇徐州221002)
目的探討羊水干細胞(AFSCs)移植對單側輸尿管梗阻(UUO)小鼠腎臟微血管損傷的影響及其可能的機制。方法選擇1例孕中期需進行產前篩查的孕婦,穿刺抽取羊水后分離、培養AFSCs,制備AFSCs懸液。將36只小鼠隨機分為假手術組、模型組和觀察組,每組12只。模型組和觀察組采用結扎的方法建立左側UUO模型,假手術組只游離輸尿管不結扎。觀察組腹部縫合后經尾靜脈注射150 μL AFSCs懸液,模型組和假手術組注射等量生理鹽水。三組術后第3、7天分別處死6只小鼠,采用HE染色觀察腎組織病理情況,免疫組化法檢測腎組織管周毛細血管密度,Western blotting法檢測腎組織尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(gp91-phox)、抗硝基酪氨酸(NT)蛋白表達。結果HE染色結果顯示:假手術組腎臟結構正常;模型組術后第3、7天出現不同程度的腎小管上皮細胞腫脹,空泡變性,刷狀緣消失,腎間質增寬,炎性細胞浸潤,腎間質纖維化程度隨時間延長而逐漸加重。觀察組術后第3、7天均出現腎間質纖維化,但其程度均輕于模型組同時間點。模型組、觀察組術后第3、7天腎組織管周毛細血管密度均低于假手術組同時間點,gp91-phox、NT蛋白相對比表達量均高于假手術組同時間點,但模型組變化更明顯(P均<0.05)。結論AFSCs移植可減輕單側UUO小鼠腎臟微血管損傷;通過降低gp91-phox、NT表達而減輕氧化應激是其可能的機制。
輸尿管梗阻;羊水干細胞;微血管損傷;尼克酰胺腺嘌呤二核苷酸磷酸氧化酶;抗硝基酪氨酸
干細胞是一類具有較強自我更新和定向分化能力的原始細胞,是組織、器官結構與功能再生的理想種子細胞,因此干細胞移植逐漸成為腎臟疾病修復再生的治療手段[1~3]。胚胎干細胞(ESCs)是一類未分化細胞,具有高度的自我復制能力,幾乎可以分化為人體內所有的組織器官,但因倫理學爭議及安全性問題導致其應用受到限制[4]。羊水干細胞(AFSCs)是比成體干細胞(ASCs)更原始的干細胞,其多能性介于ESCs和ASCs之間,可以向脂肪細胞、成骨細胞、神經原細胞等分化。維持腎臟微血管的數目及功能,對于減輕腎臟組織形態學損傷及腎功能惡化、延緩腎臟纖維化進程具有重要意義。尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(gp91-phox)與硝基酪氨酸(NT)均為氧化應激相關因子,其表達變化均可引起氧化應激及炎癥反應。2014年12月~2016年2月,本研究觀察了AFSCs移植對單側輸尿管梗阻(UUO)小鼠腎臟微血管損傷的影響。現將結果及其可能的機制報告如下。
1 材料與方法
1.1 材料 實驗動物:雄性裸小鼠36只,6~8周齡,體質量18~22 g,由徐州醫學院實驗動物中心提供,實驗期間小鼠自由飲水、攝食,飼料由徐州醫學院實驗動物中心提供。主要試劑:DMEM/F12培養基、DMEM高糖培養基、FBS均購于美國Gibco公司,胰蛋白酶、青霉素-鏈霉素溶液均購于上海碧云天生物技術研究所,抗gp91-phox兔多克隆抗體購于美國Abcam公司,抗NT鼠多克隆抗體購于美國Santa Cruz公司。
1.2 AFSCs分離及培養 選擇1例孕中期需進行產前篩查的孕婦,穿刺抽取羊水10 mL,1 200 r/min離心5 min,棄去上清液,下層沉淀即為AFSCs。將AFSCs使用DMEM/F12培養基進行培養,并加入15% FBS、4 ng/mL堿性成纖維細胞生長因子(bFGF)、100 μg/mL谷氨酰胺、1%雙抗。將細胞懸液接種于25 cm2培養瓶中,加入5 mL完全培養基,置于37 ℃、5% CO2溫箱中進行培養。待細胞融合至70%~80%后,加入0.05%酶-EDTA進行消化,按1∶3進行傳代培養,2~3天更換培養基。本研究通過醫院倫理委員會審核,孕婦及其家屬均知情同意。
1.3 建模與分組處理 將36只雄性昆明小鼠適應性喂養1周,隨機分為假手術組、模型組和觀察組,每組12只。模型組和觀察組采用結扎的方法[5]建立左側UUO模型;假手術組只游離輸尿管,不結扎。觀察組腹部縫合后經尾靜脈注射150 μL AFSCs懸液(AFSCs數量為3.5×105個),模型組和假手術組注射等量生理鹽水。三組于術后第3、7天分別處死6只小鼠,打開腹腔后迅速切除左腎,剝離腎包膜,冷生理鹽水沖洗干凈。取部分腎組織置于10%中性甲醛中固定,剩余腎組織-80 ℃保存備用。
1.4 相關指標觀察
1.4.1 腎組織病理情況 采用HE染色。取三組術后第3、7天中性甲醛固定后的腎組織標本,石蠟包埋,4 μm厚度切片。貼附于防脫載玻片上,60 ℃烤箱烘烤3 h。常規脫蠟至水,蘇木素染色,蒸餾水沖洗;待達到合適的染色程度,置于0.25%鹽酸乙醇中分化數秒,蒸餾水沖洗。1%氨水返藍,蒸餾水沖洗3次,于伊紅染液中浸染數十秒;顯微鏡下觀察染色程度,蒸餾水沖洗3 min×3次。梯度乙醇脫水,二甲苯透明,中性樹膠封片。400倍光學顯微鏡下觀察腎組織病理改變。
1.4.2 腎組織管周毛細血管(PTCs)密度 采用免疫組化法。取三組術后第3、7天中性甲醛固定后的腎組織標本,石蠟包埋,4 μm厚度切片。二甲苯脫蠟,梯度乙醇脫水,PBS清洗5 min×3次。枸櫞酸鹽緩沖液高壓水煮抗原修復,PBS清洗5 min×3次,3% H2O2孵育,消除內源性過氧化物酶,PBS清洗5 min×3次。進口羊血清工作液37 ℃ 封閉1 h,PBS浸洗5 min×3次。加入CD34一抗,4 ℃孵育過夜,室溫復溫30 min,PBS清洗5 min×3次;加入二抗,室溫孵育至少1 h。PBS搖床清洗5 min×3次。顯微鏡下DAB液顯色,蘇木素復染,1%鹽酸分化,脫水,透明,封片。400倍光學顯微鏡下觀察CD34表達情況,CD34陽性表達呈黃褐色,定位于腎臟間質。采用Image Pro Plus軟件分析其光密度值,以CD34表達的光密度值表示腎組織PTCs密度。
1.4.3 腎組織gp91-phox、NT蛋白表達 采用Western blotting法。取置于-80 ℃保存的腎臟組織,加入裂解液,冰浴中勻漿,4 ℃條件下以12 000 r/min離心15 min,所得上清即為組織蛋白提取液。采用BCA法,以牛血清白蛋白為標準品測得蛋白濃度。各組取配平后蛋白100 μg/10 μL于10%變性聚丙烯酰胺凝膠上,電泳后采用半干電轉移的方法將蛋白轉移至PVDF 膜上,置于封閉液(3% BSA)中室溫下封閉2 h。加入一抗(gp91phox稀釋倍數為1∶800,NT稀釋倍數為1∶200,內參β-actin稀釋倍數為1∶1 000),4 ℃過夜后常溫下復溫30 min,washing buffer洗滌5 min×3次;加入二抗室溫下孵育2 h,washing buffer洗滌5 min×3次。采用BCIP/NBT磷酸酶顯色試劑盒進行顯色,掃描儀分析條帶灰度值,以目的蛋白與內參蛋白(β-actin)條帶灰度值的比值作為蛋白相對表達量。
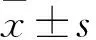
2 結果
2.1 三組腎組織病理情況比較 假手術組腎臟結構正常;模型組術后第3、7天出現不同程度的腎小管上皮細胞腫脹,空泡變性,刷狀緣消失,腎間質增寬,炎癥細胞浸潤,腎間質纖維化程度隨時間延長而逐漸加重。觀察組術后第3、7天均出現腎間質纖維化,但其程度均輕于同時間點模型組。
2.2 三組腎組織PTCs密度比較 見表1。
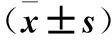
表1 三組腎組織PTCs密度比較
注:與假手術組同時間點比較,*P<0.05;與模型組同時間點比較,#P<0.05。
2.3 三組腎組織gp91-phox、NT蛋白表達比較 見表2。
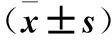
表2 三組腎組織gp91-phox、NT蛋白相對表達量比較
注:與假手術組同時間點比較,*P<0.05;與模型組同時間點比較,#P<0.05。
3 討論
腎間質纖維化與腎功能惡化密切相關,是各種慢性腎臟病長期遷延、最終進展到慢性腎衰竭的共同途徑和主要病理基礎[5]。近年來研究發現,腎臟微血管損傷對腎間質纖維化的進展具有不容忽視的作用[6]。在梗阻性腎病的發病過程中,腎臟組織血供減少,腎小管上皮細胞發生缺血缺氧性壞死和細胞凋亡;同時PTCs血流量減少,氧分壓降低,引起氧化應激反應,使活性氧(ROS)生成增加。ROS除可引起大分子(主要為脂質、蛋白質和DNA)氧化損傷外,還可促使PTCs損傷,腎實質細胞轉化為纖維母細胞,使細胞外基質沉積增加,間質纖維化程度加重,從而在腎間質纖維化的發生、發展中起重要作用[7,8]。PTCs損傷、丟失又可進一步導致局部組織缺血缺氧,引起氧化應激反應。由此可見,PTCs損傷、局部組織缺血缺氧在慢性腎臟病的進展中形成惡性循環,最終加快腎臟纖維化的進程[9,10]。
目前基因治療和干細胞治療的聯合應用已經成為再生醫學中的研究熱點。AFSCs因具有比其他干細胞更多的優勢而被廣泛應用于基因治療中,其優勢包括來源容易、具有多向分化潛能、易被外源基因轉染、表達穩定、低風險(抗免疫排斥和癌癥)、不受倫理限制等,被認為是最具潛力的基因治療方法之一。AFSCs具有分化為內、中、外3個胚層的潛能,并且表面能表達ESCs和ASCs表面標記物Oct-4[11~13]。PTCs是對維持腎小管正常形態結構、功能以及腎小球濾過功能起關鍵作用的微血管網。PTCs損傷可導致腎間質缺血、缺氧,進而加重纖維化。CD34抗原主要表達在毛細血管、小血管內皮細胞質中,能夠反映PTCs密度,是血管內皮細胞的可靠標志物。本研究結果顯示,模型組和觀察組腎組織CD34光密度值均低于假手術組,并出現腎間質纖維化,但模型組變化更明顯;表明AFSCs移植有助于增加單側UUO小鼠的腎臟微血管密度,修復受損腎臟微血管內皮,進而增加腎臟腎小管間質微循環,改善組織缺血缺氧的狀態,從而減輕腎間質纖維化。

綜上所述,AFSCs移植可減輕UUO小鼠腎臟微血管損傷;通過降低gp91-phox、NT表達而減輕氧化應激可能是其作用機制。
[1] Gorin Y, Block K, Hernandez J, et al. Nox4 NAD(P)H oxidase mediates hypertrophy and fibronectin expression in the diabetic kidney[J]. J Biol Chem, 2005,280(47):39616-39626.
[2] Hopkins C, Li J, Rae F, et al. Stem cell options for kidney disease[J]. J Pathol, 2009(217):265-281.
[3] Lange C, Togel F, Ittrich H, et al. Administered mesenchymal stem cells enhance recovery from ischemia/reperfusion-induced acute renal failure in rats[J]. Kidney Int, 2005,68(4):1613-1617.
[4] Hyun I. The bioethics of stem cell research and therapy[J]. J Clin Invest, 2010,120(1):71-75.
[5] Sun D, Bu L, Liu C, et al. Therapeutic effects of human amniotic fluid-derived stem cells on renal interstitial fibrosis in a murine model of unilateral ureteral obstruction[J]. PloS One, 2013,8(5):e65042.
[6] Zheng G, Lyons JG, Tan TK, et al. Disruption of E-cadherin by matrix metalloproteinase directly mediates epithelial-mesenchymal transition downstream of transforming growth factor-beta1 in renal tubular epithelial cells[J]. Am J Pathol, 2009,175(2):580-591.
[7] Kida Y, Tchao BN, Yamaguchi I. Peritubular capillary rarefaction: a new therapeutic target in chronic kidney disease[J]. Pediatr Nephrol, 2014,29(3):333-342.
[8] Bondi CD, Manickam N, Lee DY, et al. NAD(P)H oxidase mediates TGF-beta1-induced activation of kidney myofibroblasts[J]. J Am Soc Nephrol, 2010,21(1):93-102.
[9] Dendooven A, Ishola DA Jr, Nguyen TQ, et al. Oxidative stress in obstructive nephropathy[J]. Int J Exp Pathol, 2011,92(3):202-210.
[10] Morimoto R, Satoh F, Murakami O, et al. Expression of adrenomedullin 2/intermedin in human adrenal tumors and attached non-neoplastic adrenal tissues[J]. J Endocrinol, 2008,198(1):175-183.
[11] Wouters G, Grossi S, Mesoraca A, et al. Isolation of amniotic fluid-derived mesenchymal stem cells[J]. J Prenat Med, 2007,1(3):39-40.
[12] DeKoninck P, Toelen J, Zia S, et al. Routine isolation and expansion late mid trimester amniotic fluid derived mesenchymal stem cells in a cohort of fetuses with congenital diaphragmatic hernia[J]. Eur J Obstet Gynecol Reprod Biol, 2014(178):157-162.
[13] Kang NH, Hwang KA, Kim SU, et al. Potential antitumor therapeutic strategies of human amniotic membrane and amniotic fluid-derived stem cells[J]. Cancer Gene Ther, 2012,19(8):517-522.
[14] Qin J, Mei WJ, Xie YY, et al. Fluorofenidone attenuates oxidative stress and renal fibrosis in obstructive nephropathy via blocking NOX2 (gp91phox) expression and inhibiting ERK/MAPK signaling pathway[J]. Kidney Blood Press Res, 2015,40(1):89-99.
國家自然科學基金資助項目(81270769);江蘇省自然科學基金資助項目(BK20161172);江蘇省“十二五”醫學重點人才項目(RC2011116);江蘇省六大人才高峰項目(2010-WS043)。
孫東(E-mail: sundong126@yahoo.com)
10.3969/j.issn.1002-266X.2017.44.008
R693.2
A
1002-266X(2017)44-0029-03
2016-09-14)

