miR-106b在非小細胞肺癌細胞A549中的表達變化及意義
李磊,倪正義,湯中文,周密
(武漢市醫療救治中心,武漢430000)
miR-106b在非小細胞肺癌細胞A549中的表達變化及意義
李磊,倪正義,湯中文,周密
(武漢市醫療救治中心,武漢430000)
目的觀察miR-106b在非小細胞肺癌細胞A549中的表達變化,并探討其對細胞遷移、侵襲的影響及可能機制。方法采用熒光定量PCR法檢測非小細胞肺癌細胞A549及正常肺表皮細胞系HPL-1中miR-106b相對表達量。將非小細胞肺癌細胞A549分為miR-106b模擬物組、miR-106b抑制物組和陰性對照組,采用Lipofectamine 2000轉染法分別轉染miR-106b mimics、miR-106b inhibit及scramble。培養24 h,采用熒光定量PCR法檢測miR-106b相對表達量,進行細胞劃痕試驗、Transwell細胞侵襲試驗檢測細胞遷移和侵襲能力(分別以劃痕愈合率、穿膜細胞數表示),采用熒光定量PCR法和Western blotting法檢測墨角藻糖基轉移酶6(FUT6)mRNA及蛋白表達。結果非小細胞肺癌細胞A549及正常肺表皮細胞HPL-1中miR-106b相對表達量分別為5.37±0.42、1.00,二者比較P<0.01。miR-106b模擬物組、miR-106b抑制物組及陰性對照組miR-106b相對表達量分別為8.94±0.73、0.21±0.03、1.00,組間兩兩比較P均<0.05。miR-106b模擬物組、陰性對照組劃痕愈合率、穿膜細胞數均高于miR-106b抑制物組,FUT6 mRNA 及蛋白相對表達量均低于miR-106b抑制物組,但miR-106b模擬物組變化更明顯(P均<0.05)。結論非小細胞肺癌細胞A549中miR-106b表達升高;過表達miR-106b可能通過下調FUT6表達而促進非小細胞肺癌細胞的遷移與侵襲。
非小細胞肺癌;微小RNA-106b;細胞遷移;細胞侵襲;墨角藻糖基轉移酶6
據國際腫瘤研究機構統計,2012年約180萬人被診斷為肺癌,占所有惡性腫瘤的13%[1,2]。肺癌可分為小細胞肺癌和非小細胞肺癌,小細胞肺癌主要采用化療等全身治療,非小細胞肺癌可采用手術、化療等綜合治療,目前關于非小細胞肺癌的發病機制仍不十分清楚。微小RNA(miRNA)是一類非編碼長鏈RNA,長度為19~22 nt,可在轉錄后水平調控靶基因表達[3],廣泛參與腫瘤細胞的增殖、凋亡、侵襲及轉移等生物學過程[4,5]。miR-106b定位于染色體7q22.1上[6],其在非小細胞肺癌中的作用鮮見報道。2015年5月~2016年5月,本研究觀察了miR-106b在非小細胞肺癌細胞中的表達變化及其對細胞遷移、侵襲的影響,并探討其可能的機制。
1 材料與方法
1.1 材料 細胞:非小細胞肺癌細胞A549及正常肺表皮細胞HPL-1均購自協和醫科大學實驗中心。主要試劑:DMEM培養基、TRIzol試劑均購自美國Invitrogen公司,實驗所需一抗均購自美國BD公司,二抗購自武漢博士德生物科技有限公司。主要儀器:NanoDrop1000紫外分光光度計購自美國Thermo Scientific公司,7900HT熒光定量PCR系統購自美國Applied Biosystems公司,WimScratch在線圖像分析系統購于德國Wimasis GmbH公司。miR-106b mimics及scramble質檢均由廣州銳博生物科技有限公司合成。
1.2 A549細胞及HPL-1細胞miR-106b表達檢測 采用熒光定量PCR法。取A549細胞及HPL-1細胞,以1×103個接種于DMEM培養基(添加10% FBS),37 ℃、5% CO2條件下,培養48 h,待細胞長至鋪滿培養皿后,加入細胞裂解液,TRIzol試劑提取總RNA,采用NanoDrop1000紫外分光光度計檢測RNA濃度合格。采用7900HT熒光定量PCR儀進行PCR反應。引物序列:miR-106b正向引物:5′-CCTGCCGGGGCTAAAGTGCT-3′,反向引物:5′-TGCTGGAGCAGCAAGTACCC-3′,引物長度20 bp。內參β-actin正向引物: 5′-TGGCACCCAGCACAATGAA-3′, 反向引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′,引物長度19 bp。PCR反應體系:1×Taq Buffer 2 μL,MgCl21.2 μL,dNTP 0.2 μL,上下游引物各0.4 μL, cDNA模板 1 μL,DEPC水14.7 μL,Taq酶0.1 μL。反應條件:95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火1 min,72 ℃延伸45 s,4 ℃條件下共40個循環。以2-ΔΔCt法計算miR-106b相對表達量。
1.3 A549細胞分組處理 將A549細胞以2×103/孔的密度接種于24孔板(DMEM培養基),置于37 ℃、5% CO2培養箱中,培養48 h后進行傳代。將對數生長期的A549細胞隨機分為miR-106b模擬物組、miR-106b抑制物組及陰性對照組,采用Lipofectamine 2000脂質體轉染試劑盒分別轉染miR-106b mimics、miR-106b inhibit及scramble,轉染RNA濃度為300 nmol/孔。
1.4 miR-106b表達檢測 取處理24 h的三組細胞,采用熒光定量PCR法檢測miR-106b相對表達量。具體步驟同1.2。
1.5 細胞遷移能力檢測 采用細胞劃痕試驗。將三組細胞以2×104個/孔接種于6孔板中,培養24 h。待細胞融合至100%后,用滅菌槍頭沿直線用力劃直線。劃痕后即刻及48 h后在顯微鏡下觀察細胞劃痕修復情況,使用WimScratch在線圖像分析系統檢測細胞劃痕面積,計算劃痕愈合率。劃痕愈合率=(劃痕后即刻劃痕面積-劃痕后48 h劃痕面積)/劃痕后即刻劃痕面積×100%。實驗重復3次,取平均值。劃痕愈合率越高,表示細胞遷移能力越強。
1.6 細胞侵襲能力檢測 采用Transwell細胞侵襲試驗。將三組細胞以3×104個/孔接種于Transwell小室的碳酸磷脂表面,上室BioCoat TM包被Matrigel基質膠,37 ℃培養24 h。取出上層小室,將膜下面的細胞與1%多聚甲醛混合,用0.2%結晶紫溶液染色15 min。光學顯微鏡下隨機取10個視野,計數進入膜下的細胞數量(下稱穿膜細胞數)。實驗重復3次,取平均值。
1.7 細胞墨角藻糖基轉移酶6(FUT6)mRNA及蛋白表達檢測 ① FUT6 mRNA表達:采用熒光定量PCR法。取三組對數生長期細胞,參照1.2的步驟采用熒光定量PCR法檢測三組細胞FUT6 mRNA相對表達量。FUT6上游引物:5′-AAGATGAAACAGA-TCTGGAC-3′,下游引物:5′-CACGATGACGAAACTGCAGT-3′;內參GAPDH上游引物:5′-TATGCTCTCCTCATGCATTG-3′,下游引物: 5′-GGGACGACCTTC-GATCTACC-3′。②FUT6蛋白表達:采用Western blotting法。取三組對數生長期細胞,待細胞融合至100%后,加入裂解液提取細胞總蛋白,以每孔30 μg總蛋白上樣,常規濕法轉膜,5%脫脂奶粉封閉2 h。分別加入FUT6、GAPDH一抗過夜,抗體稀釋度均為1∶200;加入二抗山羊抗鼠(1∶1 000)孵育2 h。ECL化學發光,凝膠成像系統顯影。采用Quantity One 1-D分析軟件對蛋白質印跡條帶進行定量。以目的蛋白與GAPDH條帶灰度值的比值作為FUT6蛋白相對表達量。
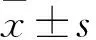
2 結果
2.1 A549細胞及HPL-1細胞miR-106b表達比較 A549細胞及HPL-1細胞miR-106b相對表達量分別為5.37±0.42、1.00,二者比較P<0.01。
2.2 三組miR-106b表達比較 miR-106b模擬物組、miR-106b抑制物組及陰性對照組miR-106b相對表達量分別為8.94±0.73、0.21±0.03、1.00,組間兩兩比較P均<0.05。
2.3 三組細胞遷移、侵襲能力比較 miR-106b模擬物組、陰性對照組劃痕愈合率、穿膜細胞數均高于miR-106b抑制物組,但miR-106b模擬物組升高更明顯(P均<0.05)。見表1。
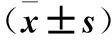
表1 三組劃痕愈合率、穿膜細胞數比較
注:與陰性對照組比較,*P<0.05;與miR-106b抑制物組比較,#P<0.05。
2.4 三組FUT6 mRNA及蛋白表達比較 miR-106b模擬物組、陰性對照組FUT6 mRNA 及蛋白相對表達量均低于miR-106b抑制物組,但miR-106b模擬物組降低更明顯(P均<0.05)。見表2。
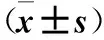
表2 三組FUT6 mRNA及蛋白相對表達量比較
注:與陰性對照組比較,*P<0.05;與miR-106b抑制物組比較,#P<0.05。
3 討論
腫瘤的發生、發展是多種癌基因與抑制基因突變的結果,包括p53[7]、p21[8]、miRNA[5]等。miRNA屬于非編碼長鏈RNA,長度為19~22 nt,可在轉錄后水平通過與靶基因結合而下調靶基因表達。miRNA廣泛參與腫瘤細胞的增殖、凋亡、侵襲及轉移等生物學過程[4,5]。miR-106b是miR-106b-25家族中的一員[6],在膀胱癌[9]、腎細胞癌[10]、喉癌[11]、肝細胞癌[12]細胞中表達升高,而在子宮內膜癌[13]細胞中表達降低。腎細胞癌組織miR-106b表達較癌旁正常組織升高,應用miR-106b抑制劑轉染腎細胞癌細胞系后,可抑制其增殖、遷移,誘導細胞凋亡[14]。Yang等[15]報道,miR-106b在胃癌細胞中高表達,并可促進胃癌細胞侵襲和遷移,與患者預后密切相關。miR-106b在乳腺癌細胞中呈高表達,與淋巴結轉移相關;miR-106b可激活Wnt信號通路,并介導β-鏈蛋白(β-catenin)入核,進而增強乳腺癌細胞的侵襲和遷移能力[16]。miR-106b還可抑制Smad7蛋白表達,激活轉化生長因子α(TGF-α)TGF-α/Smad信號通路,進而誘導乳腺癌細胞發生上皮間質轉化[17]。在卵巢癌細胞中,miR-106b呈高表達,并通過靶向結合DAB2基因、促進TGF-α表達而參與卵巢癌細胞遷移[18]。結腸癌細胞miR-106b表達高于正常結腸細胞,miR-106b高表達與結腸癌患者的臨床分期及淋巴結轉移相關,可能通過靶向結合DLC1基因而促進結腸癌細胞遷移和侵襲[19]。miR-106b在垂體瘤細胞中高表達,雙熒光素酶實驗顯示miR-106b與PTEN 基因的3′-UTR區靶向結合,通過PI3K/AKT信號通路而調控腫瘤細胞的增殖與侵襲[20]。與之相反,miR-106b在甲狀腺癌細胞中呈低表達,雙熒光素酶實驗顯示miR-106b可與C1orf24基因靶向結合,并誘導甲狀腺癌細胞凋亡、抑制細胞侵襲[21]。以上研究結果提示miR-106b在不同的腫瘤中可能具有不同的作用。
本研究結果顯示,A549細胞miR-106b相對表達量明顯高于HPL-1細胞,提示miR-106b在非小細胞肺癌細胞中呈高表達,與其在胃癌、乳腺癌、腎細胞癌、卵巢癌、結腸癌及垂體瘤組織中的表達變化一致[14~20]。本研究結果顯示,miR-106b模擬物組、陰性對照組劃痕愈合率、穿膜細胞數均高于miR-106b抑制物組,但miR-106b模擬物組升高更明顯;說明升高miR-106b表達可促進A549細胞的遷移和侵襲,miR-106b在非小細胞肺癌的發生過程中具有促癌基因的作用。FUT6是墨角藻糖基轉移酶家族中的一員,在乳腺癌細胞中呈低表達,上調FUT6表達可降低乳腺癌細胞系MDA-MB-231增殖、侵襲和遷移能力[22]。在肝癌細胞系中,siRNA 靶向沉默FUT6可降低腫瘤相關抗原sLeX表達及人肝癌細胞株HepG2的遷移和侵襲能力[23]。本研究結果顯示,miR-106b模擬物組、陰性對照組FUT6 mRNA 及蛋白相對表達量均低于miR-106b抑制物組,但miR-106b模擬物組降低更明顯;說明升高miR-106b表達可降低A549細胞FUT6表達,FUT6可能是miR-106b的負向靶控基因。
綜上所述,A549細胞中miR-106b升高;過表達miR-106b可能通過下調FUT6表達而促進A549細胞的遷移與侵襲。miR-106b可能成為非小細胞肺癌的一個新的治療靶點,但是其促進A549細胞遷移、侵襲的相關機制以及FUT6是否為miR-106b的靶基因仍需進一步探討。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Chen W, Zheng R, Zeng H, et al. The incidence and mortality of major cancers in China, 2012[J]. Chin J Cancer, 2016,35(1):73.
[3] Lee RC, Ambros V. An extensive class of small RNAs in caenorhabditis elegans[J]. Science, 2001,294(5543):862-864.
[4] Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay[J]. Nat Rev Genet, 2010,11(9):597-610.
[5] 李振華,黃瑊,胡振紅,等.miR-124對非小細胞肺癌細胞遷移和侵襲的影響及機制[J].山東醫藥,2016,56(22):18-20.
[6] Carvalheira G, Nozima BH, Cerutti JM. microRNA-106b-mediated down-regulation of C1orf24 expression induces apoptosis and suppresses invasion of thyroid cancer[J]. Oncotarget, 2015,6(29):28357-28370.
[7] 張玨,蔡鴻寧,高晗,等.不同卵巢腫瘤組織中KI-67、P53、C23、EGFR 蛋白的表達變化及其意義[J].山東醫藥,2016,56(19):67-69.
[8] 陳宏偉,王春華,李軍良,等.肝細胞肝癌組織中p21 活化蛋白激酶6的表達及意義[J].山東醫藥,2014,54(20):65-67.
[9] Ratert N, Meyer HA, Jung M, et al. miRNA profiling identifies candidate mirnas for bladder cancer diagnosis and clinical outcome[J]. J Mol Diagn, 2013,15(5):695-705.
[10] Slaby O, Jancovicova J, Lakomy R, et al. Expression of miRNA-106b in conventional renal cell carcinoma is a potential marker for prediction of early metastasis after nephrectomy[J]. J Exp Clin Cancer Res, 2010,29(7):90.
[11] Cai K, Wang Y, Bao X. MiR-106b promotes cell proliferation via targeting RB in laryngeal carcinoma[J]. J Exp Clin Cancer Res, 2011,30(8):73.
[12] Li BK, Huang PZ, Qiu JL, et al. Upregulation of microRNA-106b is associated with poor prognosis in hepatocellular carcinoma[J]. Diagn Pathol, 2014,9(1):226.
[12] Dong P, Kaneuchi M, Watari H, et al. MicroRNA-106b modulates epithelial-mesenchymal transition by targeting TWIST1 in invasive endometrial cancer cell lines[J]. Mol Carcinog, 2014,53(5):349-359.
[14] Li Y, Chen D, Su Z, et al. MicroRNA106b functions as an oncogene in renal cell carcinoma by affecting cell proliferation, migration and apoptosis[J]. Mol Med Rep, 2016,13(2):1420-1426.
[15] Yang TS, Yang XH, Chen X, et al. MicroRNA-106b in cancer-associated fibroblasts from gastric cancer promotes cell migration and invasion by targeting PTEN[J]. FEBS Lett, 2014,588(13):2162-2169.
[16] Gong C, Qu S, Lv XB, et al. BRMS1L suppresses breast cancer metastasis by inducing epigenetic silence of FZD10[J]. Nat Commun, 2014,19(5):5406.
[17] Smith AL, Iwanaga R, Drasin DJ, et al. The miR-106b-25 cluster targets Smad7, activates TGF-α signaling, and induces EMT and tumor initiating cell characteristics downstream of Six1 in human breast cancer[J]. Oncogene, 2012,31(50):5162-5171.
[18] Cheng Y, Guo Y, Zhang Y, et al. MicroRNA-106b is involved in transforming growth factor α1-induced cell migration by targeting disabled homolog 2 in cervical carcinoma[J]. J Exp Clin Cancer Res, 2016,35(1):1.
[19] Zhang G, Li J, Zhou H, et al. MicroRNA-106b promotes colorectal cancer cell migration and invasion by directly targeting DLC1[J]. J Exp Clin Cancer Res, 2015,34(30):73.
[20] Zhou K, Zhang T, Fan Y D, et al. MicroRNA-106b promotes pituitary tumor cell proliferation and invasion through PI3K/AKT signaling pathway by targeting PTEN[J]. Tumor Biol, 2016,37(10):13469-13477.
[21] Carvalheira G, Nozima BH, Cerutti JM. microRNA-106b-mediated down-regulation of C1orf 24 expression induces apoptosis and suppresses invasion of thyroid cancer[J]. Oncotarget, 2015,6(29): 28357-28370.
[22] Li N, Liu Y, Miao Y, et al. MicroRNA‐106b targets FUT6 to promote cell migration, invasion, and proliferation in human breast cancer[J]. IUBMB life, 2016, 68(9):764-775.
[23] 李錦良,陳德,向廣陽,等.SiRNA沉默FUT6基因對HepG2細胞侵襲和遷移能力的影響[J].實用醫學雜志,2014,30(20):3229-3232.
ExpressionchangesofmiR-106binnon-small-celllungcancercelllineA549
LILei,NIZhengyi,TANGZhongwen,ZHOUMi
(WuhanMedicalTreatmentCenter,Wuhan430000,China)
ObjectiveTo observe the expression changes of miR-106b in non-small-cell lung cancer (NSCLC) cell line A549, and to investigate its effects on cell migration and invasion, as well as the regulatory mechanism.MethodsThe expression level of miR-106b was measured in A549 and HPL-1 cells by the fluorescent quantitative PCR. A549 cells were divided into three groups. The miR-106b mimics group was transfected with miR-106b mimics, the miR-106b inhibition group with miR-106b inhibit, and the control group with scramble. The relative expression level of miR-106b was measured by real-time fluorescent quantitative PCR (qRT-PCR) at 24 h after culture. The migration and invasion abilities in the three groups were measured by Scratch test and Transwell invasion assay. The expression levels of FUT6 mRNA and protein were measured in these three groups by fluorescent quantitative PCR and Western blotting, respectively.ResultsThe expression level of miR-106b in the A549 cells was 5.37±0.42, which was higher than that of HPL-1 cells (1.0),P<0.01. The expression level of miR-106b was 8.94±0.73 in the miR-106b mimics group, 0.21±0.03 in the miR-106b inhibit group and 1.0 in the control group, respectively, and the difference was significant, allP<0.05. The wound healing rate and the number of invasive cells in the miR-106b mimics group and control group were significantly higher than those of the miR-106 inhibition group, while the expression levels of FUT6 mRNA and protein were significantly lower than those in the miR-106b inhibit group, and the change in the miR-106b mimics group was more significance (allP<0.05).ConclusionThe miR-106b is up-regulated in the NSCLC A549 cells and the over-expression of miR-106b promotes the migration and invasion of NSCLC by down-regulating FUT6 expression.
non-small-cell lung cancer; microRNA-106b; cell migration; cell invasion; fucosyltransferase VI
武漢市應用基礎研究計劃項目。
李磊(1979-),男,主治醫師,研究方向為肺癌的基礎與臨床。E-mail: lileiwuhan899@126.com
周密(1974-),男,副主任醫師,研究方向為肺癌的基礎與臨床。E-mail: mizhou768@126.com
10.3969/j.issn.1002-266X.2017.44.006
R734.2
A
1002-266X(2017)44-0022-04
2017-03-27)

