獨活寄生湯含藥血清對膝關節OA大鼠滑膜細胞TNF-α、IL-6、IL-8、IL-10表達的影響及其機制
杜津莉,樊煒駿,李建,陳少青,孫鵬
(1天津中醫藥大學第一附屬醫院,天津300193;2內蒙古民族大學附屬醫院)
獨活寄生湯含藥血清對膝關節OA大鼠滑膜細胞TNF-α、IL-6、IL-8、IL-10表達的影響及其機制
杜津莉1,樊煒駿1,李建1,陳少青2,孫鵬1
(1天津中醫藥大學第一附屬醫院,天津300193;2內蒙古民族大學附屬醫院)
目的探討獨活寄生湯含藥血清對膝關節骨關節炎(OA)大鼠滑膜細胞炎癥因子表達的影響及其可能機制。方法采用Hulth法建立OA大鼠模型,分離膝關節滑膜細胞,采用酶原消化法進行培養,并將其分為模型組及低、中、高劑量組,以正常大鼠膝關節滑膜細胞為對照組。低、中、高劑量組分別加入經獨活寄生湯中藥0.85、1.7、3.4 mL/kg灌胃大鼠的含藥血清,對照組與模型組加入等量20% FBS,培養48 h。采用ELISA法檢測各組細胞TNF-α、IL-6、IL-8及IL-10表達,超高效液相色譜-高分辨質譜法檢測各組細胞脂氧素A4表達,Western blotting法檢測各組細胞抗c-Jun氨基末端激酶(JNK)、磷酸化JNK(p-JNK)、激活子蛋白1(AP-1)及磷酸化AP-1(p-AP-1)表達。結果對照組、高劑量組、中劑量組、低劑量組和模型組細胞TNF-α、IL-6、IL-8表達均依次升高,IL-10、脂氧素A4表達依次降低,組間兩兩比較P均<0.05。與對照組比較,模型組細胞AP-1、p-AP-1、JNK及p-JNK表達均升高(P均<0.05);與模型組比較,高、中、低劑量組細胞AP-1、p-AP-1、JNK及p-JNK表達均降低,且高劑量組降低更明顯(P均<0.05)。結論獨活寄生湯含藥血清可降低膝關節OA大鼠滑膜細胞TNA-α、IL-6、IL-8、IL-10表達,并呈劑量依賴性;提高滑膜細胞脂氧素A4表達、抑制JNK、AP-1及其磷酸化通路可能是其作用機制。
骨關節炎;膝關節;獨活寄生湯;滑膜細胞;脂氧素A4;炎癥反應;大鼠
60歲以上男性骨關節炎(OA)發病率約為9.6%,女性發病率約為18%[1]。OA的病理表現為關節軟骨變性及丟失,最易受累的關節為膝關節[2]。中醫認為,膝關節OA屬于“骨痹”、“膝痹”范疇,多為肝腎虧虛、外感寒濕所致[3]。獨活寄生湯具有祛風濕、止痹痛、益肝腎、補氣血之功效,既往關于獨活寄生湯治療膝關節OA的臨床效果及其對關節軟骨細胞作用的研究較多[4],但其對滑膜細胞的影響鮮見報道。2016年8~12月,本研究觀察了獨活寄生湯含藥血清對膝關節OA大鼠滑膜細胞炎癥因子表達的影響,現分析結果并探討其可能的機制。
1 材料與方法
1.1 材料 實驗動物:雄性Wistar大鼠60只,6周齡,體質量(180±5)g,由天津中醫藥大學醫學動物實驗中心提供,動物合格證號:SCXK(津)2009-002。主要試劑:抗激活子蛋白1(AP-1)、抗磷酸化AP-1(p-AP-1)、抗c-Jun氨基末端激酶(JNK)、抗磷酸化JNK(p-JNK)、抗β-肌動蛋白(β-actin)購于美國Abcam公司,TNF-α、IL-6、IL-8、IL-10 ELISA試劑盒購于中國欣博盛生物科技有限公司。主要儀器:5804R高速冷凍離心機購于德國Eppendorf公司,光學顯微鏡購于日本Olympus公司。
1.2 獨活寄生湯含藥血清制備 獨活寄生湯方藥組成:獨活9 g,桑寄生6 g,當歸6 g,茯苓6 g,黨參6 g,熟地黃6 g,防風6 g,秦艽6 g,白芍6 g,川牛膝6 g,川芎6 g,制川烏6 g (先煎),細辛6 g,甘草6 g,由天津中醫藥大學附屬醫院中藥制劑室濃縮煎制成濃度為1 g/mL的藥液。選擇雄性Wistar大鼠30只,隨機分為三組,每組10只。按照人鼠體表面積比值進行換算[3],分別給予獨活寄生湯中藥0.85、1.7、3.4 mL/kg灌胃,1次/d,連續給藥14天。末次給藥2 h后處死,于無菌條件下采集腹主動脈血5 mL,靜置2 h。4 ℃條件下2 000 r/min離心10 min,分離血清,分別記為低、中、高劑量含藥血清。56 ℃水浴滅活,-80 ℃冰箱保存備用。
1.3 滑膜細胞提取及鑒定 隨機選擇雄性Wistar大鼠15只,采用Hulth法建立膝關節OA模型,方法如下:無菌條件下于大鼠膝關節內側縱行切開約2 cm,眼科剪剪斷內側副韌帶及前、后交叉韌帶,僅保留關節軟骨面;縫合切口后不固定傷肢,腹腔注射青霉素鈉3×104U預防感染[5]。術后給予正常飲食,自由活動。造模4周處死,切取膝關節OA大鼠滑膜組織,清洗后用眼科無菌剪剪成約1 mm3小塊。加入含10% FBS的Ⅱ型膠原酶約6 mL,消化3 h,吹打細胞懸濁液、離心;加入2 mL DMEM培養液,200目篩網過濾、離心。棄上清后加入4 mL DMEM培養液,吹打混勻細胞沉淀。選擇正常雄性Wistar大鼠15只,參照上述方法分離滑膜細胞。取分離的膝關節OA大鼠及正常大鼠的滑膜細胞,培養48 h,光鏡下觀察細胞形態;4%多聚甲醛固定,PBS緩沖液沖洗,采用免疫組化法檢測滑膜細胞標志性蛋白(波形蛋白)表達,所有操作嚴格參照說明書進行。結果顯示,細胞以梭型為主,細胞波形蛋白表達呈陽性,符合滑膜細胞形態及特征。
1.4 細胞分組處理 取對數生長期的膝關節OA大鼠滑膜細胞接種于6孔板中,調整細胞密度為5×104個/孔,將細胞隨機分為模型組及低、中、高劑量組。低、中、高劑量組細胞分別加入1.2中保存備用的低、中、高劑量含藥血清1 mL,24 h更換一次同樣的含藥血清,共培養48 h。模型組加入等量20% FBS,培養48 h。取對數生長期的正常大鼠滑膜細胞作為對照組,接沖6孔板,調整細胞密度為5×104個/孔,加入等量20% FBS,培養48 h。
1.5 細胞TNF-α、IL-6、IL-8及IL-10表達檢測 采用ELISA法。培養48 h,采用ELISA試劑盒檢測各組細胞TNF-α、IL-6、IL-8及IL-10表達。所有操作嚴格參照說明書進行,試劑盒靈敏度均為1 pg/mL。實驗重復3次,取平均值。
1.6 細胞脂氧素A4表達檢測 采用超高效液相色譜-高分辨質譜法。培養48 h,各組細胞采用PBS緩沖液清洗2次,液氮鋪滿培養孔,待液氮蒸發后,每孔加入0.75 mL甲醇-水溶液(體積比4∶1)。用細胞刮刀刮下細胞,經三氯甲烷萃取溶液中的脂溶性成分,沉淀后上層用等體積乙腈沉淀蛋白,加入0.1%甲酸水溶液復溶,采用超高效液相色譜-高分辨質譜法進行分析。色譜柱柱溫40 ℃,流動相:(A)含0.1%甲酸的水溶液;(B)甲醇流動相梯度組成:1~3 min,8%~85%流動相B;3~6 min,85%~100%流動相B;6~8 min,100%流動相B;8~9 min, 100%~8%流動相B;9~11 min,8%流動相B。流速0.5 mL/min;樣品進樣量10 μL。質譜分析條件:ESI離子源,采用正、負離子模式。正離子模式:毛細管電壓2.6 kV,錐孔電壓60 V,離子源、霧化溫度分別為110、470 ℃,殼氣流速900 L/h;負離子模式:毛細管電壓2.6 kV,錐孔電壓40 V,離子源、霧化溫度分別為70、160 ℃,殼氣流速550 L/h;亮氨酸腦啡肽做為質譜內標,采用甲酸鈉校正質量軸。采用Masslynx V4.1軟件進行峰提取、峰對齊及歸一化處理,通過HMDB及METLIN等精確質量檢索數據庫[6]確定脂氧素A4相對分子質量。采用正交偏最小二乘判別法計算脂氧素A4表達,實驗重復3次,取平均值。
1.7 細胞AP-1、p-AP-1、JNK及p-JNK表達檢測 采用Western blotting法。作用48 h,取各組細胞,加入RIPA裂解液及蛋白酶抑制劑PMSF,提取蛋白質,測定濃度合格。取15 μL蛋白進行10% SDS-PAGE,常規轉膜后脫脂奶粉封閉;加入抗AP-1、抗p-AP-1、抗JNK或抗p-JNK一抗(稀釋比例分別為1∶1 000、1∶500、1∶500、1∶500),4 ℃孵育過夜,TBST洗脫5 min×3次;加入辣根過氧化酶標記的二抗,室溫孵育2 h,TBST洗脫10 min×3次,ECL化學發光顯像[7]。采用Image J軟件分析條帶灰度值,以目的蛋白與內參蛋白β-actin灰度值的比值計算目的蛋白的相對表達量。實驗重復3次,取平均值。
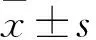
2 結果
2.1 各組細胞TNF-α、IL-6、IL-8及IL-10表達比較 見表1。
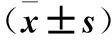
表1 各組細胞TNF-α、IL-6、IL-8及IL-10表達比較
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05;與中劑量組比較,▽P<0.05。
2.2 各組細胞脂氧素A4表達比較 對照組、高劑量組、中劑量組、低劑量組和模型組細胞脂氧素A4表達分別為27.47±5.08、24.78±2.37、16.12±1.47、13.48±2.1、5.63±2.62,組間兩兩比較P均<0.05。
2.3 各組細胞AP-1、p-AP-1、JNK及p-JNK表達比較 見表2。
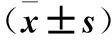
表2 各組細胞AP-1、p-AP-1、JNK及p-JNK相對表達量比較
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05;與低劑量組比較,△P<0.05;與中劑量組比較,▽P<0.05。
3 討論
既往研究認為,OA的主要發病機制為軟骨降解及關節邊緣骨贅形成[8]。近年來滑膜細胞在OA發病及進展中的作用逐漸受到重視[9]。滑膜細胞可通過自分泌和旁分泌的方式產生大量炎癥因子,從而干擾軟骨生成和加速軟骨基質降解,進而誘發OA臨床癥狀和疾病進展[10]。因此,抑制滑膜細胞炎癥因子分泌可能成為治療或輔助治療OA的新方向。獨活寄生湯由獨活、桑寄生、杜仲、牛膝等15味中藥組成,是《備急千金方》中治療下肢痹痛的經典方劑。鄺高艷等[11]采用獨活寄生湯治療OA患者838例,結果顯示獨活寄生湯治療OA療效肯定,且不良反應較少。另有研究報道,獨活寄生湯可抑制關節液中IL-6、TNF-α、基質金屬蛋白酶1(MMP-1)表達,減輕炎癥反應對關節軟骨的破壞[12]。
脂氧素A4是目前為止人類發現具有廣泛抗炎作用的脂質類抗炎遞質之一[13]。已有研究證實,脂氧素A4與關節炎的發生有著廣泛而密切的聯系[14]。Alexander等[15]研究證實,脂氧素A4可抑制JNK信號通路激活,進而抑制微血管的炎癥滲出及炎性因子表達。Bitto等[16]研究證實,脂氧素A4可通過降低JNK及p-JNK的表達減少炎性因子TNF-α、IL-6生成,同時提高抗炎因子IL-10 表達。Wu等[17]研究發現,脂氧素A4可抑制JNK激活,進而降低AP-1表達并減少其向細胞核轉移,從而降低IL-6、IL-8等炎性因子表達。TNF-α可通過降解軟骨基質、提高其他炎性因子活性、促進骨膜細胞產生前列腺素E2等多個方面破壞膝關節軟骨組織[18]。IL-6可抑制骨糖蛋白合成,并促進成纖維細胞和基質微分子的降解,從而加重軟骨損傷[19]。IL-8是目前已知作用最強的中性粒細胞趨化因子,可由滑膜細胞本身分泌,促使炎癥細胞向炎癥部位募集,增強對關節軟骨的損傷作用[20];抑制滑膜細胞中IL-8表達有可能成為延緩OA發病進程的關鍵因素。IL-10在OA的發病中具有雙重作用,一方面當OA滑膜細胞具有炎癥反應時,高表達的IL-10可抑制TNF-α、IL-6生成,另一方面IL-10可以抑制單核巨噬細胞釋放免疫介質,從而保護OA軟骨細胞[21]。
本研究結果顯示,對照組、高劑量組、中劑量組、低劑量組和模型組細胞TNF-α、IL-6、IL-8表達均依次升高,IL-10表達均依次降低;說明獨活寄生湯含藥血清可抑膝關節OA大鼠滑膜細胞炎性因子分泌,并呈劑量依賴性。本研究模型組細胞AP-1、p-AP-1、JNK及p-JNK表達均高于對照組,脂氧素A4表達均低于對照組,說明脂氧素A4表達下降可能通過升高AP-1、JNK及其磷酸化水平而促進滑膜細胞分泌炎性因子,從而參與OA的發生與發展。本研究高、中、低劑量組細胞中AP-1、p-AP-1、JNK及p-JNK表達均低于模型組,脂氧素A4表達高于模型組,且高劑量組變化更明顯,說明獨活寄生湯含藥血清可提高OA滑膜細胞脂氧素A4表達,降低JNK、AP-1及其磷酸化水平,并呈劑量依賴性。
綜上所述,獨活寄生湯含藥血清可降低膝關節OA大鼠滑膜細胞炎癥因子表達,并呈劑量依賴性;提高滑膜細胞脂氧素A4表達、抑制JNK、AP-1及其磷酸化通路可能是其作用機制。
[1] Woolf AD, Pfleger B. Burden of major musculoskeletal conditions[J]. Bull World Health Organ, 2003,81(9):646-656.
[2] 張磊,孫德昱.雙醋瑞因聯合獨活寄生湯治療中老年膝骨性關節炎[J].中國實驗方劑學,2013,19(2):299-302.
[3] 蘭平文,沈彬.TGF-β/BMP信號通路在骨關節炎軟骨細胞退變中的作用機制[J].中華關節外科雜志(電子版),2015,9(5):644-647.
[4] 車萍,季旭明,梁粟,等.獨活寄生湯對佐劑性關節炎大鼠的抗炎鎮痛作用及血清中5-HTP, 5-HIAA的影響[J].中國實驗方劑學雜志,2014,20(19):170-173.
[5] 袁琴,闞衛兵,宋鵬飛,等.補腎活血方對大鼠膝骨關節炎滑膜細胞β-catenin、MMP-7的影響[J].中國骨傷,2012,25(9):761-765.
[6] 王曦燁,單曉彤,王伊林,等.丹參多酚酸鹽改善擴張性心肌病心肌功能的作用機制[J].高等學校化學學報,2016,37(5):844-851.
[7] 王伊林,趙雅君,楊洋,等.磷酸肌酸鈉對慢病毒介導Calumenin蛋白沉默阿霉素損傷心肌細胞內質網應激信號通路的作用[J].臨床心血管病雜志,2015,31(10):1119-1122.
[8] Goncalves FB, Rocha FA, Albuquerque RP, et al. Reproducibility assessment of different descriptions of the kellgren and lawrence classification for osteoarthritis of the knee[J]. Rev Bras Ortop, 2016,510(6):687-691.
[9] 許傳勇,宋鵬飛,闞衛兵,等.塞來昔布膠囊對大鼠膝骨性關節炎滑膜細胞β-catenin和基質金屬蛋白酶-7的影響[J].廣東醫學,2013,34(5):678-681.
[10] 吳廣文,陳俊,葉錦霞,等.透骨消通膠囊含藥血清對膝骨關節炎滑膜細胞uPA系統及炎性因子的影響[J].中國組織工程研究,2015,19(16):6005-6009.
[11] 鄺高艷,嚴可,柴爽,等.獨活寄生湯加減治療膝骨關節炎療效及安全性的Meta分析[J].中醫藥導報,2016,22(17):59-62.
[12] 李軍,王朝陽.獨活寄生湯對兔膝骨性關節炎關節液腫瘤壞死因子-α、白介素-6和基質金屬蛋白酶-1水平的影響[J].中國老年學雜志,2012,32(5):1002-1003.
[13] Romano M. Lipoxin and aspirin-triggered lipoxins[J]. Scientific World J, 2010,10(2):1048-1064.
[14] 程璐璐,陳朝輝,張慧,等.脂氧素與類風濕關節炎的相關性研究[J].中國免疫學雜志,2016,32(11):1721-1724.
[15] Alexander Q, Ereso MD, Victorino MD, et al. Lipoxin A4 attenuates microvascular fluid leak during inflammation[J]. J Surg Res, 2009,156(2):183-188.
[16] Bitto A, Minutoli L, Altavilla D, et al. Flavocoxid a dual inhibitor of COX-2 and 5-LOX of natural origin, attenuates the inflammatory response and protects mice from sepsis[J]. Critical Care, 2012,16(1):32.
[17] Wu SH, Liao PY, Chen ZQ, et al. Signal pathway involved in inhibition by lipoxin A4 of production of interleukins induced in endothelial cells by lipopolysaccharide[J]. Inflamm Res, 2008,57(9):430-437.
[18] 陳元良,張濤,鐘海波.骨碎補總黃酮對骨性關節炎血清IL-1、IL-8及TNF-α表達的影響[J].陜西中醫,2013,34(9):1251-1253.
[19] 張新玉,黃炳倉,無墅,等.影像學檢查與細胞因子與膝骨關節炎患者病情活動的相關性研究[J].臨床和實驗醫學雜志,2015,14(13):1082-1085.
[20] 羅心靜,莫選榮,周玲玲.Hsp72對類風濕關節炎滑膜細胞IL-6、IL-8表達及NF-kB活化的影響[J].中國應用生理學雜志,2012,28(4):336-339.
[21] 潘建科,羅斌,郭達,等.龍鱉膠囊對膝骨關節炎大鼠IL-1β、IL-6、IL-10水平的影響[J].中華中醫藥雜志,2015,30(5):1675-1679.
EffectofDuhuoJishengdecoctiondrug-containingserumonexpressionofsynovialcellTNA-α,IL-6,IL-8,IL-10inkneeosteoarthritisrats
DUJinli1,FANWeijun,LIJian,CHENShaoqing,SUNPeng
(1TheFirstTeachingHospitalofTianjinUniversityofTraditionalChineseMedicine,Tianjin200193,China)
ObjectiveTo observe the effect of Duhuo Jisheng decoction drug-containing serum on the expression of inflammatory factors in synovial cells of knee osteoarthritis (OA) rats and to explore its possible mechanism.MethodsThe rat model of OA was established by Hulth method. The synovial cells of knee joint were cultured by enzymatic digestion. The synovial cells were divided into the model group and low-dose, medium-dose and high-dose groups. The normal rat synovial cells were used as the control group. The rats in the low-dose, medium-dose and high-dose groups were added with the serum containing Duhuo Jisheng decoction 0.85, 1.7 and 3.4 mL/kg by gavage, respectively, while rats in the control group and the model group were given the same amount of 20% fetal bovine serum, and then both of them were cultured for 48 h. The levels of TNF-α, IL-6, IL-8, and IL-10 were detected by ELISA. The expression of lipoxin A4 was detected by high performance liquid chromatography-high resolution mass spectrometry. Western blotting was used to detect the expression of Anti-c-Jun amino terminal kinase (JNK) , p-JNK, activator protein 1 (AP-1), and p-AP-1 expression.ResultsThe expression levels of TNF-α, IL-6, and IL-8 in the control group, high-dose group, medium-dose group, low-dose group, and model group gradually increased, the expression levels of IL-10 and lipoxin A4 gradually decreased, and significant difference was found between every two groups (allP<0.05). Compared with the control group, the expression levels of AP-1, p-AP-1, JNK, and p-JNK in the model group increased (allP<0.05). Compared with the model group, the expression levels of AP-1, p-AP-1, JNK, and p-JNK gradually decreased in the high-dose, medium-dose and low-dose groups, and the decrease was more significant in the high-dose group (allP<0.05).ConclusionDuhuo Jisheng decoction can reduce the expression of TNA-α, IL-6, IL-8, IL-10 in the synovial cells of knee OA rats in a dose-dependent manner by inhibiting JNK, AP-1 and its phosphorylation pathway and increasing the expression of lipoxin A4 in synovial cells.
osteoarthritis; knee; Duhuo Jisheng decoction; synovial cells; lipoxy A4; inflammatory response; rats
內蒙古自治區自然科學基金資助項目(2016MS08125)。
杜津莉(1980-),女,主治醫師,研究方向為脊柱、關節疾病的發病機制及治療。E-mail: zydujinli@126.com
陳少青(1980-),男,副主任醫師,研究方向為脊柱、關節疾病的發病機制及治療。E-mail: jxtgteam@163.com
10.3969/j.issn.1002-266X.2017.44.004
R684.3
A
1002-266X(2017)44-0014-04
2017-01-16)

