FAM92A1-289對人腦膠質瘤U251細胞增殖、遷移能力的影響及其與Galectin-1的關系
吳慕禹,郭興榮,李東升
(1湖北醫藥學院附屬太和醫院,湖北十堰442000;2湖北醫藥學院第二臨床學院)
FAM92A1-289對人腦膠質瘤U251細胞增殖、遷移能力的影響及其與Galectin-1的關系
吳慕禹1,2,郭興榮1,李東升1
(1湖北醫藥學院附屬太和醫院,湖北十堰442000;2湖北醫藥學院第二臨床學院)
目的探討FAM92A1-289對人腦膠質瘤U251細胞增殖、遷移能力的影響及其與半乳糖凝集素1(Galectin-1)的關系。方法將CMV-SP6-TALEN-GFP-289質粒轉染至U251細胞中,通過嘌呤霉素篩選得到穩定過表達FAM92A1-289基因的腦膠質瘤U251/289++細胞株。取腦膠質瘤U251/289++細胞作為觀察組,未轉染質粒的野生型U251細胞作為對照組,采用實時無標記動態細胞分析技術檢測兩組培養24、48、72、96、120 h的細胞增殖能力(以光密度值表示),采用Transwell小室試驗檢測兩組細胞遷移能力(以穿膜細胞數表示)。構建PCS2-3Flag-Galectin-1質粒,將人腦膠質瘤U251細胞隨機分為FAM92A1-289組、Galectin-1組、共轉染組及空白對照組,FAM92A1-289組、Galectin-1組均采用Lipofactamine 3000轉染法分別轉染CMV-SP6-TALEN-GFP-289質粒、PCS2-3Flag-Galectin-1質粒,共轉染組同時轉染上述兩種質粒,空白對照組僅加入Lipofactamine 3000轉染試劑。采用免疫共沉淀實驗驗證FAM92A1-289與Galectin-1是否存在相互作用。結果兩組培養24 h光密度值比較差異無統計學意義(P>0.05);觀察組培養48、72、96、120 h光密度值均高于對照組(P<0.05或<0.01)。觀察組與對照組穿膜細胞數分別為(242.0±11.41)、(65.40±7.92)個,兩組比較P<0.01。共轉染組抗GFP蛋白相對表達量明顯高于FAM92A1-289組、Galectin-1組及空白對照組(P均<0.01)。結論過表達FAM92A1-289可提高人腦膠質瘤U251細胞增殖和遷移能力;FAM92A1-289與Galectin-1之間的相互作用可能為FAM92A1-289調控人腦膠質瘤U251細胞惡性行為的作用機制。
腦膠質瘤;U251細胞;FAM92A1-289;半乳糖凝集素1;細胞增殖;細胞遷移
腦膠質瘤占顱腦腫瘤總數的一半以上,WHO根據組織病理學標準按照惡性程度將其分為Ⅰ~Ⅳ級[1]。Ⅳ級腦膠質瘤又稱膠質母細胞瘤,惡性程度最高、患者預后最差,患者經手術切除以及放化療等綜合治療后的中位生存期僅14個月[2]。分子靶向治療是將患者腦膠質瘤組織或瘤細胞中存在的某些特殊分子與相應抗體結合,進一步發生反應產生具有特異性的靶點,并通過該類特異性靶點有效殺死腦膠質瘤細胞[3]。FAM92A1-289是從腫瘤細胞中發現并克隆的一個FAM92A1新轉錄變異體基因[4]。本課題組前期研究發現,FAM92A1-289在增殖旺盛的腫瘤細胞、干細胞及癌組織中表達均較高,尤其在胚胎期腦組織中表達極高,而在正常腦組織中表達很低[5],推測FAM92A1-289基因可能與腫瘤細胞增殖等惡性行為相關。半乳糖凝集素1(Galectin-1)是半乳糖凝集素(Galectins)家族蛋白中最先被發現的一員,其表達量與腦膠質瘤的惡性程度呈正比[6]。Galectin-1可以通過與解聚素金屬蛋白酶15[7]、基質金屬蛋白酶2(MMP-2)、MMP-9[8]及β1整合素[9]相互作用而提高腦膠質瘤細胞的遷移能力,通過促進血管內皮生長因子分泌而提高腦膠質瘤細胞的增殖能力[10]。故研究FAM92A1-289與Galectin-1之間的相互作用有助于加深理解FAM92A1-289對腦膠質瘤細胞增殖、遷移能力影響的可能作用機制。2016年4月~2017年4月,本研究觀察了FAM92A1-289對膠質瘤細胞增殖及遷移能力的影響,現分析結果并探討其可能的作用機制。
1 材料與方法
1.1 材料 細胞:人腦膠質瘤U251細胞及人胚胎腎293T細胞均購自美國菌種典藏中心。主要試劑:DMEM培養液、Opti-MEM培養液均購自美國Gibco公司,總RNA提取TRIzol試劑購自美國LifeTechnologies公司,FastQuant cDNA第一鏈合成試劑盒購自天根生化科技(北京)有限公司,Flag Beads購自美國Sigma公司,單克隆鼠抗人Flag、GAPDH抗體及單克隆兔抗人GFP抗體均購自北京蘭博利德商貿有限公司,青霉素、鏈霉素、胎牛血清、胰酶消化液、SDS-PAGE凝膠快速配制試劑盒、抗鼠及抗兔二抗均購自武漢碧云天生物技術有限公司。主要儀器:Transwell小室購自美國Corning公司,電轉儀購自日本NEPA GENE公司,電轉杯及凝膠成像系統均購自美國Bio-Rad公司。
1.2 穩定過表達FAM92A1-289基因的腦膠質瘤U251/289++細胞株構建及鑒定
1.2.1 腦膠質瘤U251/289++細胞株構建 將人腦膠質瘤U251細胞以1.0×105個/孔的密度接種于含2 mL DMEM完全培養基的6孔板中,置于37 ℃、5% CO2培養箱中孵育,取處于對數生長期的生長狀態良好的細胞用于以下實驗。參照本課題組前期研究[11]的方法構建帶綠色熒光蛋白(GFP)的CMV-SP6-TALEN-289質粒,命名為CMV-SP6-TALEN-GFP-289質粒。將CMV-SP6-TALEN-289質粒用電穿孔的方法轉染入人腦膠質瘤U251細胞內,并采用嘌呤霉素篩選出陽性細胞。方法如下:取1×106個人腦膠質瘤U251細胞與8 μg CMV-SP6-TALEN-GFP-289質粒在Opti-MEM無血清培養基中混勻,130 V電壓轉染后將混合液取出,加入完全培養基,置于37 ℃、5% CO2培養箱中孵育,對照孔加入未轉染質粒的野生型人腦膠質瘤U251細胞。加入4 μg/μL嘌呤霉素作用10~14天,直至對照孔的野生型細胞完全死亡。取出轉染CMV-SP6-TALEN-GFP-289質粒的人腦膠質瘤U251細胞,置于200倍顯微鏡下觀察其生長情況。結果顯示,轉染CMV-SP6-TALEN-GFP-289質粒的人腦膠質瘤U251細胞生長狀態良好,證實成功構建腦膠質瘤U251/289++細胞株。
1.2.2 腦膠質瘤U251/289++細胞株鑒定 ①GFP表達:取1.2.1中嘌呤霉素篩選得到的陽性細胞株,置于100倍熒光顯微鏡下觀察GFP表達情況,結果顯示均呈現綠色熒光,表明均正確表達GFP。②FAM92A1-289 mRNA表達:采用RT-PCR法。取1.2.1中嘌呤霉素篩選得到的陽性細胞株作為觀察組,未轉染質粒的野生型人腦膠質瘤U251細胞作為對照組。加入細胞裂解液,采用TRIzol試劑提取細胞總RNA,按反轉錄試劑盒說明書合成cDNA。以cDNA作為模板進行PCR擴增。PCR引物:FAM92A1-289上游引物:5′-GACATTAACTGGCATTGTG-3′,下游引物:5′-GCTGTGACTGTGTAGA-3′;內參β-actin上游引物:5′-ATGGCAACGGTCGACA-3′,下游引物:5′-GACGGCGACAACGCA-3′。PCR反應條件:95 ℃預變性5 min;95 ℃變性30 s,58 ℃退火45 s,72 ℃延伸30 s,共30個循環;72 ℃、10 min。采用Image Lab軟件測量積分光密度(IOD),目的基因相對表達量以FAM92A1-289基因IOD與內參β-actin IOD的比值表示。結果顯示,觀察組與對照組FAM92A1-289 mRNA相對表達量分別為0.596±0.026、0.059±0.006,兩組比較P<0.01。③FAM92A1-289蛋白表達:采用Western blotting法。參照②的方法進行分組,提取各組細胞總蛋白,以20 μL/孔上樣量進行10% SDS-PAGE蛋白分離,將電泳分離的蛋白電轉移至PVDF膜上,5%脫脂奶粉室溫封閉2 h;TBST洗滌3次,每次5 min;分別加入GFP抗體(1∶1 000稀釋)、GAPDH抗體(1∶1 000稀釋),4 ℃孵育過夜;TBST洗滌3次,每次5 min;加入堿性磷酸過氧化物酶標記的人抗兔及抗鼠二抗(1∶1 000稀釋)室溫孵育2 h;TBST洗滌3次,每次5 min;將PVDF膜顯影并在凝膠成像系統上成像,以GAPDH為內參,參照②的方法計算目的蛋白相對表達量。結果顯示,觀察組與對照組GFP-FAM92A1-289蛋白相對表達量分別為0.602±0.036、0,兩組比較P<0.01。證實構建的腦膠質瘤U251/289++細胞株可穩定過表達FAM92A1-289基因。
1.3 細胞增殖能力檢測 采用實時無標記動態細胞分析技術。取兩組細胞,均以3×103個/孔的密度接種于含DMEM完全培養基的12孔板中。將兩組細胞同時置于實時無標記動態細胞分析儀器中,設置每孔所含細胞量、細胞量監測頻率及總監測時長等參數,待儀器校準后開始實時監測。記錄兩組細胞培養24、48、72、96、120 h的光密度(OD)值,以此表示細胞增殖能力。每組設3個復孔,取平均值。
1.4 細胞遷移能力檢測 采用Transwell小室試驗。取兩組細胞,均計數5×104個細胞加入Transwell小室上室中,用無血清培養基正常培養,小室下加入含10%FBS的完全培養基。作用24 h,將小室取出用PBS沖洗,95%乙醇固定30 min,0.2%結晶紫染液染色1 h。顯微鏡下觀察并拍照,隨機選取5個視野計數穿膜細胞數,以此表示細胞遷移能力。每組設3個復孔,取平均值。
1.5 FAM92A1-289與Galectin-1的相互作用驗證
1.5.1 PCS2-3Flag-Galectin-1真核表達質粒構建 在美國國立生物技術信息中心中查詢Galectin-1基因的CDS區,設計上下游兩條引物并擴增其全長序列。利用AscⅠ、FseⅠ酶對PCS2-3Flag載體和Galectin-1全長cDNA片段進行雙酶切,將得到的純化DNA片段進行連接、轉化,搖菌擴大培養后,提取PCS2-3Flag-Galectin-1真核表達質粒進行質粒堿基序列測序,檢測其是否存在堿基的缺失、突變等情況。雙酶切及質粒堿基序列測序結果顯示,質粒雙酶切后分為載體和目的基因兩條線性條帶,各條帶大小與預期相符;質粒沒有任何堿基的缺失和突變,堿基序列完全正確。
1.5.2 PCS2-3Flag-Galectin-1真核表達質粒鑒定 取對數生長期的人胚胎腎293T細胞,分別轉染或未轉染PCS2-3Flag-Galectin-1質粒,作用24 h后提取細胞總蛋白,Flag抗體按1∶1 000稀釋,Western blotting過程及目的蛋白相對表達量計算均參照1.2.2中③的方法。結果顯示,轉染和未轉染PCS2-3Flag-Galectin-1質粒的293T細胞3Flag-Galectin-1蛋白相對表達量分別為1.678±0.065、0,兩組比較P<0.01。
1.5.3 免疫共沉淀驗證 將人腦膠質瘤U251細胞接種到6孔板中,待細胞長至70%~80%時,隨機分為FAM92A1-289組、Galectin-1組、共轉染組及空白對照組。FAM92A1-289組、Galectin-1組均采用Lipofactamine 3000轉染法分別轉染CMV-SP6-TALEN-GFP-289質粒、PCS2-3Flag-Galectin-1質粒,共轉染組共轉染上述兩種質粒,空白對照組僅加入Lipofactamine 3000轉染試劑。作用24 h收集各組細胞,置于250 μL含1% TritonX-100的蛋白裂解液冰上裂解,離心后取30 μL上清加入蛋白上樣緩沖液,100 ℃作用10 min作為Input。將7 μL含Flag抗體的Beads顆粒分別加入剩余上清中,4 ℃搖床上過夜孵育,次日去除上清,在沉淀的Beads顆粒中加入蛋白上樣緩沖液,100 ℃作用15 min作為IP。將Input和IP分別進行10% SDS-PAGE、轉膜,5%脫脂奶粉封閉,加入一抗4 ℃搖床孵育過夜,加入二抗室溫搖床孵育2 h后AP顯影成像,記錄各組蛋白條帶的灰度值。
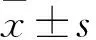
2 結果
2.1 兩組細胞增殖能力比較 兩組培養24 h時OD值比較差異無統計學意義(P>0.05);觀察組培養48、72、96、120 h時OD值均高于對照組(P<0.05或<0.01)。見表1。
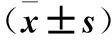
表1 兩組細胞增殖能力比較
注:與對照組比較,*P<0.05,#P<0.01。
2.2 兩組細胞遷移能力比較 觀察組與對照組穿膜細胞數分別為(242.0±11.41)、(65.40±7.92)個,兩組比較P<0.01。
2.3 FAM92A1-289與Galectin-1的相互作用 Input中1、2號條帶結果顯示GFP-FAM92A1-289與3Flag-Galectin-1均得到正確表達,表示兩種質粒的單轉染與共轉染均成功。IP中3號條帶為Flag Beads骨架,為IP的內參;5號條帶結果顯示3Flag-Galectin-1成功結合到Flag Beads顆粒上;4號條帶結果顯示,共轉染組抗GFP蛋白相對表達量為0.317±0.010,FAM92A1-289組、Galectin-1組及空白對照組均為0。見圖1。

注:A為空白對照組;B為FAM92A1-289組;C為Galectin-1組;D為共轉染組。
圖1FAM92A1-289與Galectin-1蛋白相互作用的免疫共沉淀驗證結果
3 討論
腦膠質瘤是最常見的顱內腫瘤,具有高發病率、高致死率[1]。腦膠質瘤具有細胞結構混雜、增殖能力及侵襲力強、高耐藥性等特性,給該疾病的臨床治療帶來了巨大的挑戰[2]。FAM92A1是一個高度保守的基因,目前發現其有10個轉錄變異體,編碼一組小分子的核蛋白[4]。FAM92A1-289是Ruan等[4]2007年從腫瘤細胞中發現并克隆的一個FAM92A1新轉錄變異體基因,同時也是其最大的一個變異體,編碼289個氨基酸核蛋白。EST分析顯示,FAM92A1-289在人體發育各個階段、多種正常組織及癌組織中均有表達[5]。而且FAM92A1-289在增殖旺盛的腫瘤細胞、干細胞及癌組織中表達較高,尤其在胚胎期腦組織中表達極高,而在正常腦組織表達很低[6]。因此,我們推斷FAM92A1-289可能調控腫瘤細胞的惡性生物學行為。目前FAM92A1-289的功能仍不明確,已知的功能主要包括:①抑制腫瘤細胞增殖:采用RNAi技術下調FAM92A1-289表達可改變HeLa細胞周期分布,可使細胞阻滯于S期,表明FAM92A1-289可能通過調控細胞周期抑制腫瘤細胞增殖[13,14];②促進腫瘤細胞增殖:腎癌OS-RC-2細胞過表達FAM92A1-289,其單克隆形成能力及裸鼠成瘤能力均顯著提高[15];白血病患者預后與該基因表達呈負相關,表明FAM92A1-289基因具有促進腫瘤增殖作用[16]。以上研究結果說明,FAM92A1-289基因可能在細胞增殖調控中發揮重要作用,但該基因是促進還是抑制細胞增殖目前還存在爭議。
目前關于FAM92A1-289基因在腦膠質瘤發生、發展中的作用鮮見報道。本研究通過體外轉染質粒、嘌呤霉素篩選及mRNA、蛋白兩個水平的分子鑒定,最終成功構建了穩定過表達FAM92A1-289的膠質瘤U251/289++細胞株,并觀察其對膠質瘤細胞增殖和侵襲能力的影響。結果顯示,觀察組培養48、72、96、120 h OD值均高于對照組,觀察組穿膜細胞數高于對照組;表明穩定過表達FAM92A1-289能明顯促進膠質瘤U251細胞的增殖及遷移能力,提示FAM92A1-289是一個促進腦膠質瘤細胞增殖與遷移的基因。
前期研究中酵母雙雜交實驗發現,FAM92A1-289可能與Galectin-1存在相互作用[12]。Galectin-1屬于Galectin家族蛋白,廣泛存在于人體組織及細胞內,可與半乳糖苷特異性結合,在細胞黏附、增殖、凋亡等多種病理生理過程中發揮重要作用[17]。大量研究發現,Galectin-1在許多腫瘤組織中表達明顯上調,并且其表達量的改變與腫瘤細胞增殖、遷移和侵襲性能力有關[18~22]。為了進一步探討FAM92A1-289調控U251細胞增殖和遷移能力的作用機制,我們利用免疫共沉淀驗證Galectin-1與FAM92A1-289是否存在相互作用。結果顯示,共轉染組抗GFP蛋白相對表達量明顯高于FAM92A1-289組、Galectin-1組及對照組,證實Galectin-1存在時FAM92A1-289才能被共沉淀,表明FAM92A1-289與Galectin-1在真核細胞內存在相互作用。
綜上所述,過表達FAM92A1-289可提高腦膠質瘤U251細胞增殖和遷移能力,FAM92A1-289與Galectin-1之間的相互作用可能是FAM92A1-289調控腦膠質瘤細胞惡性行為的作用機制。
[1] Lefranc F, Brotchi J, Kiss R. Possible future issues in the treatment of glioblastomas: special emphasis on cell migration and the resistance of migrating glioblastoma cells to apoptosis[J]. J Clin Oncol, 2005,23(10):2411-2422.
[2] Chen YP, Zhang Y, Lv JW, et al. Genomic analysis of tumor microenvironment immune types across 14 solid cancer types: immunotherapeutic implications[J]. Theranostics, 2017,7(14):3585-3594.
[3] 杜春霞,楊林,周愛萍,等.重組人血管內皮抑素聯合一線化療治療晚期結直腸癌的臨床觀察[J].中國腫瘤臨床與康復,2015,23(9):1029-1033.
[4] Ruan XZ, Yan F, Zhao XY, et al. Identification and characterization of two novel variants of the DUF1208 protein FAM92A1[J]. Mol Cells, 2007,23(3):391-397.
[5] Ruan XZ, Yang HS, Yao SH, et al. Isolation and characterization of a novelXenopus gene (xVAP019) encoding a DUF1208 domain containing protein[J]. Mol Reprod Dev, 2007,74(12):1505-1513.
[6]Gunnersen JM, Spirkoska V, Smith PE, et al. Growth and migration markers of rat C6 glioma cells identified by serial analysis of gene expression[J]. Glia, 2000,32(2):146-154.
[7] Camby I, Decaestecker C, Lefranc F, et al. Galectin-1 knocking down in human U87 glioblastoma cells alters their gene expression pattern[J]. Biochem Biophys Res Commun, 2005,335(1):27-35.
[8] Chiang WF, Liu SY, Fang LY, et al. Overexpression of galectin-1 at the tumor invasion front is associated with poor prognosis in early-stage oral squamous cell carcinoma[J]. Oral Oncol, 2008,44(4):325-334.
[9] Fortin S, Le Mercier M, Camby I, et al. Galectin-1 is implicated in the protein Kinase C epsilon/Vimentin-controlled trafficking of integrin-beta1 in Glioblastoma cells[J]. Brain Pathol, 2008,35(3):2-3.
[10] Fischer I, Gagner JP, Law M, et al.Angiogenesis in gliomas: biology and molecular pathophysiology[J]. Brain Pathol, 2005,15:297-310.
[11] Gui H, Guo XR, Fang J, et al. The tumor-promoting effects of FAM92A1-289 in cervical carcinoma cells[J]. Anticancer Res, 2016,36(10):5197-5204.
[12] 沈君豪,方娟,郭興榮,等.酵母雙雜交技術篩選宮頸癌HeLa細胞cDNA文庫中FAM92A1-289關聯蛋白[J].山東醫藥,2016,56(19):1-4.
[13] 陳潔,李瑞明,方娟,等.siRNA-FAM92A1-289對HeLa細胞增殖的影響[J].湖北醫藥學院學報,2011,30(2):105-108.
[14] Liau LM, Black KL, Prins RM, et al. Treatment of intracranial gliomas with bone marrow-derived dendritic cells pulsed with tumor antigens[J]. J Neurosurg, 1999,90(6):1115-1124.
[15] Zappasodi R, Pupa SM, Ghedini GC, et al. Improved clinical outcome in indolent B-Cell lymphoma patients vaccinated with autologous tumor cells experiencing immunogenic death[J]. Cancer Res, 2010,70(22):9062-9072.
[16] Qin EY, Cooper DD, Abbott KL, et al. Neural precursor-derived pleiotrophin mediates subventricular zone invasion by glioma[J]. Cell, 2017,170(5):845-859.
[17] Camby I, Belot N, Rorive S, et al. Galectins are differentially expressed in supratentorial pilocytic astrocytomas, astrocytomas, anaplastic astrocytomas and glioblastomas, and significantly modulate tumor astrocyte migration[J]. Brain Pathol, 2001,11(1):12-26.
[18] Camby I, Belot N, Lefranc F, et al. Galectin-1 modulates human glioblastoma cell migration into the brain through modifications to the actin cytoskeleton and levels of expression of small GTPases[J]. J Neuropathol Exp Neurol, 2002,61(7):585-596.
[19] Camby I, Le Mercier M, Lefranc F, et al. Galectin-1: a small protein with major functions[J]. Glycobiology, 2006,16(11):137-157.
[20] Cárcamo C, Pardo E, Oyanadel C, et al. Galectin-8 binds specific β1integrins and induces polarized spreading highlighted by asymmetric lamellipodia in Jurkat T cells[J]. Exp Cell Res, 2006,312(4):374-386.
[21] D′Abaco GM, Kaye AH. Integrins: molecular determinants of glioma invasion[J]. J Clini Neurosci, 2007,4(11):1041-1048.
[22] Schulz H, Schmoeckel E, Kuhn C, et al. Galectins-1, -3, and -7 are prognostic markers for survival of ovarian cancer patients[J]. Int J Mol Sci, 2017,18(6):1230.
EffectsofFAM92A1-289onproliferationandmigrationofgliomacellsU251anditsrelationshipwithgalectin-1
WUMuyu1,GUOXingrong,LIDongsheng
(1TaiheHospital,HubeiUniversityofMedicine,Shiyan442000,China)
ObjectiveTo explore the function of FAM92A1-289 in regulating the proliferation and migration of glioma cells U251 and its relationship with galectin-1.MethodsWe transfected the plasmid CMV-SP6-TALEN-GFP-289 into U251 cells, and used puromycin to get the stable cell line U251/289++with over-expression of FAM92A1-289 gene. We took U251/289++cells as the observation group, and U251 cells without transfection as the control group. The real-time cell analysis (RTCA) technology was used to detect the cell proliferation ability of the two groups (expressed by the optical density value) at 24, 48, 72, 96, and 120 h; Transwell test was used to detect the cell migration ability of the two groups (expressed by the number of cells crossing the trans-well chamber). We constructed the PCS2-3Flag-Galectin-1 plasmid, and the U251 cells were randomly divided into FAM92A1-289 group, the Galectin-1 group, co-transfection group, and control group. In the FAM92A1-289 group and Galectin-1 group, we used the Lipofactamine 3000 transfection method to transfect CMV-SP6-TALEN-GFP-289 and PCS2-3Flag-Galectin-1 plasmids, respectively. The cells in the co-transfection group were transfected with the two plasmids, and in the control group we only added Lipofactamine 3000 transfection reagent. The interaction between FAM92A1-289 and Galectin-1 protein was verified by Co-Immunoprecipitation.ResultsThere was no statistically significant difference between the two groups cells at 24 h (P>0.05). The optical density value at 48, 72, 96 and 120 h was significantly higher than that in the control group (P<0.05 orP< 0.01). The number of cells crossing the chamber in the observation group and the control group were 242.0±11.41 and 65.40±7.92, respectively (P<0.01). The relative expression of GFP in co-transfection group was significantly higher than that in the FAM92A1-289 group, Galectin-1 group, and control group (P<0.01).ConclusionThe over-expression of FAM92A1-289 can improve the proliferation and migration of U251 cells, and the interaction between FAM92A1-289 and galectin-1 is used to provide evidence for the role of FAM92A1-289 in regulating the malignant behavior of glioma cells.
glioma; U251 cells; FAM92A1-289; galectin-1; cell proliferation; cell migration
國家自然科學基金應急管理項目(81641028);湖北省自然科學基金面上項目(2016CFB408)。
吳慕禹(1992-),男,碩士在讀,研究方向為腦膠質瘤的基礎和臨床。E-mail: 315971175@qq.com
李東升(1960-),男,教授,研究方向為腦膠質瘤的基礎和臨床。E-mail: dsli1698@126.com
10.3969/j.issn.1002-266X.2017.44.003
R739.41
A
1002-266X(2017)44-0009-05
2017-05-15)

