基于核心素養觀念下對數圖像題的突破策略研究
□劉樹領 周建國
(山東省北鎮中學,山東濱州256600;鄒平縣第一中學,山東鄒平256200)
基于核心素養觀念下對數圖像題的突破策略研究
□劉樹領 周建國
(山東省北鎮中學,山東濱州256600;鄒平縣第一中學,山東鄒平256200)
因圖像題較好地體現出化學核心素養體系的考查,使得對數圖像題逐漸成為命題的熱點及主流題型。通過分析與研究發現,知識考查的落腳點主要集中在電解質溶液理論的基本知識及實際應用知識,進而找出對數圖像題解答的關鍵在于橫坐標為0點或問題點的探析上,由此提出了在夯實電解質溶液理論知識的前提下,運用學科觀念、思維解答對數圖像題的有效策略。
核心素養;對數圖像題;學科觀念;突破策略
在立德樹人、突出核心素養考查的命題指導思想下,圖像成為命題的新載體,其目的就是在考查基本知識及靈活運用的基礎上,來滲透模型認知、證據推理、宏觀辨識、微觀探析、變化觀念、平衡思想、社會責任等化學核心素養知識。化學上為了簡便表示溶液的酸堿性從而引入了pH,因而出現了較多與pH有關的對數圖像題,并衍生出了許多pOH、pKa、pKw、pKsp等對數圖像題。
一、常見對數圖像題的類型
(一)電離平衡(或水解平衡)對數圖
溶液多為電解質溶液,因而溶液中就常存在電離平衡、水解平衡等多種平衡體系。為了考查其平衡移動方向及其影響因素、粒子濃度大小關系等知識,同時凸顯宏微結合、變化與平衡、證據推理及模型認知等學科素養,因而出現電離(或水解)圖像問題。
例125℃時,相同體積和pH的NaX、NaY、NaZ三種鹽溶液,分別加水稀釋,溶液pH的變化與所加水的體積關系如圖1所示。下列說法正確的是( )
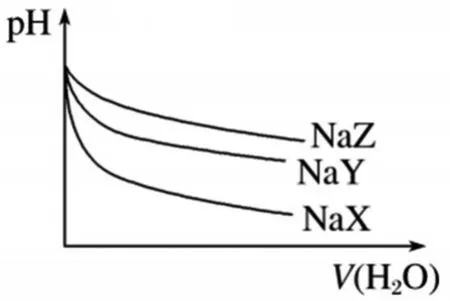
圖1
A.在上述三種鹽原溶液中,水的電離度大小是NaX>NaY>NaZ
B.在等物質的量濃度的NaX、NaY、NaZ混合液中,離子濃度的大小關系是c(Z-)>c(Y-)>c(X-)
C.在上述NaX和NaY的混合液中存在c(HX)/c(X-)=c(HY)/c(Y-)
D.在0.2 mol·L-1NaX溶液中加入等體積0.1 mol·L-1的鹽酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-)
評析:以鹽類水解為知識考查背景而設計的圖像題,突出對曲線變化原因分析及控制變量對比思想的靈活應用。解題的關鍵是曲線起點(橫坐標為0)相同、稀釋相同倍數時pH的變化量不同。具體過程:“稀釋相同倍數的鹽類溶液時,其pH變化越大則意味著該鹽的水解程度就越小,其相對應的酸性就越強”[1],得出酸根離子水解程度大小順序是Z->Y->X-,酸的強弱順序是HX>HY>HZ。等物質的量濃度的NaX、NaY、NaZ混合液中,存在離子濃度的大小關系是c(Z-)<c(Y-)<c(X-),故A、B錯誤;等濃度NaX和NaY的混合液中存在c(HX)/c(X-)<c(HY)/c(Y-),故C錯誤;在0.2 mol·L-1NaX溶液中加入等體積0.1 mol·L-1的鹽酸后,所得溶液是等物質的量濃度的NaX、NaCl、HX,根據電荷守恒得c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(X-),物料守恒得c(Na+)=c(HX)+c(X-)=2c(Cl-),可得c(H+)+c(HX)=c(OH-)+c(Cl-),故D正確。
(二)酸堿中和滴定對數圖
中和滴定是高中化學最重要的定量實驗之一,因而對中和滴定曲線的考查較多,涉及的知識點考查較多,設問方式較多,并把數形結合思想、宏微結合、變化與平衡思想等素養體現的淋漓盡致。
1.一元酸與一元堿之間的滴定
例2(2016年天津卷) 室溫下,用相同濃度的NaOH溶液,分別滴定濃度均為0.1mol·L-1的三種酸(HA、HB和HD)溶液,滴定的曲線如圖2所示,下列判斷錯誤的是( )
A.三種酸的電離常數關系:KHA>KHB>KHD
B.滴定至P點時,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7時,三種溶液中:c(A-)=c(B-)=c(D-)
D.當中和百分數達100%時,將三種溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
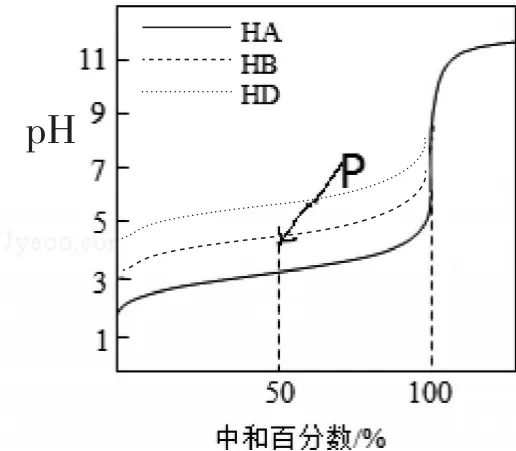
圖2
評析:三條曲線是三種酸單獨與等濃度氫氧化鈉反應而產生的,組合在一起就是考查對比數據處理能力、視圖分析能力及提取信息與靈活應用能力。解題的關鍵是曲線的起點(橫坐標為0)、圖中標記的P點及橫坐標標出的中和百分之五十(即反應只進行了一半)、百分之百(恰好完全反應)時對應的特殊點。由濃度均為0.1mol·L-1的三種酸(HA、HB和HD)溶液滴定的三條變化曲線的起點(也可根據分別中和百分之五十或百分之百時對應的pH大小判斷)可知,其酸性HA、HB、HD都是弱酸,且酸性依次減弱,故三種酸的電離常數關系存在KHA>KHB>KHD,所以A正確;滴定至P點時恰好HB反應了一半,即溶液中存在等濃度的HB與NaB,結合P點對應的溶液呈酸性,HB電離程度大于NaB水解程度,所以B正確;pH=7時,即意味著三種酸(HA、HB和HD)溶液中消耗氫氧化鈉溶液的體積依次減少,故鈉離子濃度不同,進而依據電荷守恒可知C錯;當中和百分數達100%時,將三種溶液混合后含等濃度的NaA、NaB、NaD三種溶質,均水解呈堿性,其物料守恒式為 c(Na+)=c(HA)+c(HB)+c(HD)+c(A-)+c(B-)+c(D-)、電荷守恒式為 c(A-)+c(B-)+c(D-)+c(OH-)=c(Na+)+c(H+),進而得 c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),所以D正確。
2.多元酸(或堿)與強堿(或強酸)的滴定
例3(2017全國理綜I)常溫下將NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系圖3所示。下列敘述錯誤的是( )
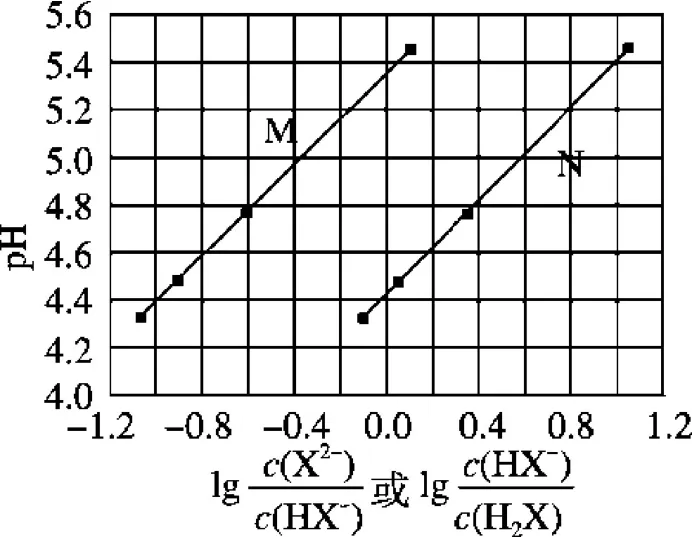
圖3
A.Ka2(H2X)的數量級為10-6
C.NaHX溶液中c(H+)>c(OH-)
D.當混合溶液呈中性時,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
評析:這是一個二元酸被滴定的反應圖像,圖像中的兩個直線就證明了反應過程存在反應先后順序,兩條直線有對應部分的橫軸處于相同狀態,說明反應又是一個連續的過程。突破關鍵是依據二元弱酸分步電離常數表達式,進行對數處理即可明確M、N兩線的含義,再抓住橫坐標為0分析即可。H2X?H++HX-、HX-?H++X2-,則Ka1=然后取對數可得不妨設當均為0時,即橫坐標0時Ka1=c1(H+)≈10-4.4、Ka2=c2(H+)≈10-5.4,故曲線N代表第一步電離,曲線M代表第二步電離,故A、B項正確。同時由等量Na2X、NaHX溶液呈酸性知NaHX溶液一定呈酸性,故C正確;要使溶液顯中性必然有大于 1,即c(HX-)<c(X2-),故D錯誤。
(三)鹽溶液與強酸(或酸與鹽混合)反應對數圖
鹽(或酸與鹽混合)溶液與強酸反應實質上仍是酸堿中和滴定,僅是酸堿中和滴定的變式而已。
例 420℃時,向 20 mL 0.1 mol·L-1的Na2CO3溶液中逐滴加入0.1 mol·L-1鹽酸(忽略H2CO3的分解和CO2的揮發),溶液pH隨鹽酸加入的體積變化曲線如圖4。下列說法正確的是( )
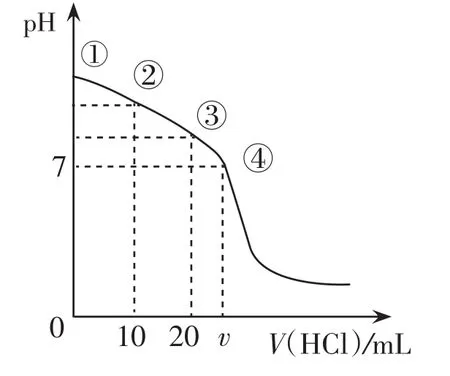
圖4
A.點 ① 所 示 溶 液 中 :c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B.點②所示溶液中:c(CO32-)>c(Cl-)>c(HCO3-)>c(OH-)
C.點③所示溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.點④所示溶液中:c(Cl-)=2c(H2CO3)+c(HCO3-)
評析:本圖像是多元弱酸鹽與酸的反應,屬于中和反應滴定的變式。解答的關鍵是依據離子反應的本質,分析多元弱酸離子(或混合溶液)與酸反應的先后順序,然后再結合圖像中提供的特殊點橫坐標為0、10、20對應的溶液成分來分析。Na2CO3溶液中逐滴加入0.1= mol·L-1鹽酸時發生兩=個過程,即 CO32-+H+HCO3-、HCO3-+H+H2CO3。具體解答過程:點①所示溶液是碳酸鈉溶液,根據鹽類水解規律可得c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故A錯;點②所示溶液恰好等到等濃度的碳酸鈉、碳酸氫鈉、氯化鈉溶液,由于碳酸根離子水解程度大于碳酸氫根離子,故 c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-),故B錯;點③所示溶液恰好是碳酸氫鈉,其質子守恒式為 c(CO32-)+c(OH-)=c(H2CO3)+c(H+),故C正確;點④所示溶液為中性知含有碳酸氫鈉、碳酸及氯化鈉,根據電荷守恒2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)及物料守恒 2c(CO32-)+2c(H2CO3)+2c(HCO3-)=c(Na+)可得 2 c(H2CO3)+c(HCO3-)=c(Cl-),所以D正確。
(四)沉淀溶解平衡對數圖
沉淀溶解平衡是電解質溶液凈化除雜、沉淀轉化等方面最常用的理論或方法之一。能較好地體現化學科學精神與社會責任、變化與平衡思想。
例5某溫度下,向10 mL 0.1 mol·L-1CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加過程中溶液中-lgc(Cu2+)與Na2S溶液體積(V)的關系如圖5所示,下列有關說法正確的是( )
已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2·L-2。
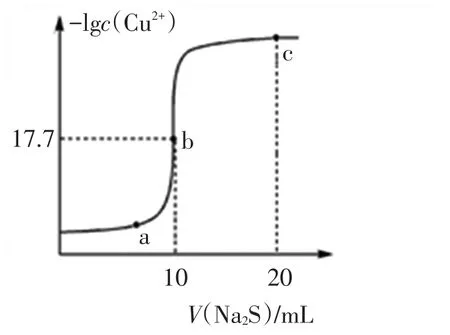
圖5
A.a、b、c三點中,水的電離程度最大的為b點
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.該溫度下Ksp(CuS)=4×10-36mol2·L-2
D.向100 mL Zn2+、Cu2+濃度均為10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Zn2+先沉淀
評析:本圖像盡管是溶液中-lgc(Cu2+)隨Na2S溶液體積(V)變化關系圖,其實質上仍是除原點部分之外硫化銅的沉淀溶解平衡問題,目的是考查對沉淀溶解平衡曲線的深度理解,即曲線起點(橫坐標為0)表示的0.1 mol·L-1CuCl2溶液,沒有沉淀溶解平衡存在,但在曲線上的a、b、c等點存在沉淀溶解平衡。b點是CuCl2與Na2S溶液恰好完全反應的點,溶質是氯化鈉,對水的電離沒有作用,水的電離程度最小的為b點,而a、c兩點對應的溶液中依次含有CuCl2、Na2S,而CuCl2、Na2S均能水解促進水電離,故A錯誤;根據物料守恒Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故 B 錯誤;b點是CuCl2與Na2S溶液恰好完全反應的點,由CuS(s)?Cu2+(aq)+S2-(aq)知c(Cu2+)=c(S2-),再根據b點數據c(Cu2+)=2×10-18mol-1可推知該溫度下Ksp(CuS)=4×10-36mol2·L-2,故C正確;Ksp(ZnS)=3×10-25mol2·L-2大于 Ksp(CuS)知CuS更難溶,所以向100 mL Zn2+、Cu2+濃度均為10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Cu2+先沉淀,故D錯誤。
二、突破策略
從上述例題中不難發現,突出數形結合來解答化學問題的命題思想,突出了定性與定量分析相結合、實證與邏輯推理及模型認知相結合的學科特點,其考查的知識點既有對強弱電解質、電離平衡、水的電離、pH、離子反應、鹽類水解等基本概念或理論知識的考查,又有對圖形等所給的相關信息提取、分析解決問題的綜合運用能力及表達能力的考查。
(一)熟練掌握電解質溶液理論知識
電解質溶液理論主要包含電離平衡、水解平衡以及沉淀溶解平衡三部分,都是動態平衡,均遵循平衡移動原理。從形式上講盡管三個平衡的研究對象不同,電離平衡、水解平衡以及沉淀溶解平衡分別研究可溶性弱電解質、可溶性且含弱離子的鹽、難溶電解質,但它們之間存在內在的邏輯聯系[2],如電離平衡與鹽類水解平衡是一個相反的過程,等濃度下弱酸或弱堿的電離程度越小,則其對應鹽的水解程度越大。沉淀溶解平衡則是在溶液達到飽和時存在的一種平衡狀態,一般是研究難溶電解質,并因其電離出的離子濃度較小而忽略離子的水解影響,而電離平衡、鹽類水解平衡一般是研究未達到飽和狀態下存在的平衡關系,因而其加水稀釋或增加溶質濃度均出現正向移動的結果,但其電離(或水解)程度相應地變大或變小。
(二)善于從化學學科素養角度認識圖像問題
圖像既有對宏觀物質性質的反映,也有對微觀反應過程的體現,因而分析圖像時可以運用數形結合進行定量分析、微宏結合思想探析物質的性質、轉化與守恒思想來建立量的關系。通過上述實例不難發現隱含著核心化學觀念有:(1)微粒觀:①微粒來源:其來源可能是外加物質、物質轉化、物質的電離等。②存在形式:環境性質如何?存在形態是分子、原子還是離子?③微粒性質:如溶解性、酸堿性等。④微粒行為:如外觀現象是沉淀生成、弱電解質生成?行為類型是氧化還原反應還是非氧化還原反應?是可逆過程還是非可逆過程?(2)守恒觀:守恒觀是基于元素觀和轉化觀規律的升華和演變。元素有不同的存在形態,在轉化過程中也以不同形態存在,但轉化過程卻表現為物料守恒、電荷守恒、質子守恒等多種形式。(3)平衡觀:涉及電離平衡、難溶物沉淀平衡、水解平衡等類型。平衡定性分析涉及反應、條件、方向和結果四個方面的建模。具體而言:找微粒、建平衡,看條件、判移動,比結果。平衡量化思維需比較Qc與K的相對大小,判斷平衡移動的方向及建立途徑[3]。
(三)針對性訓練提高解題能力
千懂萬懂不如一試就懂。只有通過適量的有針對性地強化訓練,才能真切感悟到基本理論的奇妙、靈活,才能自我歸納總結出切實有效的解題方法或技巧。如由上述幾例,我們可總結出對數圖像題的解題步驟,即宏觀上由大到小依次看圖,即首先看兩軸表示的物理量,然后再看曲線總體變化趨勢,再看曲線中的特殊點,即起點(尤其是橫坐標為0時)、拐點、標記的問題點。其次是聯想規律:強弱電解質的電離特點、電離平衡規律(或鹽類水解規律)、沉淀溶解平衡規律及有關計算的格式。第三是結合題中信息及相關問題要求進行針對性地給予解答。對于出現多條變化曲線的圖像時,則常考慮運用控制變量思想來分析比較找出一個自變量進行分析。對于出現有關計算時,則常采用以平衡常數為中心的三段式列式計算。
總之,對數圖像題并不高深,它僅是基于客觀事實的符號體現而已,只要我們善于從橫坐標為0思考問題、善于運用學科觀念來統領問題分析,總結出必要的解題步驟,就一定可使圖像題迎刃而解。
[1]周建國,劉樹領.高考新寵——三大平衡常數[J].化學教學,2010(3):63.
[2]劉樹領.電解質溶液教學中常見疑難點的探究[J].化學教學,2013(6):74.
[3]夏時君,周小凡.化學圖像信息解讀的層次與方法[J].化學教育,2016(11):83.
*本文系濱州市教育科學“十三五”規劃課題《基于學生核心素養培養下的化學教學設計研究》〔編號:BJK13517-23〕研究成果之一。

