甲乙苯脫氫制甲基苯乙烯反應工藝及動力學研究
郝明坤,李瑞江,朱學棟,卓 超,倪燕慧,魯 航
(1.華東理工大學大型工業反應器工程教育部工程研究中心,上海 200237;2.南京煉油廠有限責任公司)
甲乙苯脫氫制甲基苯乙烯反應工藝及動力學研究
郝明坤1,李瑞江1,朱學棟1,卓 超2,倪燕慧1,魯 航1
(1.華東理工大學大型工業反應器工程教育部工程研究中心,上海 200237;2.南京煉油廠有限責任公司)
使用工業脫氫催化劑,在溫度580~635 ℃、水與甲乙苯質量比2.0~4.0、體積空速0.5~1.5 h-1、壓力(a)30~101 kPa的實驗條件范圍內,研究了工藝參數對甲乙苯脫氫制甲基苯乙烯反應的影響規律。結果表明:隨著溫度的升高,甲乙苯轉化率提高,甲基苯乙烯選擇性下降;隨著水與甲乙苯配比的增加,轉化率和選擇性均上升;體積空速降低時,雖能提高轉化率,但會使選擇性降低;壓力降低時,既可提高轉化率,又有利于選擇性的升高;適宜的工藝條件為壓力(a)50 kPa、溫度620 ℃、水與甲乙苯質量比2.0、體積空速0.5 h-1。利用實驗數據,對甲乙苯脫氫反應進行了動力學研究。假設并簡化反應網絡,根據不同反應機理提出3種可能的甲乙苯脫氫反應動力學模型,對模型進行統計學檢驗篩選后,確定雙位吸附模型為最佳反應動力學模型,并估算了該模型的參數,可為反應器的設計和最佳操作條件的選擇提供依據。
甲乙苯 甲基苯乙烯 脫氫 反應工藝 反應動力學
甲基苯乙烯為無色透明液體,常用來代替苯乙烯,主要應用于樹脂涂料、熱固性聚酯塑料等方面[1-3]。與苯乙烯相比,甲基苯乙烯具有較高的沸點、較低的蒸氣壓,可明顯地減少潛在的危害性[4-5];與聚苯乙烯相比,聚甲基苯乙烯具有較低的密度、較高的熱變形溫度、較好的流動性等特點[1-2],具有更廣闊的應用空間。目前我國苯乙烯的生產量仍不能滿足市場需求,須依靠大量進口來平衡需求[6]。在這種情況下,需對甲基苯乙烯的生產給予足夠重視,解決我國苯乙烯市場供量不足的問題,大力發展聚甲基苯乙烯新工藝技術[2]。近年來,隨著碳九芳烴的深度利用開發,甲乙苯脫氫制甲基苯乙烯技術的開發成為研究方向之一[7-8]。
甲乙苯脫氫制甲基苯乙烯技術最早是由美國的赫斯特和莫比爾公司聯合開發的。在20世紀80年代,國內研究者吳榮安[9]、朱曉苓[10]、李琪[11]等分別對甲乙苯脫氫制甲基苯乙烯進行了研究,這些研究均側重于無鉻脫氫催化劑的研制與性能考察,而有關甲乙苯脫氫反應動力學的研究迄今未見報道。
本課題采用工業GS脫氫催化劑,對甲乙苯脫氫制甲基苯乙烯過程進行反應特性研究及工藝參數優化,對甲乙苯脫氫反應進行動力學分析,為反應器的設計和最佳操作條件的選擇提供必要的依據。
1 實 驗
1.1 原 料
間、對甲乙苯混合物,純度98.6%(間甲乙苯和對甲乙苯的質量分數分別為50.4%和48.2%),由南京煉油廠提供。
1.2 催化劑
工業GS脫氫催化劑,尺寸為Φ3 mm×5 mm,已成功應用到乙苯脫氫工業生產中,上海石油化工研究院研制。該催化劑以氧化鐵為主要活性組分,添加碳酸鉀、鈰鹽、鉬鹽、氧化鎂等為助劑[12]。
1.3 反應器
等溫積分管式反應器,尺寸為內徑2.54 cm、外徑3.5 cm、長度80 cm。
1.4 實驗步驟
本實驗采用30 g原顆粒催化劑,在實驗操作條件下能夠達到排除外擴散要求[13]。甲乙苯與水分別稱量后經計量泵送入反應系統,混合后通過油浴鍋汽化。隨后物料經保溫管線進入反應管反應。反應產物經過冷凝后進入脫氫液收集裝置進行收集。每隔2 h取樣一次,對樣品進行氣相色譜分析。
2 結果與討論
采用工業GS脫氫催化劑,考察了溫度、水與甲乙苯配比、空速、壓力等工藝參數對甲乙苯轉化率、甲基苯乙烯選擇性的影響。
2.1 溫度的影響
在常壓、水與甲乙苯質量比2.0、體積空速1.0 h-1的條件下,考察溫度對甲乙苯脫氫反應的影響,結果見圖1。從圖1可知:在620 ℃以下,甲乙苯轉化率較低,隨著溫度的提高,甲乙苯轉化率增大,特別是在溫度由600 ℃提高到635 ℃時,甲乙苯轉化率的提高明顯;隨著溫度的提高,甲基苯乙烯選擇性不斷下降。因此,甲乙苯脫氫反應的起始溫度設定在620 ℃左右比較合理,此時甲乙苯轉化率及甲基苯乙烯選擇性均較高。
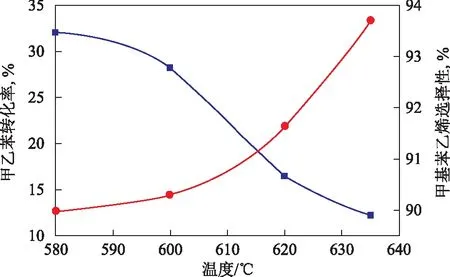
圖1 溫度對甲乙苯轉化率和甲基苯乙烯選擇性的影響●—甲乙苯轉化率; ■—甲基苯乙烯選擇性。圖2~圖4同
2.2 水與甲乙苯配比的影響
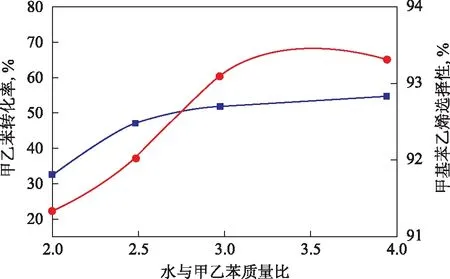
圖2 水與甲乙苯配比對甲乙苯轉化率和甲基苯乙烯選擇性的影響
在常壓、溫度620 ℃、體積空速1.0 h-1的條件下,考察水與甲乙苯配比對甲乙苯脫氫反應的影響,結果見圖2。從圖2可知,水蒸氣的加入能夠降低反應組分的分壓,促進主反應平衡向生成甲基苯乙烯的方向移動,從而提高甲乙苯轉化率,并且使甲基苯乙烯的選擇性上升。加入水蒸氣還能發生水煤氣變換反應,從而清除催化劑上的積炭。但水蒸氣用量太多時,對提高甲乙苯平衡轉化率的作用不是很顯著,并且能耗增加,使設備生產能力降低。
2.3 空速的影響
在常壓、溫度620 ℃、水與甲乙苯質量比2.0的條件下,考察空速對甲乙苯脫氫反應的影響,結果見圖3。從圖3可看出,隨著空速增大,物料在催化劑上的停留時間減少,導致甲乙苯轉化率降低,但甲基苯乙烯選擇性上升。在空速較低時,雖然甲乙苯轉化率較高,但由于裂解、聚合及深度裂解等副反應加劇而使催化劑表面結炭嚴重,從而使催化劑活性下降,導致甲基苯乙烯選擇性較低;提高空速時,雖然甲乙苯轉化率有所降低,但甲基苯乙烯選擇性提高,故空速的最適宜范圍與催化劑的活性和反應溫度有關。
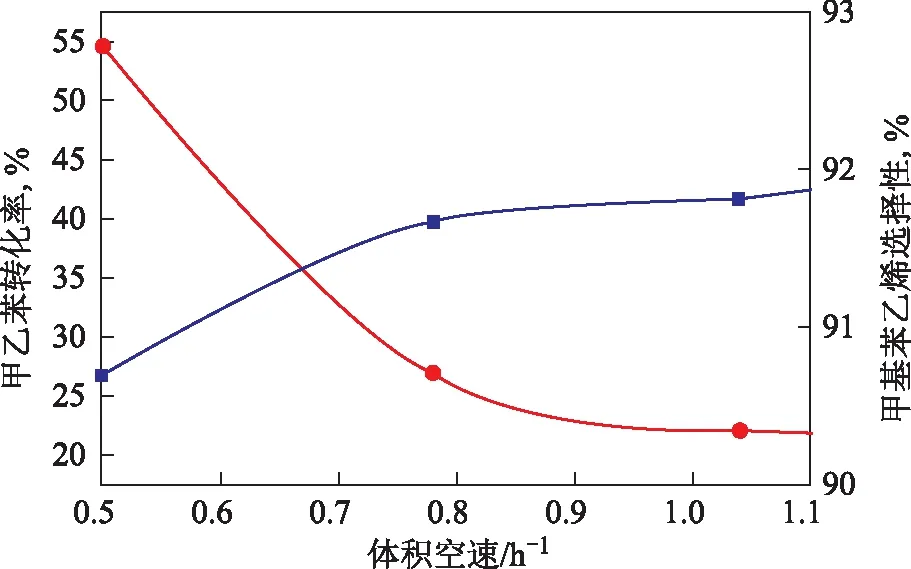
圖3 空速對甲乙苯轉化率和甲基苯乙烯選擇性的影響
2.4 壓力的影響
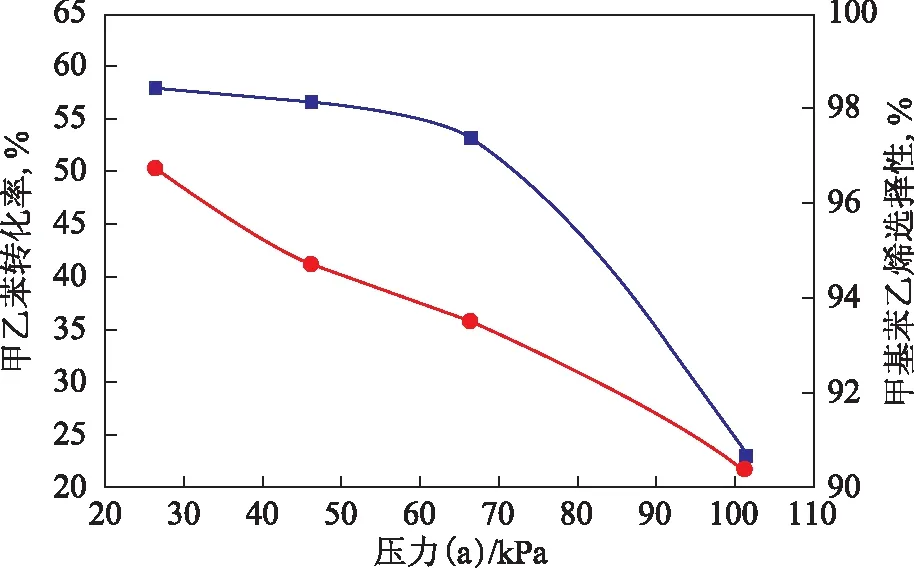
圖4 壓力對甲乙苯轉化率和甲基苯乙烯選擇性的影響
在溫度620 ℃、水與甲乙苯質量比2.0、體積空速1.0 h-1的條件下,考察壓力對甲乙苯脫氫反應的影響,結果見圖4。從圖4可以看出,由于甲乙苯脫氫反應為可逆增分子反應,故壓力的降低有利于提高甲乙苯轉化率以及甲基苯乙烯選擇性,抑制副反應的發生。
通過上述實驗研究和綜合分析,推薦適宜的甲乙苯脫氫工藝條件為:壓力(a)50 kPa,溫度620 ℃,水與甲乙苯質量比2.0,體積空速0.5 h-1。
3 甲乙苯脫氫反應動力學
3.1 反應網絡
根據甲乙苯脫氫實驗的產物分析結果可知,主要反應產物為甲基苯乙烯,副產物的量較少,主要包括甲苯、二甲苯、苯乙烯、乙苯、苯。
甲乙苯脫氫反應網絡可假設如下[9]:
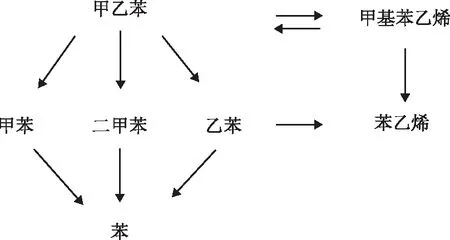
由于甲乙苯脫氫反應中副反應較多,為了便于研究反應動力學,對此脫氫反應網絡進行簡化。由于生成苯、乙苯、苯乙烯等副產物的量較少,所以主要考慮主反應和生成甲苯、二甲苯的副反應。吳榮安[9]、李琪[11]的研究結果表明,間、對甲乙苯異構體的脫氫性能相似,且脫氫過程中兩者不存在異構化反應,故將間、對甲乙苯脫氫簡化為一個脫氫反應。簡化后甲乙苯脫氫中涉及的反應為:
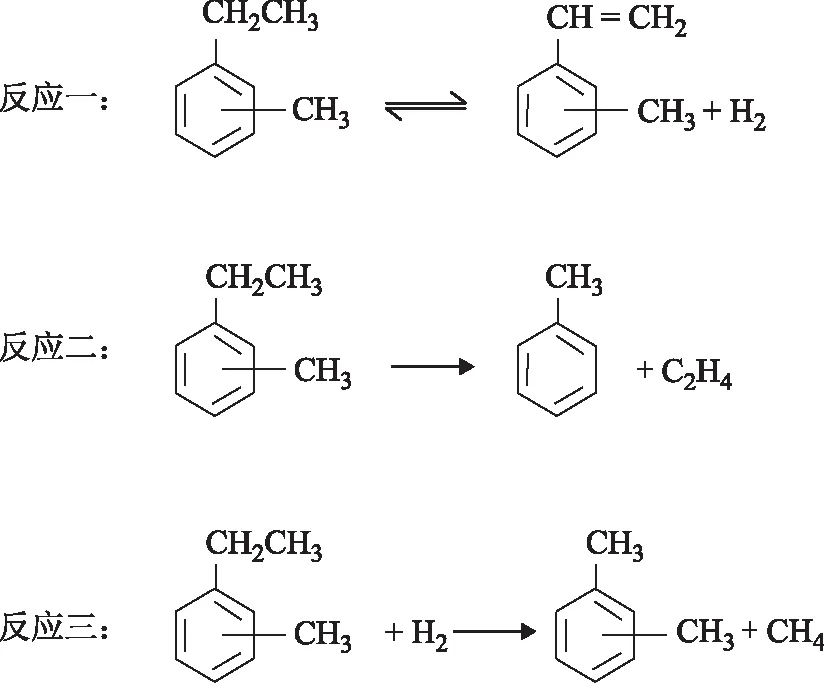
3.2 動力學建模
甲乙苯與乙苯在結構上類似,文獻中已有許多關于乙苯脫氫反應動力學的報道,故本課題以乙苯脫氫反應動力學研究成果為基礎,對甲乙苯脫氫反應進行動力學研究。根據不同的脫氫反應機理,提出3種可能的甲乙苯脫氫反應動力學模型,分別為單位吸附模型、雙位吸附模型和經驗模型。
3.2.1單位吸附模型基于Langmuir-Hinshelwood理論,Carrà等[14]提出了苯乙烯的生成速率方程。在這個模型的基礎上,甲乙苯脫氫反應過程可表示如下:
甲乙苯吸附過程:

表面反應過程:

式中:[]表示催化劑表面吸附活性空位;MEB表示甲乙苯;MST表示甲基苯乙烯;TL表示甲苯;DB表示二甲苯。
甲乙苯脫氫產物中甲苯、二甲苯、甲烷、乙烯的含量很低,可忽略不計;本實驗進料中水和甲乙苯的配比較高,甲乙苯分壓較小,故甲乙苯分壓對反應速率的影響很小,因此反應速率方程可簡化如下:
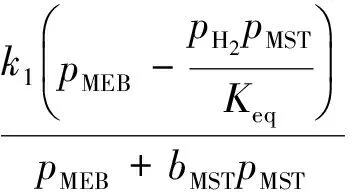


式中:r1,r2,r3分別為反應1~反應3的速率;k1,k2,k3分別為反應1~反應3的反應速率常數;p為各組分的分壓;bMST為甲基苯乙烯吸附常數;Keq為主反應平衡常數。
3.2.2雙位吸附模型依據Langmuir-Hinshelwood反應機理,Lee[15]對Hougen和Watson提出的經典動力學模型進行了改進。依據Lee提出的反應機理和動力學模型,甲乙苯脫氫反應機理可表示如下:
甲乙苯、氫氣的吸附過程:


表面反應過程:

甲乙苯脫氫產物中甲苯、二甲苯、甲烷、乙烯的含量很低,可忽略不計;由于反應在高溫下進行,氫氣的吸附系數與甲乙苯和甲基苯乙烯等烴類的吸附系數相比甚小,故分母項中忽略氫氣項,反應速率方程可表示如下:

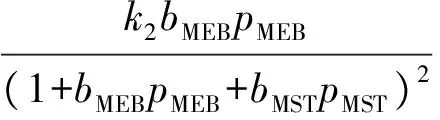
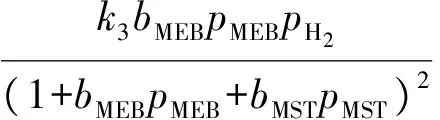
ki=ki0e(-Ei/RT),i=1,2,3,
bj=bj0e(-Aj/RT),j=MEB,MST
式中:ki0為指前因子;Ei為活化能;bj0為指前因子;Aj為吸附活化能;bj為吸附常數。
3.2.3經驗模型適用于乙苯脫氫的經驗模型最早是由Wenner和Dybdal提出的[16],甲乙苯脫氫反應過程可表示如下:

反應速率方程可表示如下:
r2=k2pMEB
r3=k3pMEBpH2
3.3 模型篩選與參數估計
將動力學實驗數據代入速率方程,利用龍格庫塔算法(MATLAB ODE45)可求解微分速率方程。最優化方法選用Levenberg-Marquardt算法,不斷迭代計算,直至使目標函數值最小,最終完成參數估算[17]。其中目標函數S表示如下:
w2(XTL,e,k-XTL,c,k)2+w3(XDB,e,k-XDB,c,k)2]
式中:XMST,e,k,XTL,e,k,XDB,e,k分別為甲基苯乙烯、甲苯、二甲苯轉化率的實驗值,XMST,c,k,XTL,c,k,XDB,c,k分別為甲基苯乙烯、甲苯、二甲苯轉化率的理論計算值;w1,w2,w3為權重因子,由于主產物甲基苯乙烯與副產物甲苯、二甲苯的含量相差很大,故采用權重因子調節各組分殘差平方和在目標函數中的權重。
采用決定性指標ρ2和F檢驗值兩種判斷標準對動力學模型進行篩選,檢驗結果見表1。由表1可知,雙位吸附模型的決定性指數ρ2均大于0.9,F檢驗值最大,且F>10F0.05,故可認為本實驗考察范圍內,雙位吸附模型為最佳動力學模型。
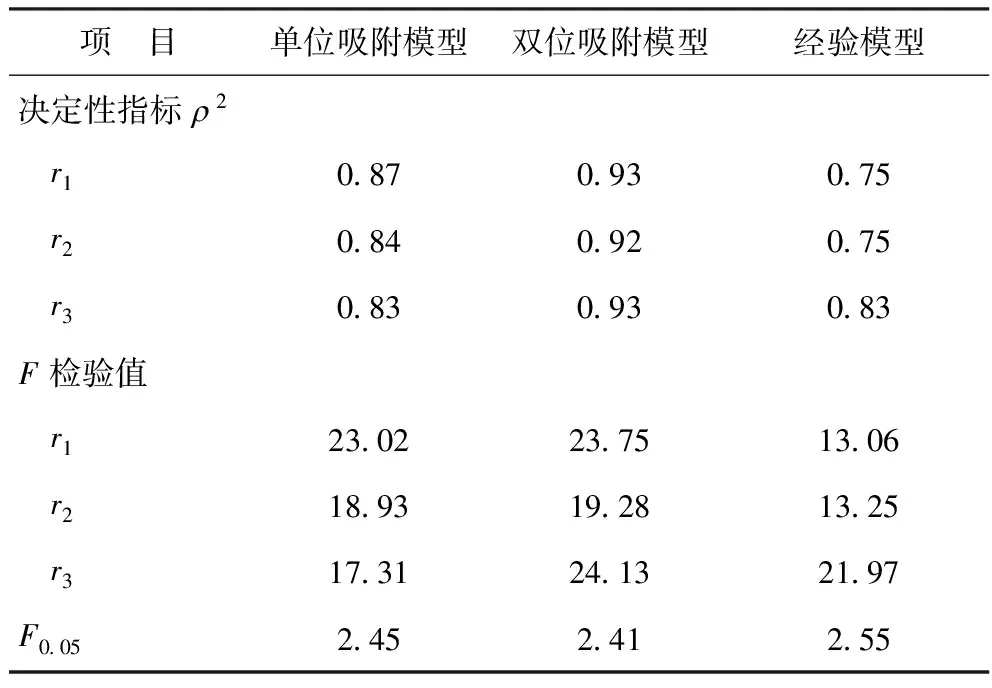
表1 動力學模型的統計學檢驗結果
雙位吸附模型的參數估算結果見表2。

表2 雙位吸附模型的參數估計結果
4 結 論
(1)溫度、水與甲乙苯配比、空速、壓力對甲乙苯轉化率以及甲基苯乙烯選擇性的影響規律為:隨著溫度的升高,轉化率提高,選擇性下降;隨著水與甲乙苯配比的增加,轉化率和選擇性均上升;體積空速降低時,雖能提高轉化率,但會使選擇性降低;壓力降低時,既可提高轉化率,又有利于選擇性的升高。
(2)適宜的甲乙苯脫氫工藝條件為:壓力(a)50 kPa,溫度620 ℃,水與甲乙苯質量比2.0,體積空速0.5 h-1。
(3)提出了3種甲乙苯脫氫反應動力學模型。經篩選,確定雙位吸附模型為最佳模型,并估算了該模型參數值,統計學檢驗結果顯示:ρ2>0.9,F>10F0.05,故在本實驗考察范圍內,所采用的假定和提出的雙位吸附動力學模型是合理的。
[1] 郝國璋.新型塑料單體——對甲基苯乙烯[J].合成樹脂及塑料,1985(2):45-49
[2] 蔡光宇.新工藝生產聚甲基苯乙烯[J].中國科技信息,1992(12):39-40
[3] 曹正國,荊曉平,任偉,等.一種用于乙烯基甲苯生產的精餾裝置及精餾方法:中國,CN104072328 A[P].2014-10-01
[4] 維美.新型塑料——聚對甲基苯乙烯[J].化工新型材料,1983(7):15-16
[5] 吳鑫干.一種比苯乙烯更好的單體對甲基苯乙烯正在走向工業化[J].現代化工,1984(6):28-31
[6] 陳雷,馬勝澤,王金昭,等.苯乙烯的市場及技術進展[J].彈性體,2016,26(3):90-96
[7] 馮海強,朱躍輝,高繼東,等.一種用于甲基乙苯脫氫制備甲基苯乙烯的催化劑及制備方法:中國,CN102950005A[P].2013
[8] 朱志榮,梁錚.用于甲乙苯脫氫制甲基苯乙烯的催化劑:中國,CN102000587A[P].2011-04-06
[9] 吳榮安,白玉珩,林勵吾.對甲基乙苯脫氫制對甲基苯乙烯[J].石油化工,1990,19(8):511-517
[10] 朱曉苓,張培輝,潘伯華,等.甲乙苯脫氫制甲基苯乙烯的研究[J].上海化工學院學報,1980(1):54-63
[11] 李琪,胡家臻.甲乙苯脫氫催化劑的研制[J].化學反應工程與工藝,1988,10(2):69-74
[12] 宋磊.GS-11催化劑催化乙苯脫氫制苯乙烯反應性能[J].化學反應工程與工藝,2013,29(1):92-96
[13] 陳建春.乙苯脫氫副反應及動力學的研究[D].上海:華東理工大學,2003
[14] Carrà S,Forni L.Kinetics of catalytic dehydrogenation of ethylbenzene to styrene[J].Industrial & Engineering Chemistry Process Design and Development,1965,4(3):281
[15] Lee W J,Froment G F.Ethylbenzene dehydrogenation into styrene:Kinetic modeling and reactor simulation[J].Industrial & Engineering Chemistry Research,2008,47(23):9183-9194
[16] Sheppard C M,Maier E E,Caram H.Ethylbenzene dehydrogenation reactor model[J].Industrial & Engineering Chemistry Process Design and Development,1986,25(1):207-210
[17] 王超.低水烴比型負壓乙苯脫氫催化劑反應動力學研究及反應工藝剖析[D].上海:華東理工大學,2014
STUDYONREACTIONCONDITIONSANDKINETICSOFDEHYDROGENATIONOFETHYLTOLUENETOMETHYLSTYRENEWTBZ
Hao Mingkun1, Li Ruijiang1, Zhu Xuedong1, Zhuo Chao2, Ni Yanhui1, Lu Hang1
(1.LargeIndustrialReactorEngineeringResearchCenteroftheMinistryofEducation,EastChinaUniversityofScienceandTechnology,Shanghai200237; 2.NanjingRefineryCo.Ltd.)
With the industrial dehydrogenation catalyst,the ethyl toluene dehydrogenation was conducted at 580—635 ℃,30—101 kPa,water/ethyl toluene mass ratio of 2.0—4.0,and space velocity ranging from 0.5—1.5 h-1.The results indicated that the conversion of ethyl toluene increases as the temperature rises while the selectivity for methylstyrene is the opposite;increasing water/methyl toluene ratio leads to higher conversion and selectivity;the effect of reducing LHSV is the same as increasing temperature,while higher reaction pressure is in favor of both conversion and selectivity.The most optimal reaction conditions are:50 kPa,620 ℃,the water-to-reactant ratio of 2.0 and the LHSV of 0.5 h-1. The kinetics of dehydrogenation reaction of ethyl toluene was studied by using experimental data.Three possible ethyl toluene dehydrogenation reaction kinetics models were proposed in the premise of assumptive and simplified reaction network and based on the different reaction mechanisms.After the statistical test for 3 models,the two-site adsorption model was chosen as the best model,and then the parameters of the model were determined.The results can be used for the reactor design and the selection of optimal operating conditions.
ethyl toluene; methylstyrene; dehydrogenation; reaction process; reaction kinetics
2017-06-05;修改稿收到日期2017-08-24。
郝明坤,碩士研究生,化學工藝專業,研究方向:催化反應工程及化工工藝。
李瑞江,E-mail:ruijiangli@ecust.edu.cn。

