核苷酸結合寡聚化結構域樣受體對結核分枝桿菌免疫應答研究的新進展
張雨晴 張旭霞 劉毅 李傳友
·綜述
核苷酸結合寡聚化結構域樣受體對結核分枝桿菌免疫應答研究的新進展
張雨晴 張旭霞 劉毅 李傳友
結核分枝桿菌(Mycobacteriumtuberculosis,MTB)是引發結核病的主要病原菌。宿主對MTB的免疫應答在結核病發病過程中有重要地位,該過程主要通過模式識別受體(pattern recognition receptor,PPR)進行。核苷酸結合寡聚化結構域(nucleotide-binding oligomerization domain,NOD)樣受體(NOD-like receptor,NLR)是其中的一種重要PPR,在MTB感染和發病中扮演重要角色,目前已發現有20多種。NLR主要針對胞內的細菌和病毒進行免疫應答,同時對它們釋放或降解的產物也產生免疫反應。NLR在MTB感染早期固有免疫系統對病原菌的識別和清除,以及啟動適應性免疫應答和分泌細胞因子、介導炎癥和細胞自噬等過程中都有重要作用。近幾年,NLR在這些功能研究上有新進展,筆者就NLR介導的對MTB感染的免疫應答過程,以及其與結核病發病關系研究的新動態進行綜合分析,以期為MTB和宿主細胞的相互作用研究提供新提示。
受體,模式識別; 受體, 蛋白酶激活; 分枝桿菌,結核; 感染; 免疫
結核分枝桿菌(MTB)是導致結核病的主要病原菌,其生長過程極其緩慢,感染發病過程不同于常見的細菌和病毒。研究顯示,結核病的發病與否及嚴重程度與宿主的免疫系統和免疫狀態有很大關系,宿主的免疫應答在發病過程中占有重要地位[1]。因此,研究免疫應答在結核病發病和進展中所起的作用十分重要。
MTB感染宿主后,細胞的模式識別受體(PRR) 首先識別MTB表面的病原相關分子模式(pathogen-associated molecular pattern,PAMP)[2],進而啟動下一步的免疫應答和免疫反應,該系統的啟動與否或者激活的程度對于抑制早期細菌復制和啟動適應性免疫應答具有重要的作用。核苷酸結合寡聚化結構域(nucleotide-binding oligomerization domain,NOD)樣受體(NOD-like receptor,NLR)是PAMP和損傷相關分子模式(damage-associated molecular pattern,DAMP)的重要胞內識別受體,參與多種信號轉導通路,在免疫、疾病、凋亡、胚胎發育等方面都有重要的作用[3]。
NLR家族由20多種蛋白組成[4],參與的主要功能和機制見表1[3, 5-6]。它們廣泛表達于多種細胞內,如免疫系統巨噬細胞、中性粒細胞和樹突狀細胞(dendritic cells,DC)等[7]。NLR分子主要由3種結構域組成:位于分子中央的核苷酸結合寡聚化結構域(nucleotide binding and oligomerization domain,NOD),對NLR的寡聚化和活化起作用;C端的富含亮氨酸(leucine rich repeat, LRR)結構域,負責識別配體;N端的半胱天冬酶活化募集結構域(caspase recruitment domain, CARD)或熱蛋白結構域(pyrin domain,PYD),負責募集下游效應信號分子[8]。
NLR在宿主識別MTB激活免疫應答過程及防御MTB感染中發揮有重要作用,目前NLR和結核病的相互關系研究有眾多新進展,筆者主要就NLR在免疫應答和免疫調控方面的最新研究結果進行總結分析。
一、NLR在宿主對MTB感染免疫中的主要作用
NLR主要識別細菌胞壁肽聚糖、胞壁酰二肽(muramyl dipeptide,MDP)或者其他降解的片段等[9]。受到外源性刺激后的NLR可激活核轉錄因子-κB (nuclear transcription factor-kappa B,NF-κB)或絲裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信號通路[10],在免疫反應中扮演重要角色。NLR與相應配體結合,通過NOD結構域寡聚體化,經CARD-CARD相互作用活化受體相互作用蛋白2(receptor interacting protein 2,RIP2),RIP2與CARD結合激活轉錄因子 NF-κB,使NF-κB轉移進入核內,誘導細胞因子、趨化因子等多種物質的表達。NLR也激活MAPK信號通路中的p38、細胞外信號調節蛋白激酶(extracellular signal-regulated kinase,ERK)和c-jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)信號,引起促炎因子和抗菌肽的釋放[11],同時與NF-κB信號通路相互影響和作用發揮生物學功能。
1. NLR的重要功能:目前在MTB感染和結核病發病過程中對NLR的重要成員NOD1和NOD2的免疫功能研究較為深入。有研究表明,NOD1基因缺失的巨噬細胞感染MTB時,細胞因子分泌水平可能無明顯變化,NF-κB和MAPK信號通路受影響不明顯,但NOD1缺失同時合并NOD2或Toll樣受體(Toll-like receptor, TLR)缺失時,細胞因子分泌水平明顯下降。這表明NOD1可能以與NOD2和TLR協同作用的方式在MTB感染免疫應答中發揮重要作用,其具體功能和機制有待進一步研究[12]。另有研究表明,NOD2沉默時,MTB生長水平明顯升高[13]。當MTB感染時,可經由NOD2受體,通過RIP2依賴方式促進巨噬細胞炎癥介質腫瘤壞死因子α(tumor necrosis factor-alpha, TNF-α)和白細胞介素1β(interleukin-1beta, IL-1β)的產生,也可通過激活下游信號通路,引起多種炎癥因子和趨化因子的產生[14],調控細胞的免疫狀態和免疫應答過程。而NOD2基因缺失后,巨噬細胞的免疫功能減弱,MTB刺激引起的TNF-α 和IL-1β分泌水平明顯下降,RIP2磷酸化水平降低,抑制MTB增殖的因素減弱。還有報道指出,NOD2敲除時巨噬細胞誘導型NO合酶(inducible nitric oxide synthase, iNOS)表達也明顯下調[15]。這些研究說明,NLR可通過調節信號通路,改變細胞因子分泌水平,介導NO生成等多種途徑在MTB的感染和致病中發揮重要的作用。
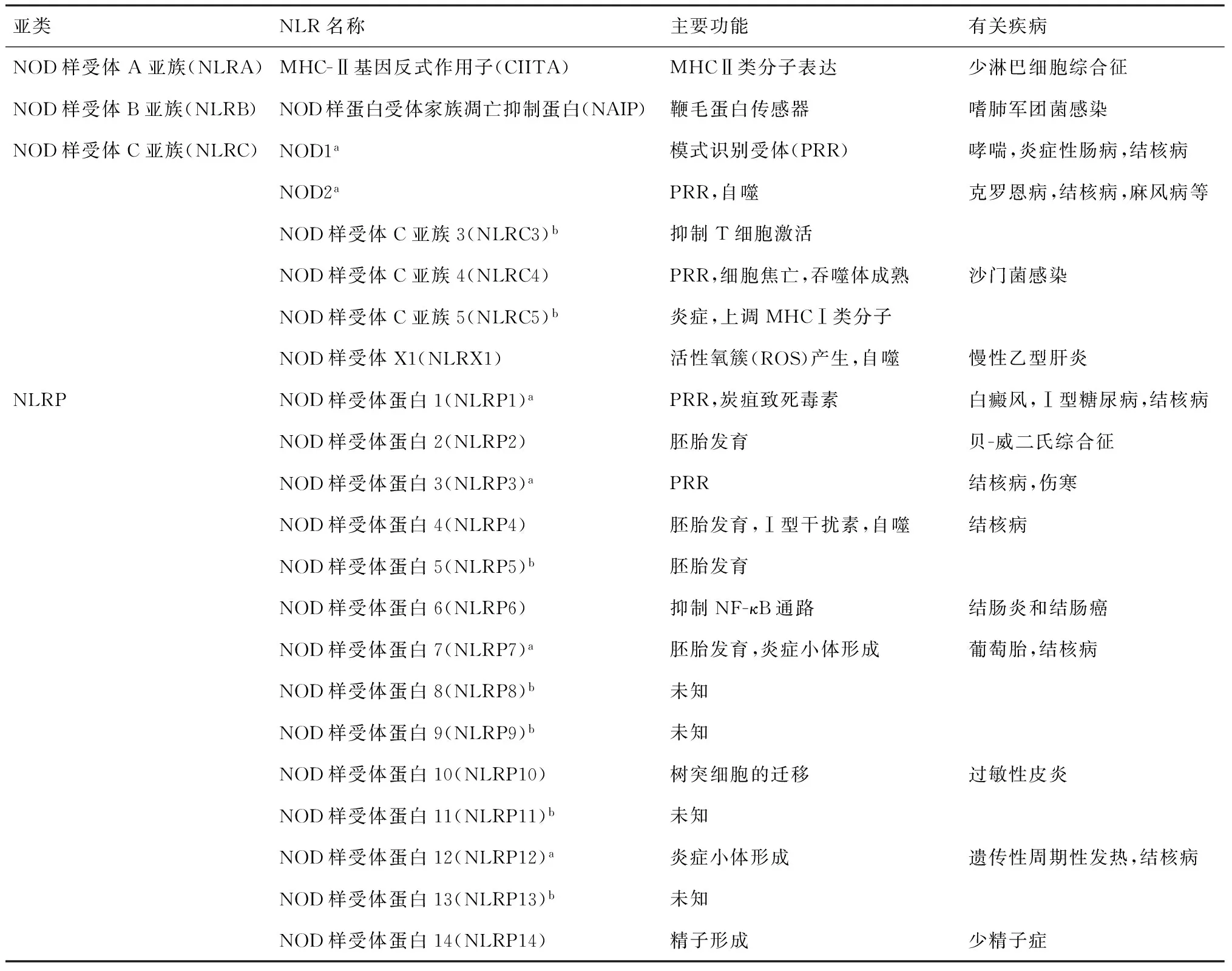
表1 目前已知的NLR家族成員的生物學功能及在相關疾病中的研究報道
注a:有與結核病相關的研究報道;b:功能未知或未見有相關疾病的研究報道
2. NLR基因和TB易感性:研究也表明,NLR基因的缺失和宿主對MTB的易感性密切相關。Hall等[16]首先報道了NOD1多態性和結核病之間的關系,為NOD受體與結核病之間的關系提供了研究方向和思路。NOD2基因中的研究表明,P268S、R702W和A725G等位置的單核苷酸多態性(single nucleotide polymorphisms,SNP)與結核病易感性有關[17]。P268S 和 R702W位點的突變可有效提高NOD2結構的穩定性及其與MTB的結合,進而有助于對結核病的防御;A725G位點的多態性與MTB易感性升高有關[18]。另有報道認為,NOD2基因中R587R (CGT→CGG) 的多態性和中國漢族人群的結核病易感性密切相關[19];Pan等[20]也報道NOD2基因中rs7194886位點的SNP可能與中國漢族人群對MTB的易感性變化有關。
NOD1和NOD2識別MTB的免疫機制研究讓我們對NLR在MTB感染和結核病發病過程的作用有初步認識,更說明了NLR的重要作用和地位,進一步就NLR對MTB免疫應答的過程進行總結分析,將對于結核病發病和致病機制有更深入的理解。
二、NLR介導的主要免疫應答過程
NLR在MTB感染中可識別其胞壁成分,介導固有免疫反應對MTB的殺傷作用和生長抑制,引起多種細胞因子的產生,介導自噬、炎癥小體的形成以及啟動適應性免疫應答,參與宿主對結核病的免疫和防御反應[21]。
1.介導NO對MTB的殺傷作用:活性氧簇(reactive oxy-gen species,ROS)和活性氮簇(reactive nitrogen species,RNS)在結核病的免疫應答中起重要作用。NO作為重要的RNS 物質,在防御MTB感染中有重要作用。MTB感染后由肺泡巨噬細胞吞噬,激活的巨噬細胞產生iNOS,可誘導NO的產生。這些RNS通過對MTB的核酸、蛋白質、脂質和碳水化合物等多種分子起調控作用,殺傷MTB,參與對MTB感染的防御反應[8]。
NOD2作為重要的胞內PRR,與分枝桿菌細胞壁成分MDP結合,通過NF-κB通路可上調iNOS的表達,促進NO產生。NO在固有免疫反應中,對抑制MTB的生長有重要作用[22]。NOD2不僅是巨噬細胞內抵抗細菌的重要防線,在早期感染中對細菌的殺傷也有重要作用。
2.介導細胞因子的產生和表達水平變化:MTB感染時 NOD2介導巨噬細胞及DC產生炎癥因子如TNF-α、IL-6和IL-1β。其中,NLR參與形成的炎癥小體對IL-1β的分泌有重要意義。NOD2與NLRP1導致含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase1,caspase-1)激活介導炎癥發生,通過炎癥清除作用抑制細菌生長[23]。
MTB感染時NOD1和NOD2還通過協同作用介導巨噬細胞產生炎癥因子和趨化因子等細胞因子,引起炎癥反應清除細菌感染。雖然NOD1和NOD2可以通過協同作用刺激IL-6和IL-1β的產生,但實驗顯示僅NOD1缺陷時,細胞因子水平無明顯變化,而NOD1和NOD2雙缺陷的巨噬細胞內IL-6和IL-1β水平的降低程度比NOD2單缺陷的細胞降低程度大。這表明NOD1在免疫反應中細胞因子的產生過程中也有一定的作用,其在細胞因子產生中的作用有待進一步研究和闡釋[12]。
3.介導和參與炎癥小體產生:炎癥小體是多種蛋白構成的復合物,對于caspase-1的激活與成熟IL-1β的產生非常重要,其與宿主免疫防御和病原體清除有關,在固有免疫中發揮重要作用[24]。NLR家族中NLRP1b、NLRP3、NLRC4都參與形成炎癥小體。最近報道NLRP6 和 NLRP12 也參與炎癥小體的形成[25]。其中NLRP3是危險信號的胞內感受器,NLRP3炎癥小體是最具特征性的炎癥小體,由NLRP3骨架,包含半胱天冬酶招募結構域適配器的凋亡顆粒蛋白和caspase-1組成。
MTB感染與炎癥小體之間的關系非常復雜。結核感染時,NOD2識別MTB胞壁成分MDP,誘導巨噬細胞和DC內NLRP3炎癥小體的形成,促進炎癥因子IL-1β和IL-18的釋放。另外,NO也可通過抑制NLRP3炎癥小體依賴的IL-1β 產生,調控結核的免疫反應[26],MTB感染導致的炎癥小體的激活也會受到DNA甲基化的修飾調控。
4.介導細胞自噬調控對MTB的清除和殺傷:研究表明,在肺泡巨噬細胞內,NOD1激活引起的依賴RIP2方式的自噬激活是固有免疫受體介導的重要抗菌機制之一,是抑制MTB進入肺泡的重要機制[27]。NOD1介導肺泡巨噬細胞內自噬相關蛋白免疫相關鳥苷三磷酸酶家族M蛋白(immunity-related GTPase family M protein,IRGM)的過表達,介導自噬而且協同清除胞內病原體,對MTB的殺傷有重要作用。
MTB感染后NOD2和MDP結合,引起自噬相關蛋白IRGM、抗菌肽蛋白輕鏈3(light chain3,LC3)和自噬相關16樣蛋白1(autophagy-related protein 16 like protein 1,ATG16L1)被募集到吞噬細菌的吞噬體和自噬小體中,參與自噬和對MTB的殺傷。這表明可通過PRR依賴機制激活自噬,而不僅由細胞因子特別是γ干擾素(interferon-γ,IFN-γ)調控。且IRGM可通過與NOD2和其他模式識別受體如NOD1、維甲酸誘導基因-Ⅰ(retinoic acid-inducible gene-Ⅰ, RIG-Ⅰ)和部分TLR相互作用轉導微生物信號[28]。
MTB感染時,與NOD2作用相關的一個重要特征是肉芽腫的形成,肉芽腫導致細菌周圍低營養和低氧狀態。研究表明,在缺氧狀態下,NOD2可與硫酯結合誘導自噬,破壞缺氧細胞自噬和炎癥的平衡狀態[29]。該調控過程不通過NF-κB 通路參與反應,為結核病研究提供了新思路。
5.啟動適應性免疫應答:DC不僅是固有免疫系統的重要組成成分,對適應性免疫也有啟動作用。NLR可以通過激活DC,促進DC的遷移和成熟,刺激T細胞增殖和分泌細胞因子而啟動適應性免疫應答[30]。研究表明,NLR在DC細胞中還有一個重要功能是負責主要組織相容性復合體(major histocompatibility complex,MHC)分子的轉錄,MHC分子對T細胞的分化發育有重要作用,影響T細胞的分化和成熟。其中,NLRC5上調MHCⅠ類分子的表達,進而激活CD8+T細胞,啟動適應性免疫應答[31]。但最近有研究表明這種作用很弱,NLRC5啟動T細胞是通過激活DC作用的[32]。MHC Ⅱ類分子的轉錄依賴于NLR蛋白家族CIITA,這可能與其N端效應結構域有關[33]。NLRP3、NLRP12 與DC的具體作用仍在研究中。通過這些機制,NLR不僅在固有免疫中扮演重要角色,也在啟動適應性免疫應答方面發揮作用,這對了解在結核感染時NLR與固有免疫和適應性免疫的關系有重要意義。
6.NLR與TLR協同發揮作用的研究:NLR與TLR作為細胞內的兩大類重要模式識別受體,二者之間存在相互促進和協同作用,如NOD2與TLR2、TLR9的協同作用,NOD1、NOD2與TLR4的協同作用等已經有所研究[34]。NOD2和TLR4信號通路通過協同增強DC的激活,促進細胞因子的產生,促進NO生成和自噬作用殺傷細菌,增強DC的吞噬能力,促進DC向淋巴結遷移,提高效應T細胞的記憶反應,促進IFN-γ和TNF-α的釋放,啟動適應性免疫應答等多種作用,與抗結核藥物聯合使用時減少抗結核藥物的劑量,提高藥物的殺菌能力[35]。開發新疫苗的研究中也表明同時激活TLR9和NOD2受體,可加速促炎因子的釋放,提高結核DNA疫苗的免疫原性[36]。NLR與TLR的協同作用雖有眾多研究,但其在MTB感染時的作用還未充分驗證,這種協同作用對于結核病防治的意義有待進一步探索。
三、展望
免疫系統對于MTB的識別過程和調控機制非常復雜,其相互作用是研究的重點和難點[37],甚至有關研究表明MTB可以通過改造PRR,逃逸宿主對其的殺傷[38],這就更說明了研究PRR對MTB的免疫應答過程對認識MTB感染發病過程中的重要性和意義。
目前NLR與MTB相互作用的研究仍不成熟,在MTB感染時NLR在免疫系統中發揮作用的時期和具體機制還不甚清楚,在對促進細胞因子的產生,炎癥小體形成,介導NO的殺傷作用等多個方面的生物活性的研究還不充分。而NLR介導的自噬作用與MTB對抗自噬的生物作用的強弱還未充分研究,以及NLR基因多態性與結核病易感性的關系都值得深入研究。NLR作為一種模式識別受體與其他PRR之間的相互作用更有待進一步探索。
深入開展對NLR參與免疫應答的機制和其與結核病的復雜關系的研究,將有助于為結核病的基礎和應用研究提供新靶標和研究方向,為結核病的預防和治療奠定重要理論基礎。
[1] Schorey JS, Schlesinger LS. Innate immune responses to tuberculosis. Microbiol Spectr, 2016, 4(6).
[2] 吳小娥, 陳晶, 宋淑霞. 固有免疫細胞對結核分枝桿菌的免疫識別. 中國防癆雜志, 2015, 37(2):189-193.
[3] Kim YK, Shin JS, Nahm MH. NOD-like receptors in infection, immunity, and diseases. Yonsei Med J, 2016, 57(1):5-14.
[4] Ting JP, Lovering RC, Alnemri ES, et al. The NLR gene family: a standard nomenclature. Immunity, 2008, 28(3):285-287.
[5] Motta V, Soares F, Sun T, et al. NOD-like receptors: versatile cytosolic sentinels. Physiol Rev, 2015, 95(1):149-178.
[6] Zhong Y, Kinio A, Saleh M. Functions of NOD-like receptors in human diseases. Front Immunol, 2013, 4:333.
[7] Sharma N, Jha S. NLR-regulated pathways in cancer: opportunities and obstacles for therapeutic interventions. Cell Mol Life Sci, 2016, 73(9): 1741-1764.
[8] Mortaz E, Adcock IM, Tabarsi P, et al. Interaction of pattern recognition receptors withMycobacteriumtuberculosis. J Clin Immunol, 2015, 35(1):1-10.
[9] Monie TP. NLR activation takes a direct route. Trends Biochem Sci, 2013, 38(3): 131-139.
[10] Jeong YJ, Kang MJ, Lee SJ, et al. Nod2 and Rip2 contribute to innate immune responses in mouse neutrophils. Immunology, 2014, 143(2): 269-276.
[11] Saxena M, Yeretssian G. NOD-like receptors: master regulators of inflammation and cancer. Front Immunol, 2014, 5:327.
[12] Lee JY, Hwang EH, Kim DJ, et al. The role of nucleotide-binding oligomerization domain 1 during cytokine production by macrophages in response toMycobacteriumtuberculosisinfection. Immunobiology, 2016, 221(1): 70-75.
[13] Brooks MN, Rajaram MV, Azad AK, et al. NOD2 controls the nature of the inflammatory response and subsequent fate ofMycobacteriumtuberculosisand M. bovis BCG in human macrophages. Cell Microbiol, 2011, 13(3):402-418.
[14] Kim TH, Park JH, Park YM, et al. Synergistic effect of muramyl dipeptide with heat shock protein 70 fromMycobacteriumtuberculosison immune activation. Immunobiology, 2015, 220(1): 26-31.
[15] Landes MB, Rajaram MV, Nguyen H, et al. Role for NOD2 inMycobacteriumtuberculosis-induced iNOS expression and NO production in human macrophages. J Leukoc Miol, 2015, 97(6): 1111-1119.
[16] Hall NB, Igo RP Jr, Malone LL, et al. Polymorphisms inTICAM2 andIL1Bare associated with TB. Genes Immun, 2015, 16(2):127-133.
[17] Azad AK, Sadee W, Schlesinger LS. Innate immune gene poly-morphisms in tuberculosis. Infect Immun, 2012, 80(10): 3343-3359.
[18] Khalilullah SA, Harapan H, Hasan NA, et al. Host genome polymorphisms and tuberculosis infection: What we have to say? Egypt J Chest Dis Tuberc, 2014, 63(1): 173-185.
[19] Zhao M, Jiang F, Zhang W, et al. A novel single nucleotide polymorphism within the NOD2 gene is associated with pulmonary tuberculosis in the Chinese Han, Uygur and Kazak populations. BMC Infect Dis, 2012, 12:91.
[20] Pan H, Dai Y, Tang S, et al. Polymorphisms of NOD2 and the risk of tuberculosis: a validation study in the Chinese popu-lation. Int J Immunogenet, 2012, 39(3):233-240.
[21] Behr MA, Divangahi M. Freund’s adjuvant, NOD2 and mycobacteria. Curr Opin Microbiol, 2015, 23:126-132.
[23] Philpott DJ, Sorbara MT, Robertson SJ, et al. NOD proteins: regulators of inflammation in health and disease. Nat Rev Immunol, 2014, 14(1):9-23.
[24] Wei M, Wang L, Wu T, et al. NLRP3 activation was regulated by DNA methylation modification duringMycobacteriumtuberculosisinfection. Biomed Res Int, 2016, 2016: 4323281.
[25] Gurung P, Kanneganti TD. Immune responses against protozoan parasites: a focus on the emerging role of Nod-like receptors. Cell Mol Life Sci, 2016, 73(16):3035-3051.
[26] Mishra BB, Rathinam VA, Martens GW, et al. Nitric oxide controls the immunopathology of tuberculosis by inhibiting NLRP3 inflammasome-dependent processing of IL-1β. Nat Immunol, 2013, 14(1): 52-60.
[27] Juárez E, Carranza C, Hernández-Sánchez F, et al. Nucleotide-oligomerizing domain-1 (NOD1) receptor activation induces pro-inflammatory responses and autophagy in human alveolar macrophages. BMC Pulm Med, 2014, 14:152.
[28] Chauhan S, Mandell MA, Deretic V. Mechanism of action of the tuberculosis and Crohn disease risk factor IRGM in autophagy. Autophagy, 2016, 12(2):429-431.
[29] Nabatov AA, Hatzis P, Rouschop KM, et al. Hypoxia induci-ble NOD2 interacts with 3-O-sulfogalactoceramide and regulates vesicular homeostasis. Biochim Biophys Acta, 2013, 1830(11): 5277-5286.
[30] Khan N, Vidyarthi A, Pahari S, et al. Signaling through NOD-2 and TLR-4 Bolsters the T cell Priming Capability of Dendritic cells by Inducing Autophagy. Sci Rep, 2016, 6:19084.
[31] Yoshihama S, Roszik J, Downs I, et al. NLRC5/MHC class Ⅰ transactivator is a target for immune evasion in cancer. Proc Natl Acad Sci U S A, 2016, 113(21):5999-6004.
[32] Rota G, Ludigs K, Siegert S, et al. T cell priming by activated Nlrc5-deficient dendritic cells is unaffected despite partially reduced MHC Class Ⅰ levels. J Immunol, 2016, 196(7):2939-2946.
[33] Neerincx A, Jakobshagen K, Utermohlen O, et al. The N-terminal domain of NLRC5 confers transcriptional activity for MHC class Ⅰ and Ⅱ gene expression. J Immunol, 2014, 193(6):3090-3100.
[34] Gause KT, Wheatley AK, Cui J, et al. Immunological principles guiding the rational design of particles for vaccine delivery. ACS Nano, 2017, 11(1):54-68.
[35] Khan N, Pahari S, Vidyarthi A, et al. NOD-2 and TLR-4 signaling reinforces the efficacy of dendritic cells and reduces the dose of TB drugs againstMycobacteriumtuberculosis. J Innate Immun, 2016, 8(3):228-242.
[36] Poecheim J, Heuking S, Brunner L, et al. Nanocarriers for DNA vaccines: co-delivery of TLR-9 and NLR-2 ligands leads to synergistic enhancement of proinflammatory cytokine release. Nanomaterials (Basel), 2015, 5(4): 2317-2334.
[37] 劉毅, 張亞莉, 張旭霞, 等. 結核分枝桿菌感染和免疫逃逸機制研究進展. 中華微生物學和免疫學雜志, 2015, 35(5):398-400.
[38] Cambier CJ, Takaki KK, Larson RP, et al. Mycobacteria manipulate macrophage recruitment through coordinated use of membrane lipids. Nature, 2014, 505(7482):218-222.
2017-04-05)
(本文編輯:李敬文)
Recentresearchprogressofthenucleotide-bindingoligomerizationdomain-likereceptorimmuneresponsetoMycobacteriumtuberculosisinfection
ZHANGYu-qing,ZHANGXu-xia,LIUYi,LIChuan-you.
DepartmentofBacterio-logyandImmunology,BeijingKeyLaboratoryforDrugResistanceTuberculosisResearch,BeijingChestHospital,CapitalMedicalUniversity,BeijingTuberculosisandThoracicTumorResearchInstitute,Beijing101149,China
s:LIUYi,Email:liuyilotus@hotmail.com;
Mycobacteriumtuberculosis(MTB) is the main pathogenic bacteria of Tuberculosis (TB). The immune responses of the host play an important role in the process of tuberculosis pathogenesis, which mainly work dependent on pattern recognition receptors (PPRs). Nucleotide-binding oligomerization domain-like receptor (NLR) is one of the important PPRs, which plays a vital role in the infection and pathogenesis of MTB. More than 20 types of NLR have been discovered hitherto. NLR primarily responses to intracellular bacteria and viruses, as well as the products released or degraded from these microorganisms. NLR functions in the process of recognition and elimination of pathogens by innate immune system in the early infection of MTB, as well as initiating adaptive immune response, secreting cytokines and inducing inflammation and autophagy. In recent years, the study of NLR has got new progress. In this paper, the immune response to MTB infection mediated by NLR and its relationship with the TB pathogenesis were analyzed comprehensively, so as to provide new clues for the study of interaction between MTB and host cells.
Receptors, pattern recognition; Receptors, proteinase-activated;Mycobacteriumtuberculosis; Infection; Immunity
10.3969/j.issn.1000-6621.2017.12.017
首都衛生發展科研專項(首發2014-4-2163);北京市醫院管理局青苗計劃(QML20161601)
101149 首都醫科大學附屬北京胸科醫院 北京市結核病胸部腫瘤研究所 耐藥結核病研究北京市重點實驗室細菌免疫室
劉毅,Email:liuyilotus@hotmail.com;李傳友,Email:lichuanyou6688@hotmail.com
LIChuan-you,Email:lichuanyou6688@hotmail.com

