RRAGD-EGFP融合蛋白在MDA-MB-436細胞中的表達定位
張崢嶸,鄭幽,阮班展,王嫚娜,梁劍青,李世崇,黃紅艷,閆敏,陳昭烈,劉真真,孫強
1.鄭州大學附屬腫瘤醫院 乳腺科,河南 鄭州 450008;2.軍事醫學科學院 生物工程研究所,北京 100071;3.首都醫科大學附屬北京世紀壇醫院 腫瘤內科,腫瘤治療性疫苗北京市重點實驗室,北京 100038
RRAGD-EGFP融合蛋白在MDA-MB-436細胞中的表達定位
張崢嶸1,2,鄭幽2,阮班展2,王嫚娜2,梁劍青2,李世崇2,黃紅艷3,閆敏1,陳昭烈2,劉真真1,孫強2
1.鄭州大學附屬腫瘤醫院 乳腺科,河南 鄭州 450008;2.軍事醫學科學院 生物工程研究所,北京 100071;3.首都醫科大學附屬北京世紀壇醫院 腫瘤內科,腫瘤治療性疫苗北京市重點實驗室,北京 100038
目的:構建RRAGD-EGFP融合基因表達載體pQCXIP-RRAGD-EGFP,并檢測RRAGD-EGFP融合蛋白在MDA-MB-436細胞中的表達定位。方法:提取HEK293細胞總RNA,逆轉錄得到cDNA并擴增RRAGD基因,克隆入逆轉錄載體pQCXIP-EGFP-N1,病毒包裝后感染人乳腺癌細胞系MDA-MB-436,活細胞觀察其在細胞內的表達定位。結果:構建獲得逆轉錄病毒載體pQCXIP-RRAGD-EGFP,融合蛋白RRAGD-EGFP定位于胞漿囊泡和細胞核。結論:RRAGD-EGFP融合蛋白在MDA-MB-436細胞中表達定位于胞漿囊泡,與其參與溶酶體調節功能一致,為后續分析RRAGD在cell-in-cell中的作用奠定了基礎。
Ras相關GTP結合蛋白D(RRAGD);基因克隆;cell-in-cell
Ras相關GTP結合蛋白D(Ras-related GTP binding protein D,RRAGD)由400個氨基酸殘基組成,相對分子質量為45 588。RRAGD基因位于染色體6q15,編碼區長1200 bp[1]。
RRAGD是GTR/RAG GTP結合蛋白家族的一員,哺乳動物體內的該家族成員還包括RRAGA、RRAGB、RRAGC[2-3]。這4種蛋白在結構上均有能與GTP/GDP結合的Loop環和異二聚化結構域,從而決定了其在功能上具有小G蛋白活性和異二聚化的能力。因此,它們作為一個分子開關參與生物過程[4]。另外,它們兩兩結合,形成了RRAG A/B-C/D異二聚體(其中RRAGA和RRAGB、RRAGC與RRAGD是同源類似物),又稱Rag復合體(Rag complex)[3,5-8]。該復合體可與溶酶體上的Ragulator結合并被氨基酸激活,促進mTORC1(mTOR complex 1)從胞漿轉移到溶酶體膜表面,并被溶酶體膜上重要的小G蛋白Rheb(Ras ho?molog enriched in brain)激活[9-11]。
為了在活細胞中研究RRAGD的定位分布,我們擬構建RRAGD與綠色熒光蛋白的融合表達載體。為此,我們提取了HEK293細胞中的RNA,逆轉錄得到cDNA后擴增RRAGD基因,連入逆轉錄表達載體pQCXIP-EGFP-N1得到pQCXIPRRAGD-EGFP,進一步在MDA-MB-436細胞中檢查了融合蛋白的亞細胞定位。
1 材料和方法
1.1 材料
MDA-MB-436細胞系來自美國ATCC細胞庫,293FT細胞和HEK293細胞為本實驗室保存(均采用Macgene公司的DMEM培養基培養);大腸桿菌Trans10和反轉錄試劑盒購自北京全式金生物技術有限公司;載體pQCXIP-EGFP-N1由本實驗保存;瓊脂糖凝膠回收試劑盒、質粒快速提取試劑盒和質粒無內毒素提取試劑盒均購自天根公司;TRIzol購自Ambion公司;T載體購自Pro?mega公司;Q5高保真DNA聚合酶,限制性內切酶BglⅡ、AgeⅠ、XhoⅠ,T4DNA 連接酶購自NEB 公司;LipofectAMINE 2000、嘌呤霉素均購自Invitro?gen公司;玻璃底30 mm培養皿購自NEST公司。
1.2 HEK293總RNA的提取和反轉錄PCR
收獲2×107HEK293細胞,加入1 mL TRIzol,吹打數次后吸入離心管,室溫靜止5 min使其充分裂解;加入0.2 mL氯仿,振蕩混勻后室溫靜置10 min,4℃、12 000 r/min離心15 min;取上清至另一離心管中,加入等量的異丙醇,將管中液體輕輕混勻,室溫靜置10 min,4℃、12 000 r/min離心10 min,棄上清;加入1 mL 75%乙醇,輕輕懸浮沉淀,4℃、7500 r/min離心 5 min,棄上清;晾干,加入 20 μL DEPC 水溶解(65℃,促溶 10~15 min);定量RNA。取1 μg總RNA進行反轉錄(反轉錄體系:1 μg RNA,1 μL Primer,10 μL Re?action Mix,1 μL Enzyme Mix,1 μL Remover,DHPC水補齊至20 μL),將上述體系混勻,42℃、30 min反轉錄,85℃、5 min使反轉錄酶失活。
1.3 RRAGD基因擴增和RRAGD-EGFP融合基因表達載體構建
以得到的cDNA為模板擴增RRAGD基因,引物 為 F1(5'-CGCTCGAGATGAGCCAGGTGCTGGG GAAGC-3')和 R1(5'-CGACCGGTCGCAGCAGCA CTCTAGGGGTCCCAT-3')。PCR 擴 增 條 件 :95℃10 s,62℃ 15 s,72℃ 45 s,30個循環。PCR使用Q5高保真聚合酶。膠回收擴增產物,用Taq酶加A后連入pGEM-T載體,經XhoⅠ/AgeⅠ酶切鑒定正確后測序,測序正確后回收目的片段,連入pQCXIP-EGFP-N1載體的XhoⅠ/AgeⅠ位點,得到逆轉錄表達載體pQCXIP-RRAGD-EGFP(圖1)。
1.4 病毒包裝、感染
293FT細胞按 1×106/孔接種于6孔板,37℃、5%CO2條件下培養過夜。將目的逆轉錄病毒載體與包裝質粒Gag/Pol、VSVG-R用脂質體Lipo?fectAMINE 2000共轉染293FT細胞,6 h后換液,于24、48、72 h收取上清,用4.5 μm濾器過濾。將MDA-MB-436細胞按2×105/孔的密度接種于6孔板,每孔加入1 mL DMEM培養基、1 mL病毒上清和1.5 μL Polybrene,48 h后用嘌呤霉素(1 μg/mL)篩選4~5 d,獲得穩定目的細胞株。
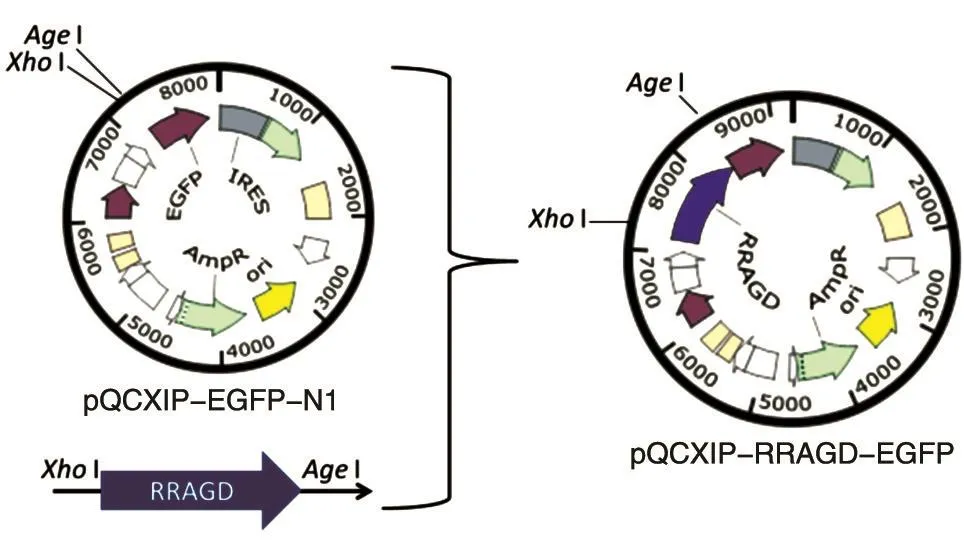
圖1 pQCXIP-RRAGD-EGFP表達載體的構建示意圖
1.5 活細胞觀察RRAGD-EGFP融合蛋白在MDAMB-436細胞中的分布
分別取目的細胞與未轉染的普通MDA-MB-436細胞2×105個,種于30 mm玻璃底培養皿中,37℃、5%CO2條件下培養過夜,12 h后在寬場活細胞熒光顯微鏡下,在FITC和明場下對RRAGDEGFP陽性細胞拍攝照片。
2 結果
2.1 pQCXIP-RRAGD-EGFP表達載體的構建
用引物F1和R1擴增所得產物約為1200 bp,與預期大小相符,提示擴增成功(圖2A)。將擴增所得片段連入T載體,用XhoⅠ/AgeⅠ酶切鑒定,電泳顯示片段大小正常(圖2B),同時測序顯示序列無突變(序列未示)。膠回收目的片段,連入逆轉錄病毒載體pQCXIP-EGFP-N1,轉化后挑2個克隆(C1、C2),分別用XhoⅠ/AgeⅠ、BglⅡ/AgeⅠ雙酶切鑒定,DNA電泳片段和模式與預期相符(圖2C),測序顯示插入序列正確無誤(序列未示),證明pQCXIP-RRAGD-EGFP表達載體構建成功。
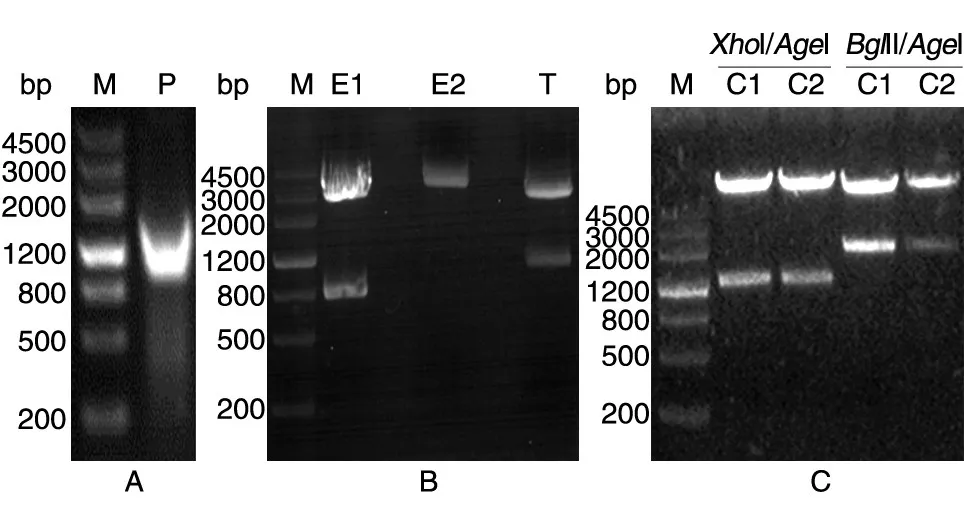
圖2 RRAGD基因的PCR擴增和表達載體酶切鑒定
2.2 RRAGD-EGFP融合基因的表達定位分析
已知RRAGD蛋白主要分布于細胞的胞漿、胞核和溶酶體,可能依賴于與其相關的核苷酸結合狀態而進出胞核。與此一致,我們發現MDAMB-436細胞中的RRAGD-EGFP蛋白表達分布在胞漿和胞核中,同時在胞漿囊泡中有特異性分布(圖3)。研究表明,在entosis(細胞侵入性死亡)的后期,mTORC1所調節的液泡分裂參與內部死亡細胞的代謝[12],而RRAGD作為募集mTORC1的關鍵分子,其在cell-in-cell結構中的表達分布仍未見報道,因此我們利用活細胞工作站觀察RRAGD-EGFP在cell-in-cell結構中的表達分布變化。結果顯示當內部細胞進入死亡狀態時,外部細胞的RRAGD-EGFP會聚集在內部細胞周圍,有明顯的聚集效應;而內部細胞處于活的狀態時,無此聚集效應(圖3)。提示RRAGD可能參與了cell-in-cell結構中內部細胞的死亡及代謝過程。
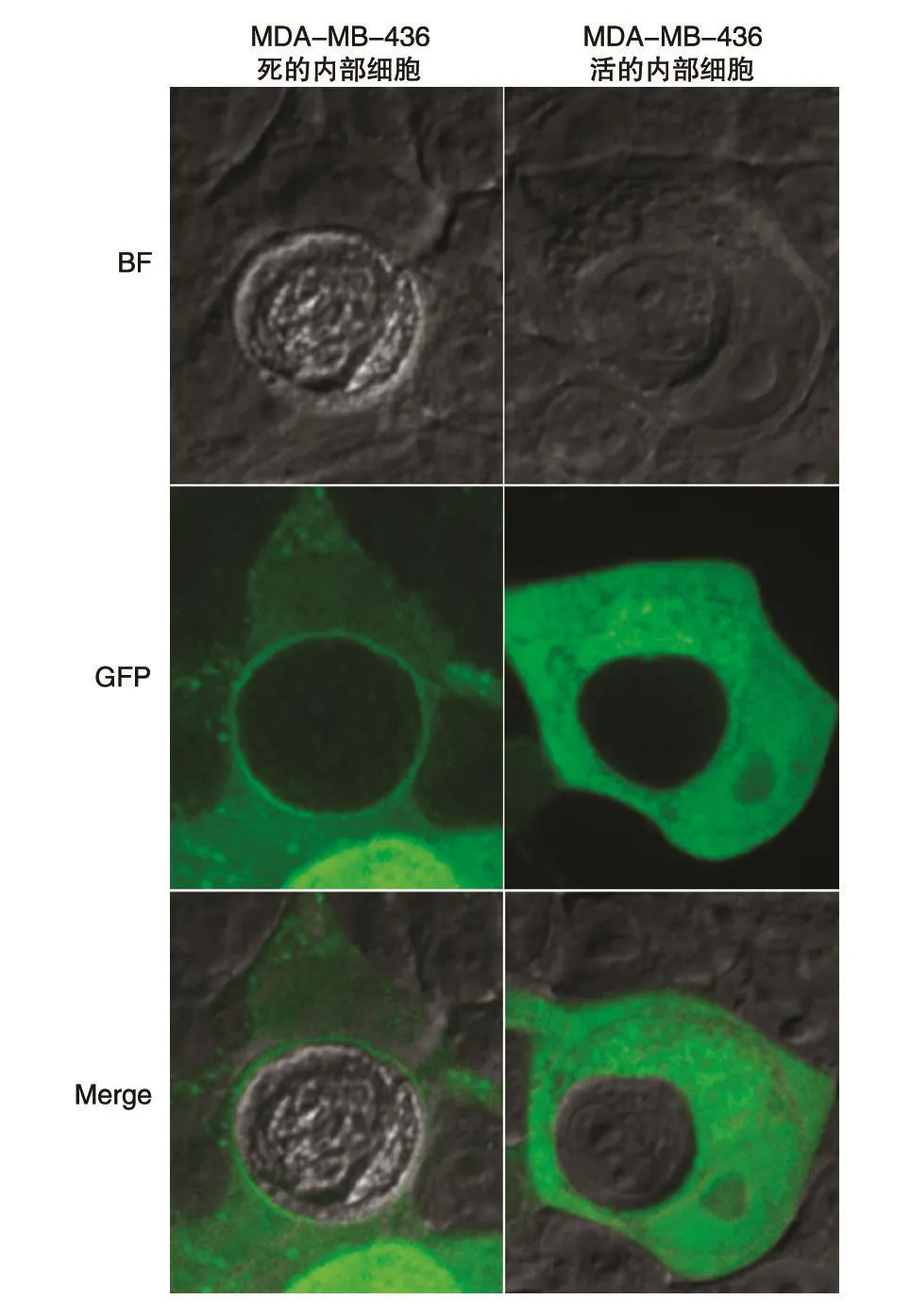
圖3 Cell-in-cell結構中外部細胞的RRAGD-EGFP融合蛋白定位
3 討論
通過建立表達RRAGD-EGFP融合蛋白的細胞系,為我們在活細胞水平研究RRAGD的表達及功能提供了便利:一方面,EGFP是無毒的,對細胞的生存狀態沒有影響,因此便于在熒光顯微鏡下長時間進行活細胞觀察,明確其表達分布的變化;另一方面,可以省去復雜的免疫熒光染色,同時簡化Western印跡實驗的抗體選擇。
RRAGD在多種組織,如皮膚、心臟、脊髓、睪丸和視網膜等中均有表達。RRAGD可以參與多種信號通路,尤其是其異二聚體復合物調節mTORC1活性的功能,具有很重要的生理意義[7]。我們前期研究發現RRADG在乳腺癌細胞系的不同單克隆細胞株中表達差異很大,同時與乳腺癌細胞的cell-in-cell形成率具有一定的相關性,因此,通過構建表達RRAGD-EGFP融合蛋白的細胞系,為探討RRAGD對cell-in-cell形成能力的作用及機制研究提供了合適的研究模型。
此外,在cell-in-cell結構中,內部細胞是被外部細胞所形成的液泡包裹的,部分液泡的命運與吞噬小體類似——液泡在外部細胞內經歷一定的事件后達到成熟,其成熟末期的標志即液泡的分解,液泡分裂后其內部營養和遺傳物質進入外部細胞并被利用[12]。在我們的實驗中發現,內部細胞處于死亡狀態時,外部細胞的RRAGD-EGFP有明顯的聚集效應,這一過程是否是通過募集mTORC1參與調節液泡的成熟,進而促進內部細胞的死亡還有待研究。同時,RRAGD及其形成的異二聚體復合物的活化是否能決定cell-in-cell結構中內部細胞的命運,也值得深入探索。
[1]Mungall A J,Palmer S A,Sims S K,et al.The DNA sequence and analysis of human chromosome 6[J].Nature,2003,425(6960):805-811.
[2]Kim E,Goraksha-Hicks P,Li L,et al.Regulation of TORC1 by Rag GTPases in nutrient response[J].Nat Cell Biol,2008,10(8):935-945.
[3]Sancak Y,Peterson T R,Shaul Y D,et al.The Rag GTPases bind raptor and mediate amino acid signal?ing to mTORC1[J].Science,2008,320(5882):1496-1501.
[4]Sekiguchi T,Todaka Y,Wang Y,et al.A novel hu?man nucleolar protein,Nop132,binds to the G pro?teins,RRAG A/C/D[J].JBiolChem,2004,279(9):8343-8350.
[5]Hirose E,Nakashima N,Sekiguchi T,et al.RagA is a functional homologue of S.cerevisiae Gtr1p involved in the Ran/Gsp1-GTPase pathway[J].J Cell Sci,1998,111(1):11-21.
[6]Schürmann A,Brauers A,Massmann S,et al.Cloning of a novel family of mammalian GTP-binding proteins(RagA,RagBs,RagB1)with remote similarity to the Ras-related GTPases[J].JBiolChem,1996,270(48):28982-28988.
[7]Sekiguchi T,Hirose E,Nakashima N,et al.Novel G proteins,Rag C and Rag D,interact with GTP-bind?ing proteins,Rag A and Rag B[J].J Biol Chem,2001,276(10):7246-7257.
[8]Kim Y M,Stone M,Hwang T H,et al.SH3BP4 is a negative regulator of amino acid-Rag GTPasemTORC1 signaling[J].Mol Cell,2012,46(6):833-846.
[9]Oshiro N,Rapley J,Avruch J.Amino acids activate mammalian target of rapamycin(mTOR)complex 1 with?out changing Rag GTPase guanyl nucleotide charging[J].J Biol Chem,2013,289(5):2658-2674.
[10]Roccio M,Bos J L,Zwartkruis F J.Regulation of the smallGTPase Rheb by amino acids[J].Oncogene,2006,25(5):657-664.
[11]Sancak Y,Bar-Peled L,Zoncu R,et al.Ragulator-Rag complex targets mTORC1 to the lysosomal sur?face and is necessary for its activation by amino acids[J].Cell,2010,141(2):290-303.
[12]Krajcovic M,Krishna S,Akkari L,et al.mTOR regu?lates phagosome and entotic vacuole fission[J].Mol Bi?ol Cell,2013,24(23):3736-3745.
Expression and Subcellular Localization of RRAGD-EGFP Fusion Protein in MDA-MB-436 Cells
ZHANG Zheng-Rong1,2,ZHENG You2,RUAN Ban-Zhan2,WANG Man-Na2,LIANG Jian-Qing2,LI Shi-Chong2,HUANG Hong-Yan3,YAN Min1,CHEN Zhao-Lie2,LIU Zhen-Zhen1*,SUN Qiang2*
1.Department of Breast,Cancer Hospital,Zhengzhou University,Zhengzhou 450008;2.Beijing Institute of Biotech?nology,Beijing 100071;3.Beijing Key Laboratory of Oncology and Oncology Vaccine,Beijing Shijitan Hospital,Capital University of Medical Sciences,Beijing 100038;China
Objective:To construct the retroviral expression vector for RRAGD-EGFP fusion protein,and exam?ine its subcellular localization in MDA-MB-436 cells.Methods:Total RNA was extracted from HEK293 cells and reverse transcribed into cDNA.RRAGD(Ras-related GTP binding protein D)gene was amplified by PCR and cloned into the retroviral expression vector pQCXIP-EGFP-N1 to construct pQCXIP-RRAGD-EGFP,followed by retrovirus was made and infected MDA-MB-436,a cell line of breast cancer.Afterwards,time lapse imaging was performed.Results:The retroviral expression vector for RRAGD-EGFP fusion protein was successfully constructed.RRAGD-EGFP fusion protein was found in cytoplasmic vesicles and nucleus.Conclusion:Localization of RRAGDEGFP fusion protein in cytoplasmic vesicles is consistent with its role in lysosomal biogenesis,which has laid foun?dation for the further study on the role of RRAGD in cell-in-cell.
Ras-related GTP binding protein D(RRAGD);gene cloning;cell-in-cell
Q78
A
1009-0002(2017)05-0639-04
10.3969/j.issn.1009-
*Co-corresponding authors,LIU Zhen-Zhen,E-mail:Liuzhenzhen73@163.com;SUN Qiang,E-mail:sunq@bmi.ac.cn
2017-04-05
國家自然科學基金(81572799,31671432);國家重點研發計劃(2016YFC1303303);北京市自然科學基金(7162091)
張崢嶸(1991- ),男,碩士研究生,(E-mail)18703605958@163.com;鄭幽(1989- ),女,助理研究員;二者為共同第一作者
劉真真,(E-mail)Liuzhenzhen73@163.com;孫強,(E-mail)sunq@bmi.ac.cn

