補腎益髓方及其拆方對自身免疫性腦脊髓炎小鼠腦和脊髓中BDNF/TrkB的影響
師一民 王永強 安 辰 趙 暉 李君玲 齊 放 張秋霞 陳振振 樊永平 李 明 王 蕾
(1 首都醫科大學中醫藥學院,中醫絡病研究北京市重點實驗室,北京,100069; 2 首都醫科大學附屬北京天壇醫院,北京,100050)
補腎益髓方及其拆方對自身免疫性腦脊髓炎小鼠腦和脊髓中BDNF/TrkB的影響
師一民1王永強1安 辰1趙 暉1李君玲1齊 放1張秋霞1陳振振1樊永平2李 明1王 蕾1
(1 首都醫科大學中醫藥學院,中醫絡病研究北京市重點實驗室,北京,100069; 2 首都醫科大學附屬北京天壇醫院,北京,100050)
目的:觀察補腎益髓(Bu Shen Yi Sui,BSYS)方及其拆方補腎(Bu Shen,BS)和化痰活血(Hua Tan Huo Xue,HTHX)方對實驗性自身免疫性腦脊髓炎(Experimental Autoimmune Encephalomyelitis,EAE)小鼠腦和脊髓中腦源性神經營養因子(Brain-derived Neurotrophic Factor,BDNF)與受體TrkB的影響。方法:將EAE造模小鼠于當天和第7天背部皮下注射髓鞘少突膠質細胞糖蛋白(Myelin Oligodendrocyte Glycoprotein,MOG)35-55抗原,并在免疫當天和第2天后腹腔注射百日咳毒素(Pertussis toxin,PTX)。每日對小鼠進行不同藥物的灌胃,并于造模第20和40天分別取腦和脊髓,采用實時熒光定量RT-PCR(qRT-PCR)與Western Blot法檢測BDNF和TrkB的表達。結果:BSYS及其拆方BS方與HTHX方均可明顯上調EAE小鼠腦和脊髓BDNF和TrkB mRNA與蛋白的表達,與模型組比較,差異均有統計學意義(P<0.05或P<0.01)。BSYS方作用優于其BS與HTHX方,但差異無統計學意義(P>0.05)。結論:BSYS及其拆方促進軸突修復的作用可能與增強BDNF/TrkB表達有關,BSYS全方更有顯著趨勢。
補腎益髓方;拆方;多發性硬化;實驗性自身免疫性腦脊髓炎;腦源性神經營養因子/TrkB
實驗性自身免疫性腦脊髓炎(Experimental Autoimmune Encephalomyelitis,EAE)是一種T細胞介導的中樞神經系統疾病,由于其臨床表現和病理變化與人類多發性硬化癥非常相似,因此,目前常常制備動物EAE作為研究MS的實驗模型[1]。前期研究發現,補腎益髓(Bu Shen Yi Sui,BSYS)方對MS患者及其EAE動物模型具有明顯的神經保護作用[2]。拆方研究發現,補腎益髓及其拆方補腎和化痰活血(HTHX)方均能降低EAE小鼠的神經功能評分,減輕其腦和脊髓的病理炎性反應損傷,減輕軸突損傷和促進其神經修復[3-5]。但其促進損傷的軸突修復機制還不清楚。研究證實,神經營養因子能夠促進神經細胞的存活、生長、分化。在眾多的神經生長因子中,腦源性神經營養因子(Brain-derived Neurotrophic Factor,BDNF)是成年大鼠腦內分布最為廣泛的神經營養因子,主要在皮質和海馬中合成。BDNF共有2個受體,一個是低親和力的P75受體,另一個是高親和力受體Trk,BDNF與TrkB結合后激活RAS/ERK與PI3K/AKT信號通路,進而調節其下游分子來發揮其神經修復作用[6-8]。TrkB受體在此信號通路中起著至關重要的作用。其為了深入探討補腎益髓及其拆方促進在軸突修復的作用機制,本實驗主要采用實時熒光定量RT-PCR(qRT-PCR)與Western Blot法觀察補腎益髓及其拆方補腎和化痰活血方對EAE小鼠腦與脊髓中BDNF和TrkB表達的影響。
1材料與方法
1.1 實驗材料
1.1.1 實驗動物 70只SPF級C57BL/6雌性小鼠(體重15~17 g)購于北京維通利華實驗動物技術有限公司[許可證號為SCXK(京)2012-0001]。動物飼養于首都醫科大學實驗動物中心(許可證號SYXK(京)2010-0020)的獨立通氣籠內,溫度18~22 ℃,相對濕度40% ~60%,自由飲水和飲食。所有實驗項目均通過首都醫科大學倫理委員會批準。
1.1.2 實驗藥物補腎益髓及其拆方補腎和化痰活血方均有北京亞東生物制藥有限公司制備。補腎益髓方由生地黃、熟地黃、浙貝母、水蛭、全蝎、益母草等組成;補腎方由生地黃、熟地黃等組成;化痰活血方由浙貝母、水蛭、全蝎、益母草等組成。醋酸潑尼松片(Prednisone Acetate,PA)由天津力生制藥有限公司生產,梓醇(Catapol,CA)由杭州康木科技有限公司提供。
1.1.3 主要試劑髓鞘少突膠質細胞糖蛋白(Myelin Oligodendrocyte Glycoprotein,MOG)35-55由北京旭和源生物科技有限公司合成;滅活結核分支桿菌(Mycobacterium Tuberculosis,TB,貨號231141)由美國BD公司提供。完全弗氏佐劑(Complete Freund′s Adjuvant,CFA,貨號F5881)、百日咳毒素(Pertussis Toxin,PTX,貨號P7208)均由美國Sigma公司提供;PCR引物由大連TaKaRa公司合成,RNA prep pure動物組織總RNA提取試劑盒(離心柱型)(DP431),TIANScript cDNA第一鏈合成試劑盒(KR104),RealMasterMix(SYBR Green)試劑盒(FP204),2×Taq PCR MasterMix(KT201-01),50bp DNA Ladder(MD108),MarkⅢ(MD103),GeneGreen核酸染料(RT210),均購自天根生化科技有限公司。
1.2 方法
1.2.1 分組與模型制備 將小鼠隨機分為7組:正常(NC)、模型(MO)、PA組、CA組、BS組、HTHX組及BSYS組。每組10只。EAE造模小鼠于造模當天與造模后第7天背部皮下注射0.2 mL抗原,包括MOG35-55(50 μg)、CFA(100 μL)和TB(0.3 mg),當天和第2天后腹腔注射500 ng的PTX。NC小鼠注射相同劑量的生理鹽水。
1.2.2 給藥方法 BSYS方組小鼠給予BSYS混懸液(3.02 g生藥/kg體重)灌胃;BS方組給予BS混懸液(1.44 g生藥/kg體重);HTHX方組給予HTHX混懸液(1.57 g生藥/kg體重);PA組小鼠給予PA混懸液(5 mg/kg體重);CA組給予CA(40 mg/kg體重);NC和MO組均給予等體積的蒸餾水灌胃。1次/d,共計40 d。
1.2.3 標本采集 于造模第20天(急性期)和第40天(緩解期),小鼠10%水合氯醛(190 mg/kg)腹腔注射麻醉后,取其腦及脊髓,快速放入液氮后移至-80 ℃冷凍保存。
1.2.4 qRT-PCR檢測小鼠腦及脊髓中BDNF、TrkB mRNA的表達 按照動物組織總RNA提取試劑盒說明書提取小鼠腦組織與脊髓組織RNA,然后根據RT-PCR kit的說明反轉錄為cDNA。引物序列見表1。擴增條件為95 ℃ 5 min變性,95 ℃ 10 s,52 ℃ 30 s,72 ℃ 30 s,共40個循環。以基因β-tubulin為內參對照,2-△△Ct(Ct代表循環閥值)表示BDNF和TrkB mRNA相對表達量。
1.2.5 Western Blot檢測小鼠腦及脊髓中BDNF和TrkB蛋白的表達 取小鼠腦與脊髓組織,按1∶7的比例加入蛋白裂解液,勻漿后,置于冰上30 min,4 ℃離心20 min后,取上清液。建立標準曲線,每孔加上清液100 μL,將96孔板置于37 ℃,反應120 min后,嚴格按照試劑盒說明書步驟進行檢測。用酶標儀測定450 nm處吸光值,制作標準曲線,計算樣本濃度,根據樣本蛋白濃度,稀釋使其終濃度為3 μg/μL。取樣本7 μL(含21 μg蛋白)蛋白樣品進行10%十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳,電轉50 min,5%脫脂奶粉室溫封閉1 h,分別加入BDNF(1∶10 000)/TrkB(1∶20 000)/β-tubulin(1∶100 000)的單克隆抗體,4 ℃過夜后,TBST洗膜4次,每次10 min,加入辣根過氧化物酶標記的二抗(1∶20 000,抗兔/小鼠),室溫孵育1 h,洗膜4次,每次5 min后,于暗室進行膠片曝光、顯影和定影。通過Image J圖像分析系統測定各蛋白條帶的灰度值,以目的蛋白條帶的灰度值與內參β-tubulin條帶灰度值的比值表示各蛋白的相對表達水平。

表1 引物序列

2結果
2.1.1 BSYS及其拆方BS和HTHX方對EAE小鼠腦與脊髓中BDNF mRNA表達的影響 QRT-PCR結果顯示,在造模的第20天和第40天,MO組小鼠腦和脊髓的BDNF mRNA表達較NC組明顯下降(P<0.01)。與MO組比較,各觀察組均能顯著升高BDNF mRNA表達,尤其PA和BSYS方組差異更為明顯(P<0.01),但治療各組差異無統計學意義。見表2。

表2 7組小鼠腦和脊髓中BDNF mRNA的變化
注:與NC組比較,**P<0.01;與MO組比較,△P<0.05,△△P<0.01
2.1.2 BSYS及其拆方BS和HTHX方對EAE小鼠腦與脊髓中TrkB mRNA表達的影響 qRT-PCR結果顯示,在造模第20天和第40天時,和NC組比較,MO組小鼠腦和脊髓的TrkB mRNA表達明顯下降(P<0.01)。與MO組比較,各觀察組均能顯著升高TrkB mRNA表達,尤其PA和BSYS方組差異有統計學意義(P<0.01)。而治療各組之間差異無統計學意義(P>0.05)。見表3。
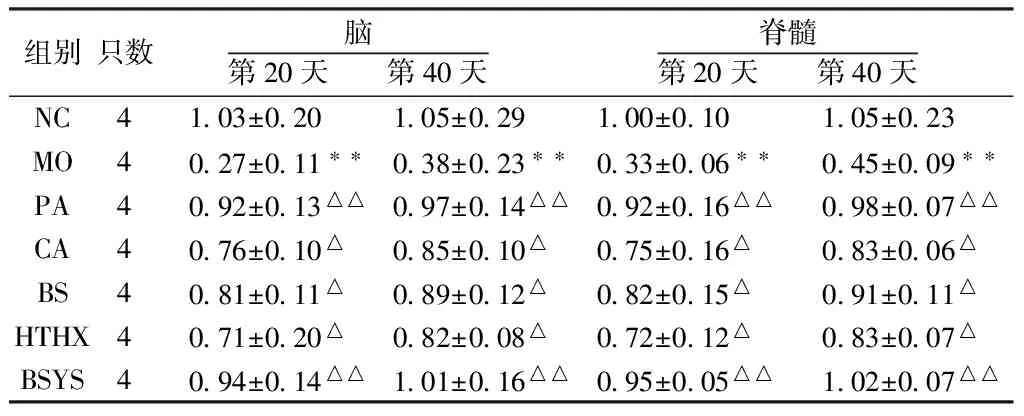
表3 7組小鼠腦和脊髓中TrkB mRNA的變化
注:與NC組比較,**P<0.01;與MO組比較,△P<0.05,△△P<0.01
2.1.3 BSYS及其拆方BS和HTHX方對EAE小鼠腦與脊髓中BDNF蛋白表達的影響 WB結果顯示,第20天和第40天,MO組小鼠腦和脊髓的BDNF蛋白表達較NC組明顯下降(P<0.01)。與MO組比較,各觀察組均能顯著升高BDNF蛋白表達,尤其PA和BSYS方組更為明顯(P<0.01),但治療各組之間差異無統計學意義(P>0.05)。見圖1-2,表4。
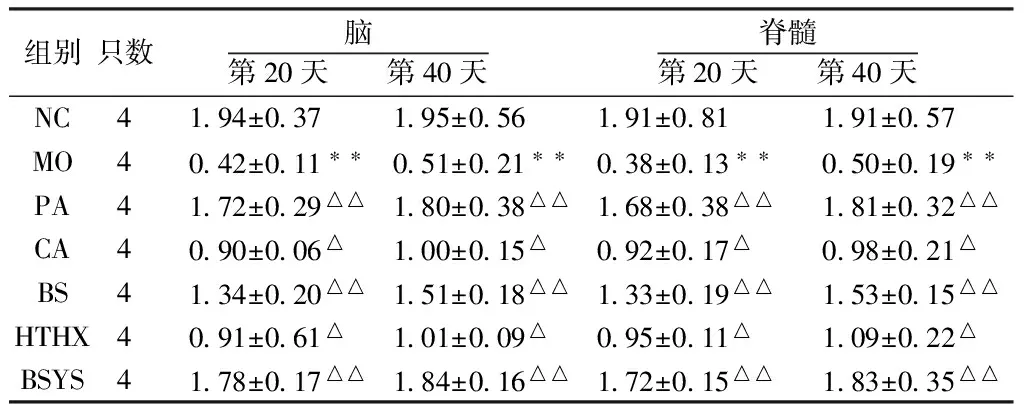
表4 7組小鼠腦和脊髓中BDNF蛋白的變化
注:與NC組比較,**P<0.01;與MO組比較,△P<0.05,△△P<0.01
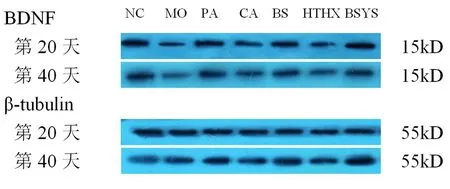
圖1 各組小鼠腦中BDNF蛋白的表達
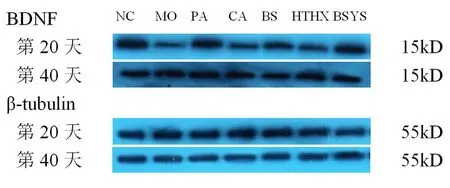
圖2 7組小鼠脊髓中BDNF蛋白的表達
2.1.4 BSYS及其拆方BS和HTHX方對EAE小鼠腦與脊髓中TrkB蛋白表達的影響 WB結果顯示,第20天和第40天,MO組小鼠腦和脊髓的TrkB蛋白表達較NC組明顯下降(P<0.01)。與MO組比較,各觀察組均能顯著升高TrkB蛋白表達,尤其PA和BSYS方組更為明顯(P<0.01),但治療各組之間差異無統計學意義(P>0.05)。見圖3-4,表5。
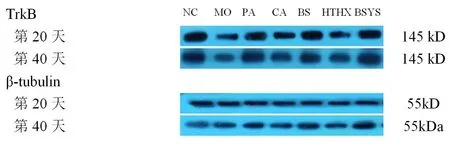
圖3 7組小鼠腦中TrkB蛋白的表達變化
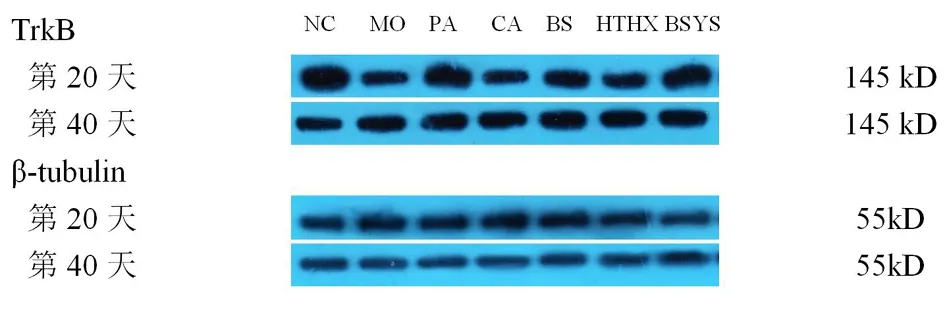
圖4 7組小鼠脊髓中TrkB蛋白的表達
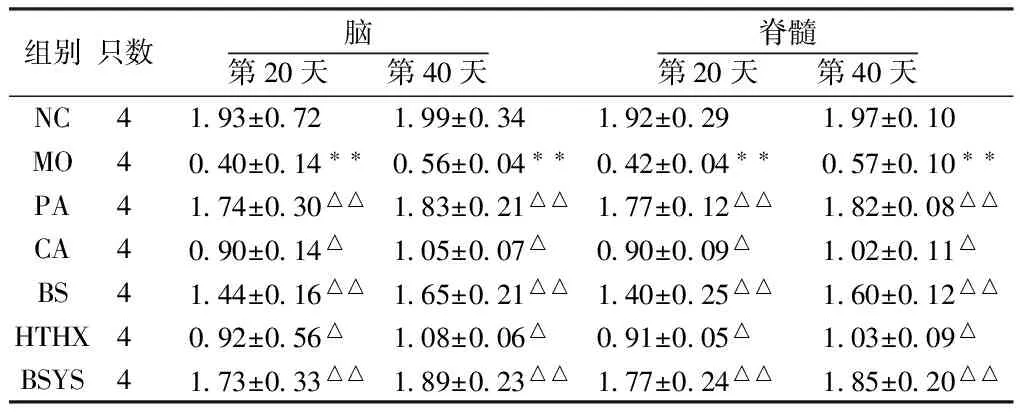
組別只數腦第20天第40天脊髓第20天第40天NC4193±072199±034192±029197±010MO4040±014??056±004??042±004??057±010??PA4174±030△△183±021△△177±012△△182±008△△CA4090±014△105±007△090±009△102±011△BS4144±016△△165±021△△140±025△△160±012△△HTHX4092±056△108±006△091±005△103±009△BSYS4173±033△△189±023△△177±024△△185±020△△
注:與NC組比較,**P<0.01;與MO組比較,△P<0.05,△△P<0.01
3討論
BDNF是1982年由德國生物學家Barde及其同事首次從豬腦中純化并發現具有防止神經元死亡功能的一種蛋白質,是目前研究最為廣泛的神經營養因子之一。內嗅皮層是位于顳葉、鄰近海馬的區域,內嗅皮層和海馬通過纖維投射和神經元換元,形成內嗅皮層-海馬環路[9-10]。內嗅皮層是BDNF產生的主要部位,并能夠轉運到海馬[11]。Marchetti和Marie[12]認為BDNF和TrkB的減少會降低突觸可塑性和損傷神經元,是皮層和海馬損傷的主要原因。有研究結果顯示BDNF與其受體TrkB共同作用可增加突觸可塑性,促進軸突及樹突生長,增加突觸末端密度[13-14],并激活下游的PI3K/AKT通路發揮神經保護作用[15-16]。
本課題組的前期研究發現,EAE小鼠存在軸突損傷狀態,主要表現在神經細胞骨架蛋白β-tubulin、NF200及MAP-2顯著下降,而β-APP,P-Tau及CSPGs則顯著上升,說明神經軸突損傷后神經細胞內運輸物質、塑性等方面發生障礙。經過BSYS及其拆方BS與HTHX方治療后,上述指標得到了明顯改善[3-5],說明BSYS及其BS與HTHX方對EAE小鼠軸突損傷修復作用。但其作用機制不清楚。近年來研究發現,軸突修復再生過程中存在著多種影響因素,神經營養因子類物質的缺乏是導致再生困難的主要因素之一。BDNF與其TrkB受體參與了神經保護作用[8]。MS和EAE小鼠腦BDNF表達顯著降低,基因敲除BDNF缺失后制備EAE小鼠模型,其神經損傷癥狀加重[17]。本實驗也發現,EAE小鼠的神經營養因子BDNF及其受體TrkB的基因和蛋白表達無論在急性期還是在緩解期均明顯降低。但在MS患者脫髓鞘區域BDNF表達增高,推測是起到神經保護和自我修復作用[18]。外源性BDNF可以延長其潛伏期,降低神經功能評分[19]。而經過BSYS及其拆方BS與HTHX方治療后,BDNF/TrkB的表達明顯增加。結合前期發現的BSYS及其拆方BS與HTHX方能夠促進軸突再生修復的實驗結果,推測BSYS及其拆方促進軸突修復的作用機制可能與增加神經營養因子及其受體的表達有關,并且BSYS全方較拆方的作用更有顯著趨勢。進一步的研究發現,BDNF-TrkB活化后激活其下游信號的PI3K/AKT通路,并參與了軸突損傷后的神經修復。研究MS患者大腦白質的基因表達發現PI3K/AKT信號通路有助于腦內環境的穩定與神經保護作用[20]。上述研究為BSYS方治療MS的機制提供的部分客觀依據,深入的作用機制還有待進一步研究。
[1]王維治.神經系統脫髓鞘疾病[M].北京:人民衛生出版社,2011:99-114.
[2]房玲,樊永平,趙暉,等.補腎益髓方防治多發性硬化的研究進展[J].中醫藥導報,2013,19(12):108-110.
[3]安辰,王永強,師一民,等.補腎益髓方及其拆方對實驗性自身免疫性腦脊髓炎小鼠腦和脊髓中β-APP和MAP-2表達的影響[J].中國中醫急癥,2016,25(4):565-568,587.
[4]安辰,王永強,師一民,等.補腎益髓方及其拆方對實驗性自身免疫性腦脊髓炎小鼠的神經保護作用及NF200和CSPGs表達的影響[J].中華中醫藥雜志,2016,31(4):1215-1220.
[5]師一民,王永強,安辰,等.補腎益髓方及其拆方對實驗性自身免疫性腦脊髓炎小鼠腦和脊髓中p-Tau和Beta-tubulin表達的影響[J].世界中醫藥,2016,9(11):1825-1830.
[6]Yoshii A,Constantine-Paton M.Postsynaptic BDNF-TrkB signaling in synapse maturation,plasticity,and disease[J].Dev Neurobiol,2010,70(5):304-322.
[7]Gonzalez A,Moya-Alvarado G,Gonzalez-Billaut C,et al.Cellular and molecular mechanisms regulating neuronal growth by brain-derived neurotrophic factor[J].Cytoskeleton(Hoboken).2016,73(10):612-628.
[8]師一民,李明,王蕾,等.神經營養因子在多發性硬化神經再生修復中的作用研究進展[J].醫學綜述,2016,22(24):4785-4787.
[9]Pilly PK,Grossberg S.How do spatial learning and memory occur in the brain:coordinated learning of entorhinal grid cells and hippocampal place cells[J].J Cogn Neurosci,2012,24(5):1031-1054.
[10]Buzsáki G,Moser EI.Memory,navigation and theta rhythm in the hippocampal-entorhinal system[J].Nat Neurosci,2013,16(2):130-138.
[11]Lu B.BDNF and activity-dependent synaptic modulation[J].Learn Mem,2003,10(2):86-98.
[12]Marchetti C,Marie H.Hippocampal synaptic plasticity in Alzheimer′s disease:what have we learned so far from transgenicmodels[J].Rev Neurosci,2011,22(4):373-402.
[13]Yang LC,Li J,Xu SF,et al.L-3-n-butylphthalide Promotes Neurogenesis and Neuroplasticityin Cerebral Ischemic Rats[J].CNS NeurosciTher.2015,21(9):733-741.
[14]Zhao W,Luo C,Wang J,et al.3-N-butylphthalide improves neuronal morphology after chronic cerebral ischemia[J].Neural Regen Res,2014,9(7):719-726.
[15]Xing M,Sun Q,Wang Y,et al.Hydroxysafflor yellow A increases BDNF and NMDARs in the hippocampus in a vascular dementia rat model[J].Brain Res,2016,1642:419-425.
[16]Fang M,Yuan Y,Lu J,et al.Scutellarin promotesmicroglia-mediated astrogliosis coupled with improved behavioral function in cerebral ischemia[J].Neurochem Int,2016,97:154-171.
[17]De Santi L,Annunziata P,Sessa E,et al.Brain-derived neurotrophic factor and TrkB receptor in experimental autoimmune encephalomyelitis and multiple sclerosis[J].J Neurol Sci,2009,287(1-2):17-26.
[18]Lee DH,Geyer E,Flach AC,et al.Central nervous system rather than immune cell-derived BDNF mediates axonal protective effects early in autoimmune demyelination[J].Acta Neuropathol,2012,123(2):247-258.
[19]Makar,TK.,Trisler,D,Sura,KT.et al.Brain derived neurotrophic factor treatment reduces inflammation and apoptosis in experimental allergic encephalomyelitis[J].J Neurol Sci,2008,270(1-2):70-76.
[20]Graumann U,Reynolds R,Steck AJ.Molecular changes in normal appearing white matter in multiple sclerosis are characteristic of neuroprotective mechanisms against hypoxic insult[J].Brain Pathol,2003,13(4):554-573.
(2016-11-10收稿 責任編輯:楊覺雄)
EffectsofBushenyisuiFormulaandItsDecomposedFormulasonExpressionsofBDNF/TrkBinBrainandSpinalCordofMicewithExperimentalAutoimmuneEncephalomyelitis
Shi Yimin1,Wang Yongqiang1,An Chen1,Zhao Hui1,Li Junling1,Qi Fang1,Zhang Qiuxia1, Chen Zhenzhen1,Fan Yongping2,Li Ming1,Wang Lei1
(1CapitalMedicalUniversity,Beijing100069,China; 2BeijingTiantanHospitalAffiliatedCapitalMedicalUniversity,Beijing100050,China)
Objective:To observe effects of Bushenyisui (BSYS) formula and its decomposed formulas,Bu Shen (BS) and Hua Tan Huo Xue (HTHX),on the expressions of brain-derived neurotrophic factor (BDNF) and TrkB in the brain and spinal cord of mice with experimental autoimmune encephalomyelitis (EAE).Methods:The EAE mice were injected subcutaneously with the myelin oligodendrocyte glycoprotein (MOG)35-55in the back on the 1st day and the 7th,and were injected intraperitoneally with pertussis toxin (PTX).All the mice were administered intragastrically with the different medicine or distilled water once a day.The brain and spinal cord of mice were removed for the examination on day 20th and 40th.The expressions of BDNF and TrkB mRNA and proteins were detected by real time fluorescent quantitative (qRT-PCR) and Western Blot analysis.Results:The expressions of BDNF and TrkB in the brain and spinal cord of EAE mice were significantly up-regulated by BSYS and its decomposed BS and HTHX,compared with the EAE mice (P<0.05).The effective trend of BSYS on the above indexes was better than that of the decomposed BS and HTHX formulas,but there was no statistical significance (P>0.05).Conclusion:The effect of BSYS and its decomposed formulas,BS and HTHX,on promoting axonal repair might be related to enhance the expression of BDNF/TrkB,and that of BSYS was more significant.
Bu Shen Yi Sui and its decomposed formulas; Multiple sclerosis; Experimental autoimmune encephalomyelitis; BDNF/TrkB
R228;R242
:Adoi:10.3969/j.issn.1673-7202.2017.09.041
國家自然基金項目(81273742,81573898);北京市教委重點項目(KZ201310025023);北京市屬高等學校高層次人才引進與培養計劃-長城學者項目(CIT&TCD20140329)
師一民(1990.06—),男,在讀碩士,首都醫科大學中醫藥學院,主要從事中醫藥防治腦病的基礎研究
李明(1963.11—),女,博士,教授,研究方向:方劑配伍規律及功效機制研究,E-mail:13611386113@163.com;王蕾(1967.10—),女,博士,教授,研究方向:中醫藥防治腦病的功效及機制研究,Tel:(010)83911626,E-mail:tmwangl@ccmu.edu.cn

