正交試驗設計篩選黃連總生物堿的提取純化工藝研究
熊玲,覃瑤,羅維早,3,肖坤全,王欣
(1.成都市食品藥品檢驗研究院,四川 成都 610045;2.太極集團有限公司,重慶 401147;3.重慶市中藥研究院,重慶 400065)
·中藥工業·
正交試驗設計篩選黃連總生物堿的提取純化工藝研究
熊玲1,覃瑤2,羅維早2,3,肖坤全2,王欣3*
(1.成都市食品藥品檢驗研究院,四川 成都 610045;2.太極集團有限公司,重慶 401147;3.重慶市中藥研究院,重慶 400065)
目的:篩選黃連總生物堿最佳提取工藝。方法:采用正交試驗設計,以小檗堿、巴馬汀、黃連堿、表小檗堿的轉移率為指標,篩選最佳的提取參數。在此基礎上綜合提取轉移率、能耗及成本因素對提取工藝進行優化。結果:以70%乙醇作為提取溶劑,提取3次,每次1 h,溶劑用量分別為8、6、6倍為最佳提取工藝。結論:所篩選的提取工藝能夠有效提取出黃連中的主要活性成分。
黃連;正交設計;生物堿;提取工藝
1 材料與儀器
1.1藥品與試劑
鹽酸巴馬汀對照品(批號:110732-200506)、鹽酸小檗堿對照品(批號:110713-200208)、鹽酸藥根堿對照品(批號:0733-200005)(中國食品藥品檢定研究院);HPLC試劑為色譜純;其余各試劑均使用分析純。
黃連藥材于2012年3月采集于重慶石柱當地,經瞿顯友研究員、舒抒副研究員鑒定為毛茛科植物黃連CoptischinensisFranch.的干燥根莖。
1.2儀器
LC-2010型液相色譜儀(島津);AUW220D型電子天平(十萬分之一,日本島津公司);BS224S型電子天平(萬分之一,德國賽多利斯公司);KQ250DB型數控超聲波清洗器 (鞏義市予華儀器有限責任公司);KQ5200型水浴鍋(昆山市超聲儀器有限公司);DHG-9140A電熱恒溫鼓風干燥箱(鞏義市予華儀器有限責任公司);Delta320pH計(Mettler-ToledoGroup);三用紫外線分析儀(上海顧村電光儀器廠);大孔樹脂D101(蚌埠市遼源新材料有限公司);DAISO反相C18硅膠填料(60μm,北京頗賽科技發展有限公司);預制硅膠板(青島譜科分離材料有限公司)。
2 實驗方法及結果
2.1樣品的制備
2.1.1對照品溶液的制備 精密稱取鹽酸藥根堿、鹽酸非洲防己堿、鹽酸表小檗堿、鹽酸黃連堿、鹽酸巴馬汀、鹽酸小檗堿6種對照品適量,置于50mL容量瓶中,甲醇定容至刻度,得到各對照品質量濃度分別為22.2、19.0、65.8、93.4、58.2、281.2μg·mL-1的混合對照品溶液。
2.1.2供試品溶液的制備 精密量取提取液1mL,加甲醇∶濃鹽酸(100∶1)稀釋至25mL,搖勻,離心(10000r·min-1),即得HPLC樣品。
2.1.3藥材樣品溶液的制備 取藥材粉末(過四號篩)約0.1g,精密稱定,置具塞錐形瓶中,精密加入甲醇-濃鹽酸(100∶1)的混合液50mL,密塞,稱定重量,超聲處理(功率:250W,頻率:40kHz)30min,放冷,再稱定重量,用甲醇補足減失的重量,搖勻,離心(10000r·min-1),即得。
2.2色譜條件
WelchMaterialsXtimateTMC18色譜柱(250mm×4.6mm,5μm);流動相A為乙腈,B為30mmol·L-1碳酸氫銨溶液(每1000mL碳酸氫銨溶液含7mL氨水及1mL三乙胺),梯度洗脫條件:0~15minA∶B為(10~25)∶(90~75),15~25minA∶B為(25~30)∶(75~70),25~40minA∶B為(30~45)∶(70~55)。流速為1mL·min-1;檢測波長為270nm;柱溫為30℃;進樣量10μL。理論塔板數按鹽酸藥根堿、鹽酸非洲防己堿、鹽酸表小檗堿、鹽酸黃連堿、鹽酸巴馬汀、鹽酸小檗堿峰計算均不低于5000。
2.3回流提取正交試驗
以黃連中6個生物堿(小檗堿、巴馬汀、黃連堿、表小檗堿、非洲防己堿、藥根堿)的轉移率為考察指標,取黃連藥材粗粉進行正交試驗。主要因素為溶媒用量(A)、提取時間(B)、乙醇濃度(C)、提取次數(D),根據黃連中生物堿類成分的提取有關文獻[1-4],選擇L9(34)正交表進行試驗。
取黃連藥材粗粉9份,每份150g,分別進行回流提取,收集提取液,按2.1樣品的制備配制HPLC樣品,按2.2色譜條件測定樣品,計算轉移率。

表1 因素水平表
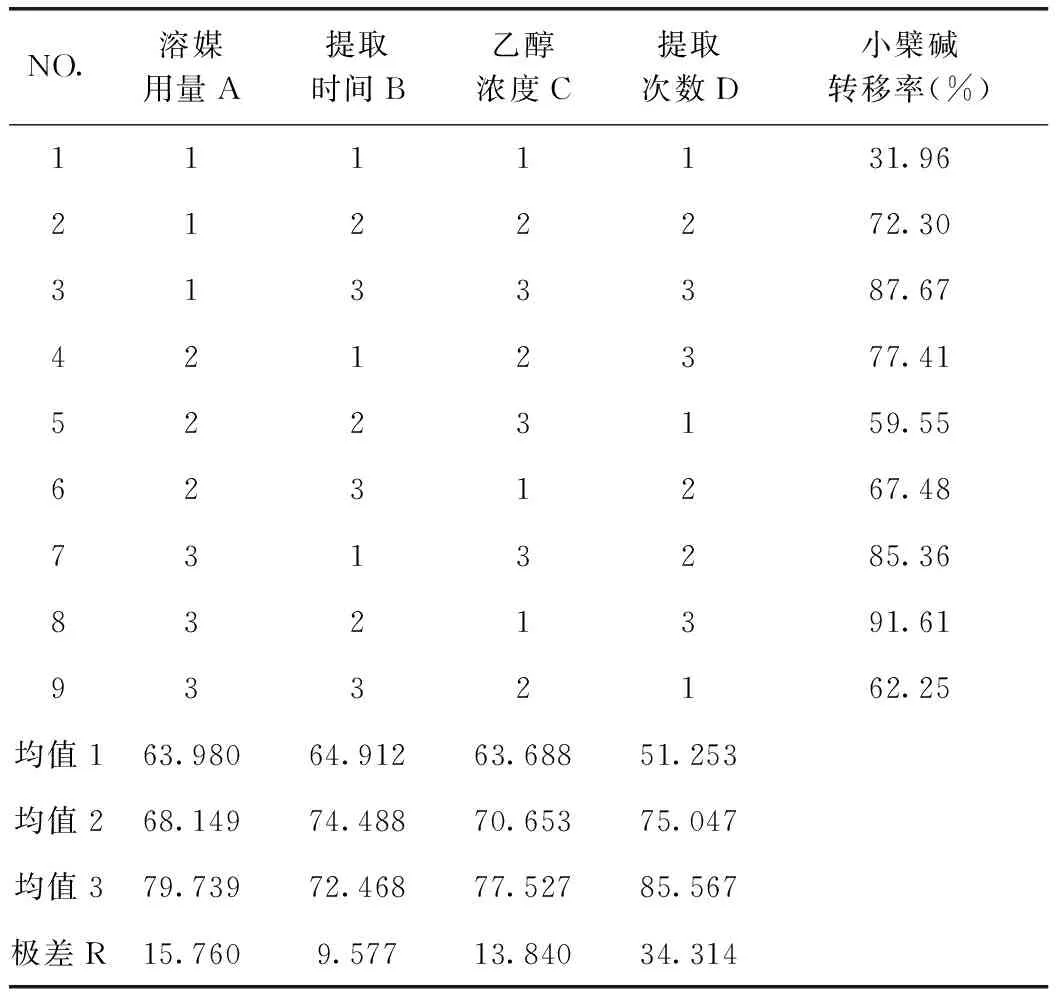
表2 小檗堿提取轉移率正交試驗結果
由表3可知,D因素的F比>F0.05,D因素對該指標的影響有顯著性意義,且非常重要;由小檗堿轉移率正交試驗結果表直觀分析R可知,其影響因素大小依次為D>A>C>B。由直觀分析可以看出,最佳提取工藝為A3B2C3D3,即用8倍量75%的乙醇提取3次,每次1 h。
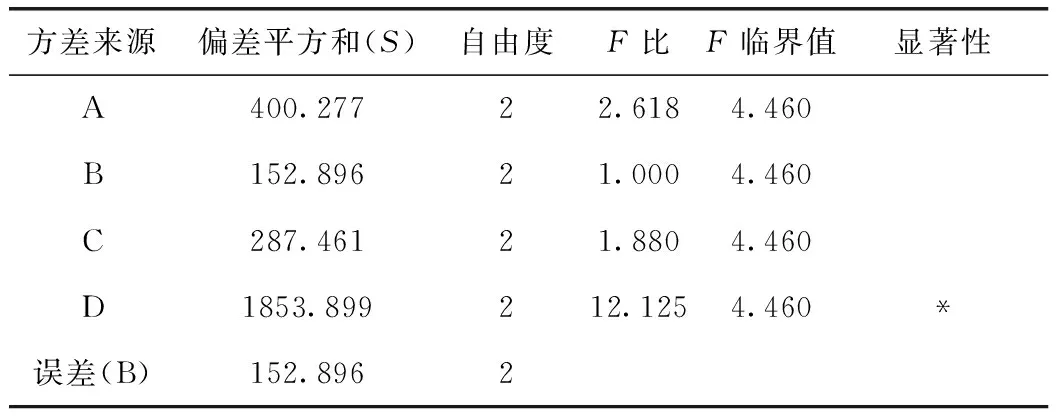
表3 方差分析表(小檗堿)
注:以B因素的偏差平方和為誤差。
由表5可知,D因素的F比>F0.05,D因素對該指標的影響有顯著性意義,且非常重要;由巴馬汀轉移率正交試驗結果表直觀分析R可知,其影響因素大小依次為D>A>C>B。由直觀分析可以看出,最佳提取工藝為A3B2C3D3,即用8倍量75%的乙醇提取3次,每次1 h。
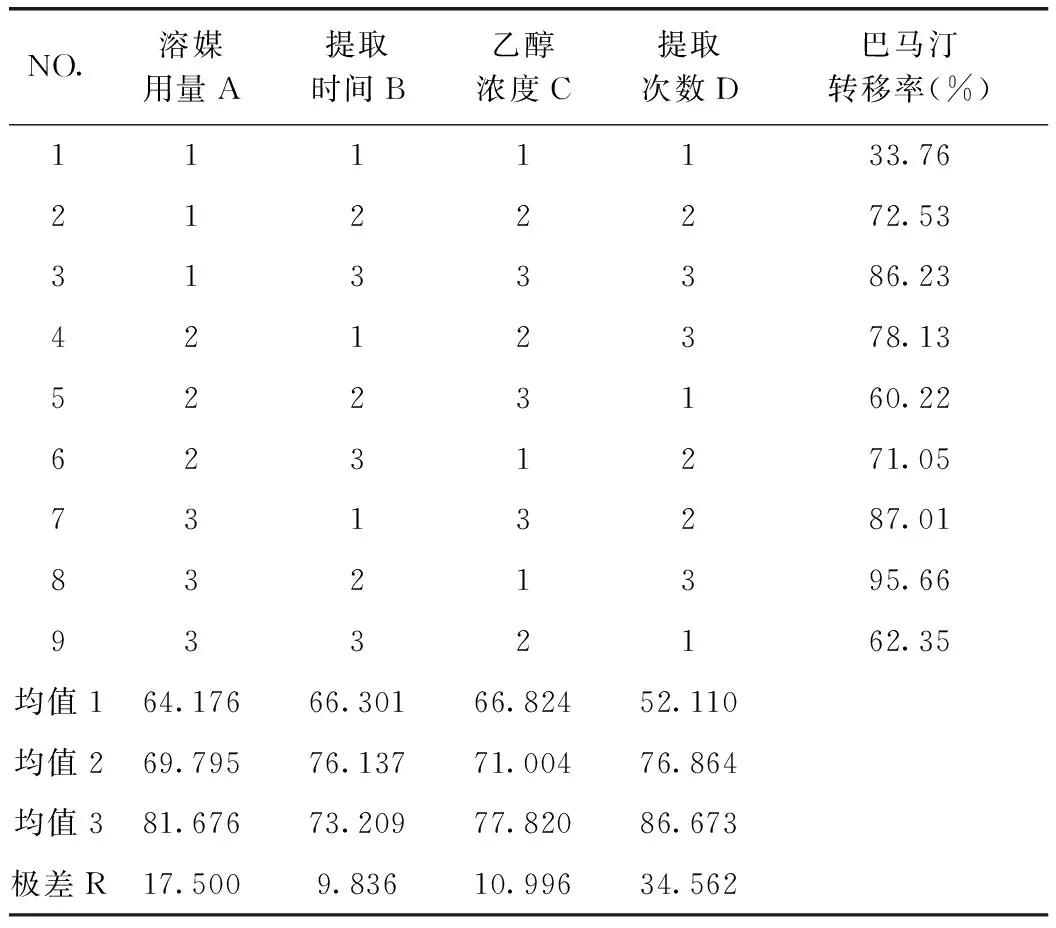
表4 巴馬汀提取轉移率正交試驗結果
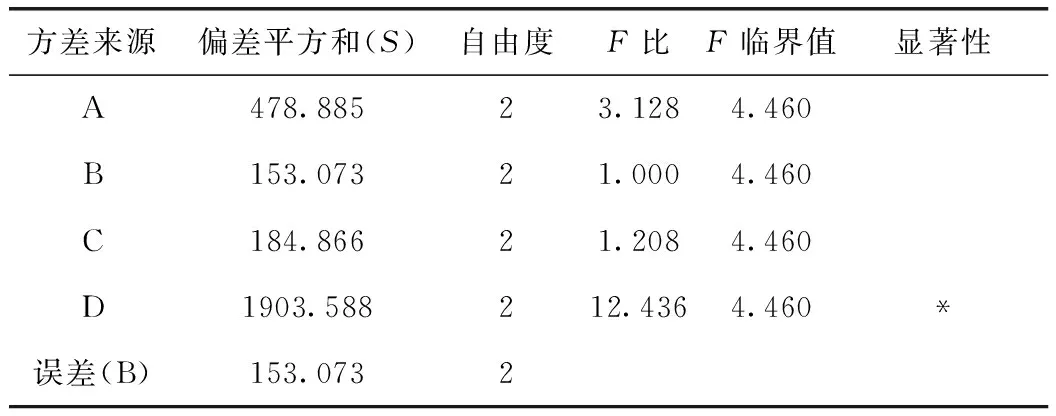
表5 方差分析表(巴馬汀)
注:以B因素的偏差平方和為誤差。
由表7可知,D因素的F比>F0.05,D因素對該指標的影響有顯著性意義,且非常重要;由黃連堿轉移率正交試驗結果表直觀分析R可知,其影響
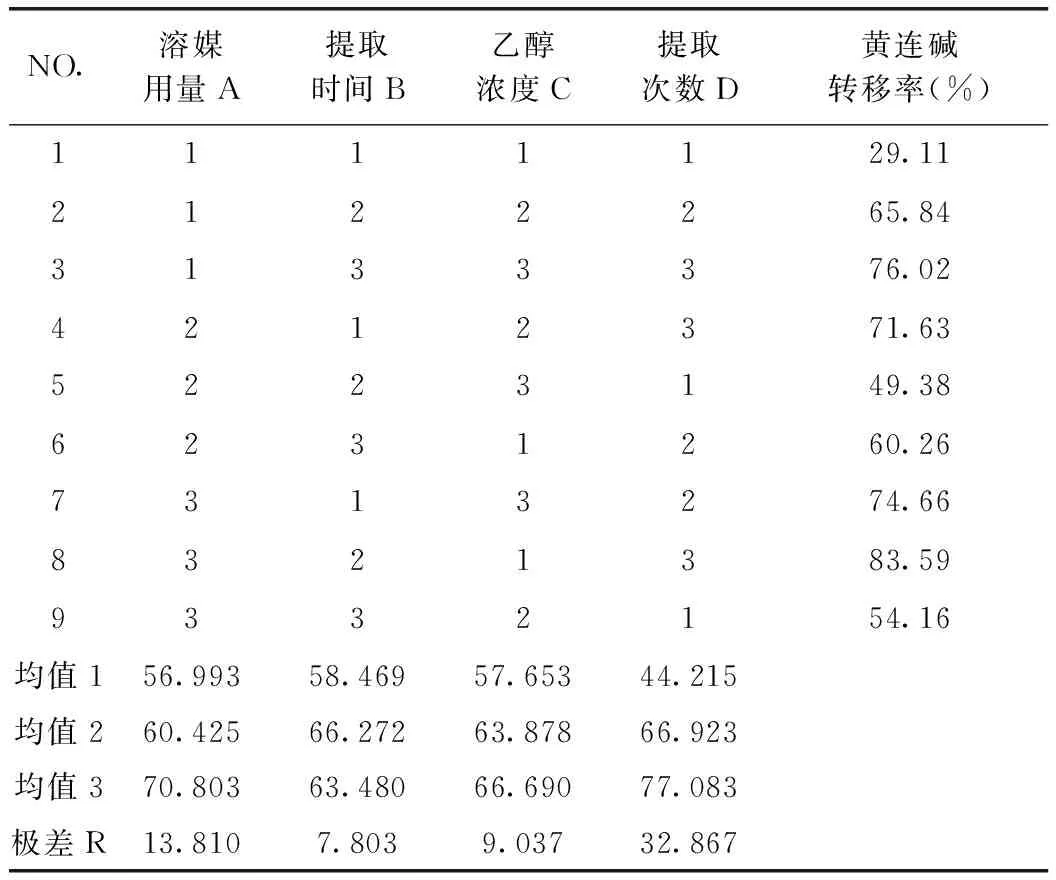
表6 黃連堿提取轉移率正交試驗結果
因素大小依次為D>A>C>B。由直觀分析可以看出,最佳提取工藝為A3B2C3D3,即用8倍量75%的乙醇提取3次,每次1 h。
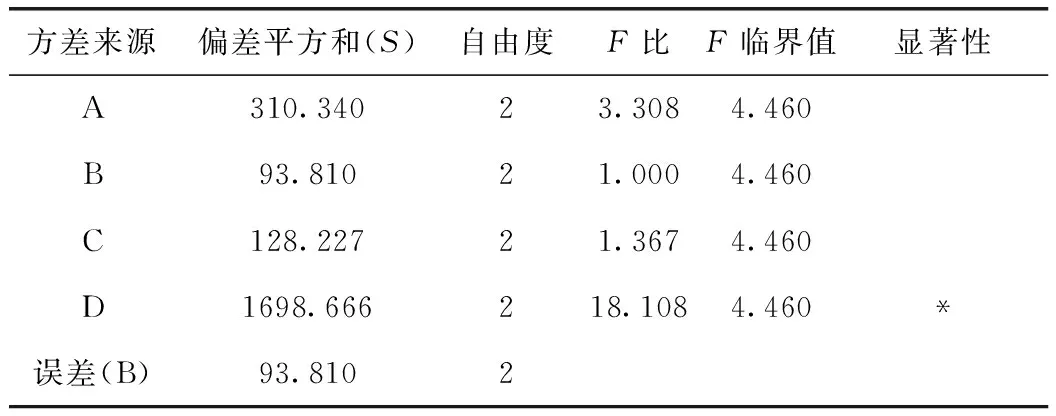
表7 方差分析表(黃連堿)
注:以B因素的偏差平方和為誤差。
由表9可知,D因素的F比>F0.05,D因素對該指標的影響有顯著性意義,且非常重要;由小檗堿轉移率正交試驗結果表直觀分析R可知,其影響因素大小依次為D>A>C>B。由直觀分析可以看出,最佳提取工藝為A3B2C3D3,即用8倍量75%的乙醇提取3次,每次1 h。
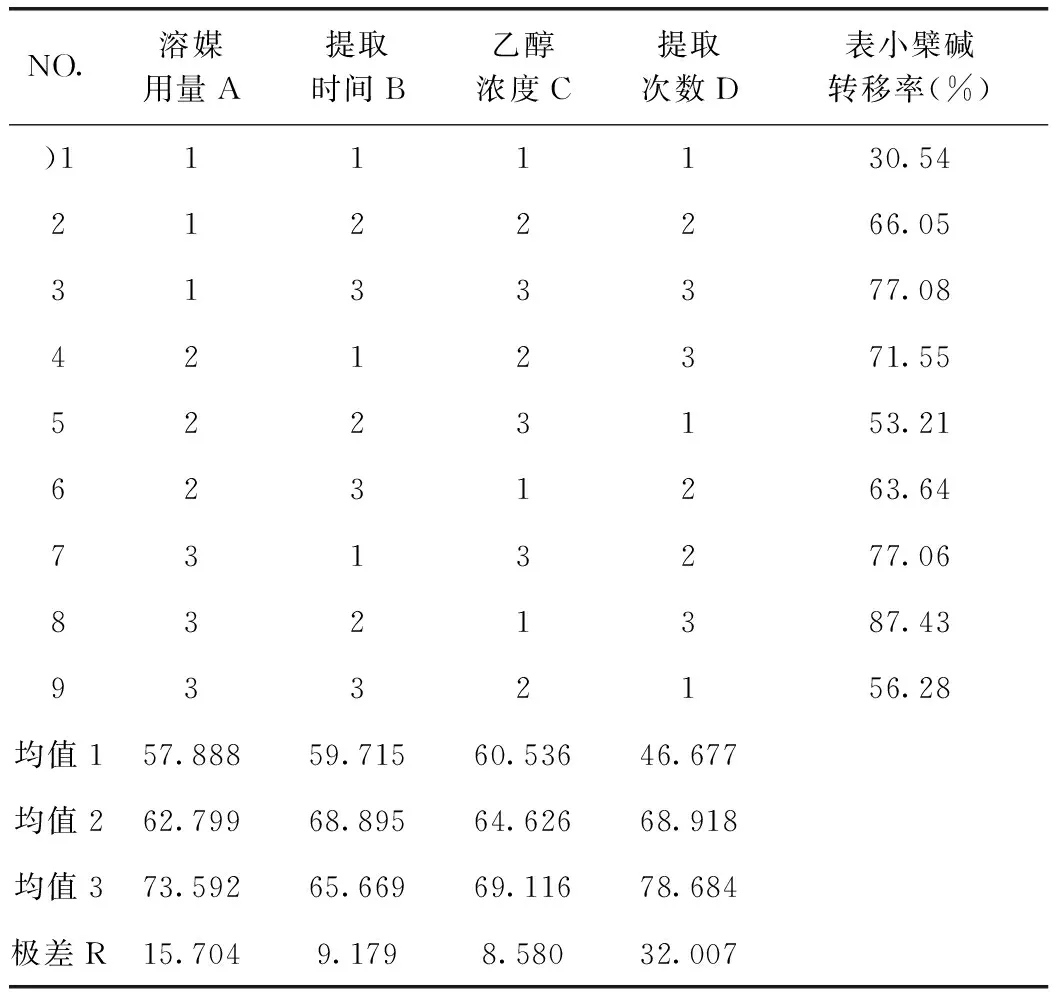
表8 表小檗堿提取轉移率正交試驗結果
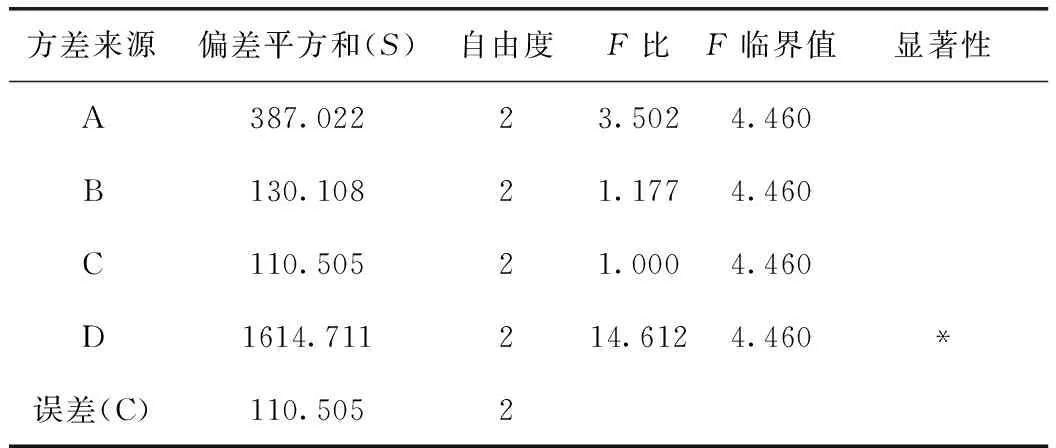
表9 方差分析表(小檗堿)
注:以C因素的偏差平方和為誤差。
由表11可知,D因素的F比>F0.05,D因素對該指標的影響有顯著性意義,且非常重要;由非洲防己堿轉移率正交試驗結果表直觀分析R可知,其影響因素大小依次為D>A>C>B。由直觀分析可以看出,最佳提取工藝為A3B2C3D3,即用8倍量75%的乙醇提取3次,每次1 h。
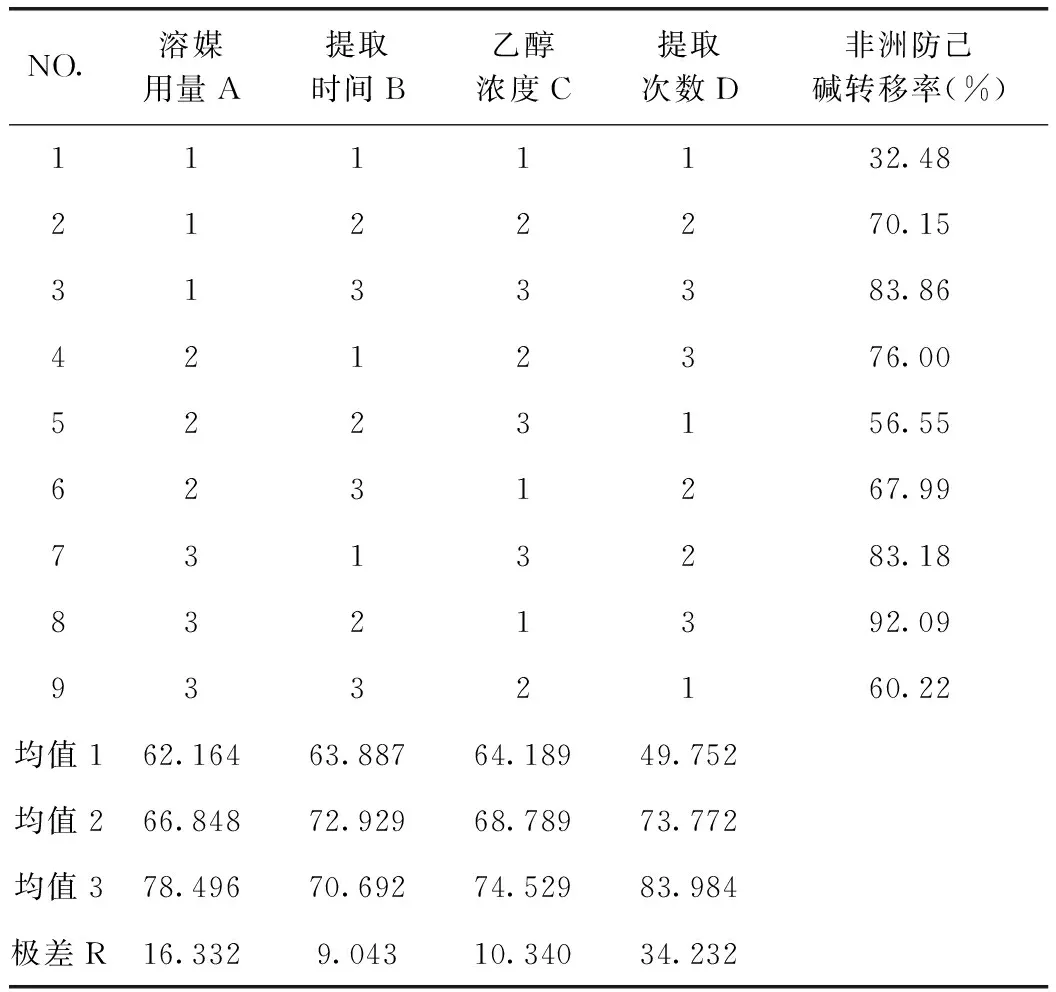
表10 非洲防己堿提取轉移率正交試驗結果
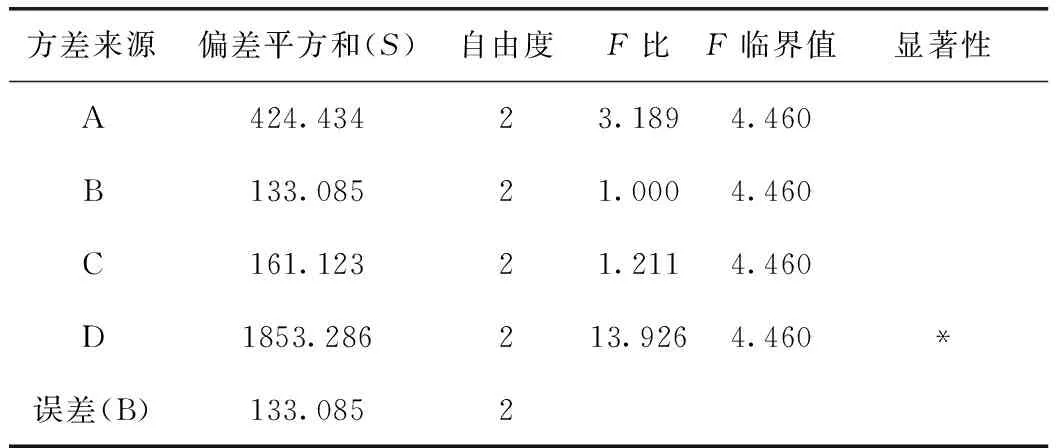
表11 方差分析表(非洲防己堿)
注:以B因素的偏差平方和為誤差。
由表13可知,D因素的F>F0.05,D因素對該指標的影響有顯著性意義,且非常重要;由藥根堿轉移率正交試驗結果表直觀分析R可知,其影響因素大小依次為D>A>C>B。由直觀分析可以看出,最佳提取工藝為A3B2C3D3,即用8倍量75%的乙醇提取3次,每次1 h。
回流提取正交試驗結果可知,回流提取黃連中6個生物堿(小檗堿、巴馬汀、黃連堿、表小檗堿、非洲防己堿、藥根堿)最佳提取工藝都為A3B2C3D3,即用8倍量75%的乙醇提取3次,每次1 h。
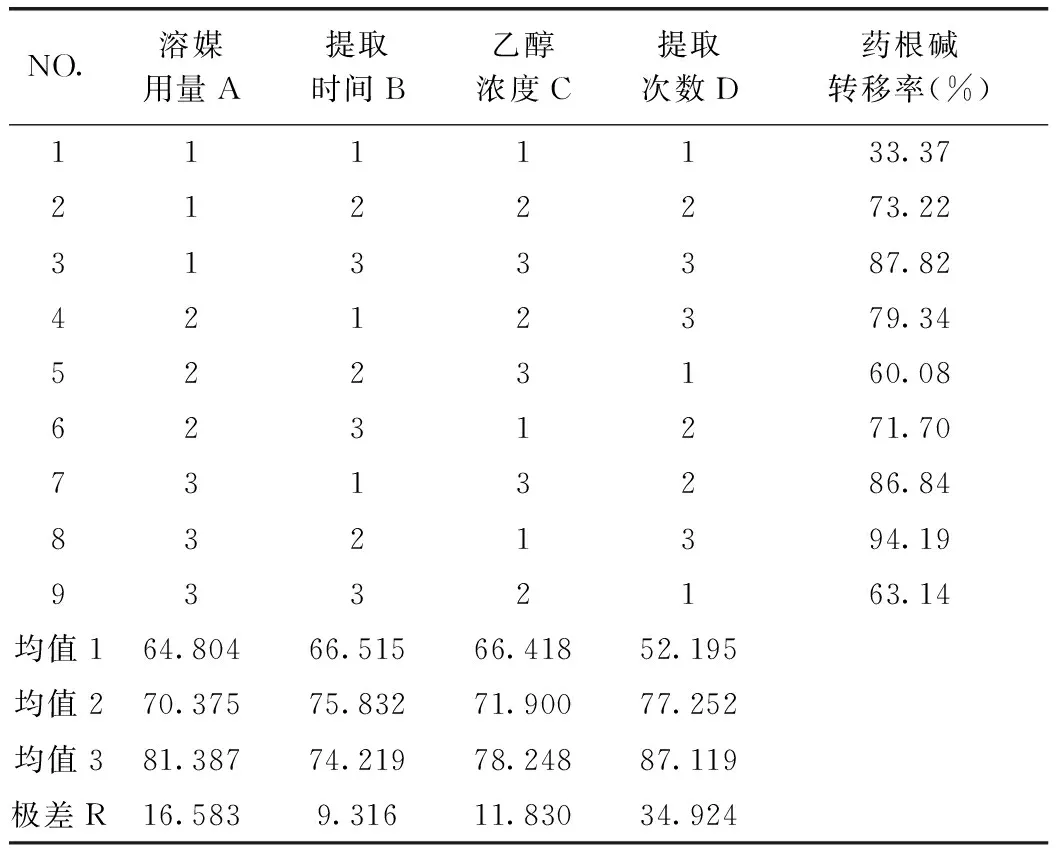
表12 藥根堿提取轉移率正交試驗結果
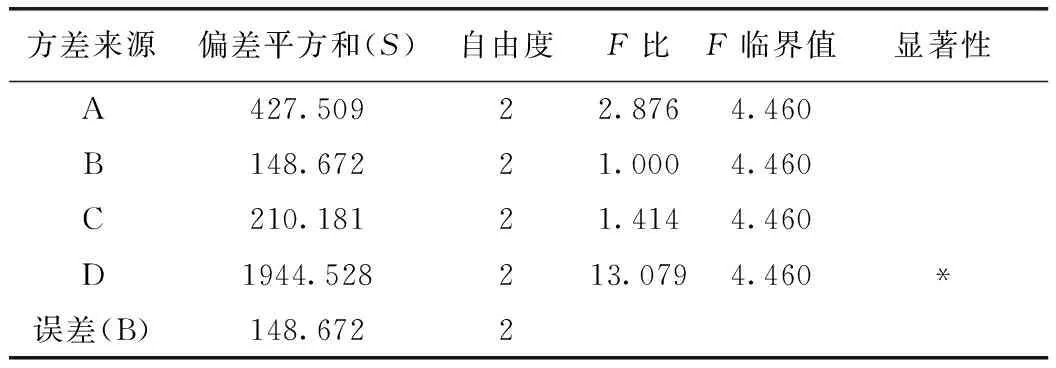
表13 方差分析表(藥根堿)
注:以B因素的偏差平方和為誤差。
2.4優化實驗
根據上述實驗結果,從大生產時節約能耗,減少成本的角度出發,以黃連中6個生物堿(小檗堿、巴馬汀、黃連堿、表小檗堿、非洲防己堿、藥根堿)的轉移率為考察指標,分別稱取黃連藥材粗粉150g,共9份,分成3組;每組分別用70%、75%、80%乙醇加熱回流提取3次,每次溶劑用量為8、6、6倍,即1200、900、900mL,每次回流1h,合并3次的提取液,按2.1樣品的制備配制HPLC樣品,按2.2色譜條件測定樣品,計算轉移率。
從表14可知,70%乙醇為提取溶劑,各生物堿轉移率最高。
2.5驗證實驗
根據上述實驗結果,分別稱取黃連藥材粗粉500g,共3份,加入70%乙醇,各提取3次,每次1h,溶劑用量分別為8、6、6倍,即4000、3000、3000mL,合并3次的提取液,按2.1方法配制HPLC樣品,按2.2色譜條件測定樣品,計算轉移率,結果見表15。
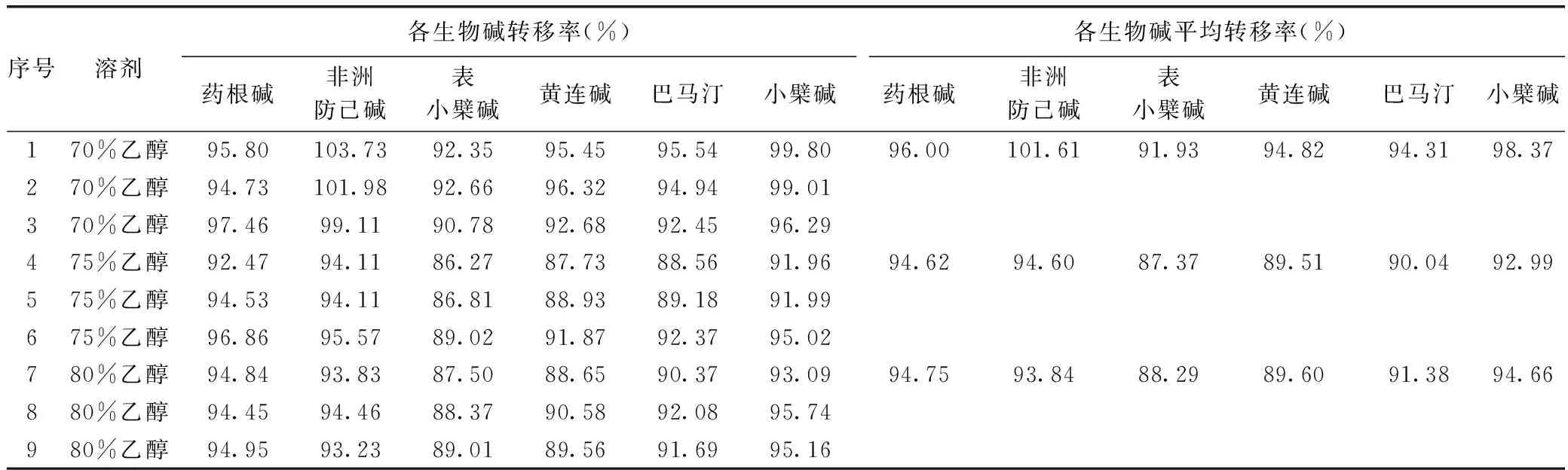
表14 回流提取轉移率一覽表
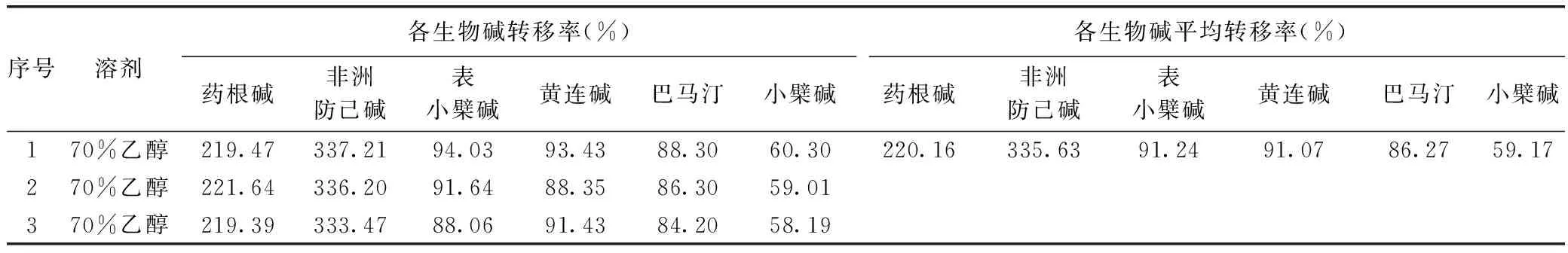
表15 回流提取轉移率一覽表
3 討論
黃連始載于《神農本草經》,列為上品。《本草綱目》中記載:“其根連珠而色黃,故名。”自古以來認為四川為主產地。有瀉火、燥濕、解毒、殺蟲的功能。現代醫學研究成果表明,黃連抗菌、抗炎、鎮痛、降糖等活性均與黃連中多種生物堿密切相關,黃連藥材的主要活性成分為其中的生物堿,包括小檗堿、黃連堿、巴馬汀、表小檗堿等。2010版《中華人民共和國藥典》一部對黃連制定了4種生物堿的含量限度;依據多成分含量測定符合中藥多成分的特點,更有利于中藥材質量控制的整體性和客觀性。但僅對藥材進行質量控制,并不能保證成藥的質量。成藥安全有效需依賴于合理的制備工藝及完善的質量控制[6]。現有的黃連提取工藝多采用小檗堿作為單一指標成分進行黃連提取工藝的篩選和研究[7-9],而黃連另含有其他多種生物堿,其含量同樣影響黃連及其提取物的質量,單一選擇一種生物堿作為指標成分進行黃連提取工藝的篩選不能體現中藥多成分多指標的特色,更不能保證成品的有效性和可控性,故本研究采用多成分作為指標對黃連的提取工藝進行篩選,為后續黃連成藥的制備提供依據。
正交試驗設計中,以多成分為指標篩選出的最佳提取工藝為8倍量75%的乙醇提取3次,每次1 h。結合能耗及實際生產成本的考慮,在此參數上進行了微調和驗證,確定最終的最佳提取工藝為以70%乙醇作為提取溶劑,提取3次,每次1 h,溶劑用量分別為8、6、6倍。
[1] 張紅梅,程雪梅,王長虹,等.黃連中生物堿提取工藝的正交試驗研究[J].中國醫藥工業雜志,2008,39(8):588-590.
[2] 劉圣,唐麗琴,陳禮明,等.正交試驗優選黃連中小檗堿提取工藝的研究[J].中國藥房,2004,15(1):18-20.
[3] 張樂佳,夏新華.黃連提取工藝的研究[J].中成藥,2001,23(6):398-400.
[4] 張福維,關崇新,高坤.鹽酸小檗堿提取實驗的改進[J].大學化學,2003,18(4):47.
[5] 崔學軍.黃連及其有效成分的藥理研究進展[J].中國藥師,2006,9(5):469-470
[6] 國家藥典委員會.中華人民共和國藥典:一部[S].北京:中國醫藥科學出版社,2005.
[7] 彭福,瞿顯友,鐘國躍,等.HPLC法測定黃連不同部位中6個生物堿[J].中草藥,2014,43(3):509-512.
[8] 陽勇,李鐵剛,朱晶晶,等.HPLC法測定黃連藥材及其炮制品中主要生物堿的含量[J].中成藥,2010,32(9):1540-1544.
[9] 耿志鵬,鄭海杰,張藝,等.RP-HPLC測定不同產地黃連中6種生物堿的含量[J].中國中藥雜志,2010,35 (19):2576-2580.
(2016-09-20)
StudyonExtractionandPurificationTechnologyofTotalAlkaloidsfromRhizomaCoptidisbyOrthogonalDesign
XIONG Ling1,QIN Yao2,LUO Weizao2,3,XIAO Kunquan2,WANG Xin3*
(1.ChengduCenterforFood&DrugControl,Sichuan,610045,P.R.China;2.TaijiGroup,Chongqing,401147,P.R.China;3.ChongqingInstituteofChineseMateriaMedica,Chongqing,400065,P.R.China)
Objective:To screen the optimal extraction technology of total alkaloids from Rhizome Coptidis.Methods:The extraction parameters were optimized by using orthogonal experiment design with the transfer rate of berberine,palmartin,coptisine,epiberberine as the index.Combining the comprehensive extraction rate,power consumption and cost factors,the extraction process was further optimized.Results:The optimal process was as follows:70% ethanol as solvent,extracting 3 times,each time 1 h,amount of solvent 8,6,6 times,respectively.Conclusion:The selected extraction technology can effectively extract the major active constituent of Rhizoma Coptidis.
Rhizoma Coptidis;orthogonal design;alkaloid;extraction process
] 王欣,副研究員,研究方向:中藥化學成分與藥效物質基礎研究;E-mail:wangxin-cq386@sina.com
10.13313/j.issn.1673-4890.2017.5.023
*[

