慢病毒載體介導HIF1α穩定表達A549細胞系構建*
鄒 斌,周學亮#,詹宇亮,陳紫晴,賴松青,吳 霞,劉季春△
(南昌大學第一附屬醫院:1.心胸外科;2.心血管內科,南昌 330006)
慢病毒載體介導HIF1α穩定表達A549細胞系構建*
鄒 斌1,周學亮1#,詹宇亮2,陳紫晴1,賴松青1,吳 霞1,劉季春1△
(南昌大學第一附屬醫院:1.心胸外科;2.心血管內科,南昌 330006)
目的 利用慢病毒載體系統構建穩定表達HIF1α的A549細胞系。方法 以NCBI人HIF1α基因編碼序列為模板,設計并合成引物,PCR法擴增HIF1α。酶切回收的HIF1α片段與制備的慢病毒載體HBLV-RFP-Puro重組反應。PCR和基因測序鑒定重組質粒。重組質粒和輔助質粒共轉染293T細胞。包裝好的病毒經過濾、濃縮后,利用稀釋計數法測定病毒滴度。制備好的慢病毒感染A549細胞,采用藥物篩選穩定轉染細胞系。熒光顯微鏡及Western blot檢測觀察轉染及篩選效果。結果 PCR擴增HIF1α片段經鑒定成功,重組質粒經PCR、基因測序鑒定構建成功。成功包裝獲得高滴度LV-HIF1α。LV-HIF1α感染A549細胞后經藥物篩選,熒光顯微鏡下細胞帶有紅色熒光,Western blot結果顯示LV-HIF1α組HIF1α的表達水平明顯高于對照組。結論 慢病毒載體介導HIF1α穩定表達的A549細胞系構建成功。
HIF1α;慢病毒載體;穩定表達;A549
肺癌是全球最常見的惡性腫瘤之一,其導致的死亡人數居各類惡性腫瘤之首[1]。在過去的研究中,盡管在腫瘤生物學、臨床研究等方面取得了不斷的進展,但肺癌的5年生存率僅提高了5%[2]。基于分子分型的個體化治療及靶向治療是肺癌治療的發展方向之一。因此,肺癌的生物學研究聚焦于尋找關鍵驅動基因或信號通路。由于腫瘤缺氧激活的缺氧反應信號通路對腫瘤生物學行為(血管生成、侵襲、轉移等)產生重要影響[3-4]。HIF1α是缺氧反應信號通路關鍵調控因子。臨床研究發現,肺癌組織HIF1α的表達與淋巴結轉移、分期、癌細胞分化等相關,腫瘤組織HIF1α陽性的肺癌患者5年生存率和總生存率明顯低于陰性患者,HIF1α可能是具有潛質的預后生物標志物[5]。本研究基于慢病毒載體系統構建HIF1α慢病毒表達載體(LV-HIF1α),篩選穩定表達HIF1α的A549細胞系,為深入探討HIF1α在肺癌中的生物學作用建立基礎。
1 材料與方法
1.1 材料 慢病毒包裝系統(HBLV-RFP-Puro、pSPAX2、pMD2G)購于漢恒生物科技有限公司;A549細胞、293T細胞購于ATCC。大腸桿菌菌株DH5α購于Invitrogen公司;限制性內切酶購于Fermentas公司;瓊脂糖凝膠回收試劑盒購于Axygen公司;一步式克隆試劑盒購于南京諾唯贊生物科技有限公司;質粒DNA大抽提取試劑盒購于Qiagen公司;LipofiterTM購于漢恒生物科技有限公司;嘌呤霉素(Puromycin)購于Sigma公司;mouse monoclonal to HIF1α Antibody購于Stan Cruz biotechnology公司;β-Actin Mouse Monoclonal Antibody 購于Cell signaling technology公司;HRP laaffinipure goat anti-Mouse IgG購于北京中杉金橋生物技術有限公司。PCR引物合成和目的基因測序由漢恒生物科技有限公司完成。
1.2 方法
1.2.1 重組慢病毒質粒pHBLV- HIF1α- RFP-Puro構建 根據NCBI人HIF1α基因編碼序列設計引物,正向序列:5′-GGA TCT ATT TCC GGT GAA TTC GCC ACC ATG GAG GGC GCC GGC GG-3′,反向序列:5′-GGA TCC GCG GCC GCT TCT AGA GTT AAC TTG ATC CAA AG-3′,下劃線序列為酶切位點。按試劑操作說明進行 PCR 擴增,50 μL反應體系,反應條件為:95℃,預變性5 min;94 ℃,20 s;55 ℃,20 s;72 ℃,2.5 min;25個循環;72 ℃,延伸10 min。1% 瓊脂糖凝膠電泳鑒定PCR產物。EcoRⅠ、XbaⅠ雙酶切后回收目的片段。載體HBLV-RFP-Puro經雙酶切后回收,處理好的目的片段和載體進行重組反應(37 ℃ 30 min),后轉化DH5α細胞,接種于含氨芐青霉素(100 μg/mL)的培養皿過夜,挑選單克隆菌落,搖菌后用菌液進行PCR鑒定,將陽性克隆菌液測序。軟件對測序的克隆序列和基因庫中的序列比對分析。
1.2.2 慢病毒包裝及滴度測定 Qiagen試劑盒大量抽提制備好的慢病毒重組質粒及其輔助包裝載體質粒,按LipofiterTM轉染試劑說明,將重組慢病毒質粒pHBLV-HIF1α-RFP-Puro和輔助包裝載體pSPAX2、pMD2G共轉染293T細胞,轉染后6 h更換為完全培養基,培養48 h和72 h后收集富含慢病毒顆粒的上清液,0.45 μm濾器過濾后離心濃縮病毒。稀釋計數法測定LV-HIF1α滴度。病毒做3倍梯度稀釋(連續6個稀釋度),準備6個1.5 mL EP管,第1管加入105 μL培養液及15 μL病毒原液,混勻后從第1個管吸取40 μL加入第2個管(含有80 μL培養液),依次類推。稀釋好的病毒液分別加入293T細胞,24 h后更換為含Puromycin(2.5 μg/mL)的培養液。因該慢病毒帶有Puromycin抗性,通過感染后活細胞數目來判定滴度。顯微鏡下活細胞在10%~30%的孔計算病毒滴度。滴度(TU/mL)=細胞數×百分比×1(MOI)×病毒稀釋倍數×103。
1.2.3 LV-HIF1α介導的A549穩定轉染細胞系篩選 將狀態良好的A549細胞接種于6孔板(5×105/孔),分為LV-HIF1α組和慢病毒空載組(LV-RFP-Puro)并做好標記。培養 24 h 后至融合度達70%~80%,估計細胞數目,更換含慢病毒的培養液1 mL(含5 μg/mL Polybrene),MOI取20,4 h補充另半量培養液1 mL(含5 μg/mL Polybrene),感染24 h后換完全培養基。利用該病毒攜帶有Puromycin抗性基因,采用藥物篩選法篩選穩定轉染細胞系。48 h后,更換含Puromycin(2 μg/mL)的完全培養液進行篩選。由于該病毒同時帶有RFP基因,成功轉染后的細胞將存活并表達紅色熒光蛋白,在熒光顯微鏡觀察到紅色熒光。每隔2~3天換液、傳代,反復篩選2周左右,未轉染的細胞逐漸被篩除,帶有紅色熒光的細胞即為穩定轉染的細胞。在此基礎上,Western blot方法檢測目的基因的表達,進一步驗證轉染、篩選是否成功。穩定表達目的基因的細胞系命名為A549-HIF1α,對照組命名為A549-RFP-Puro,待穩定轉染細胞生長穩定后凍存細胞以備后續實驗所需。
2 結 果
2.1 重組慢病毒質粒pHBLV-HIF1α-RFP-Puro成功構建 1%瓊脂糖凝膠電泳鑒定PCR擴增后的產物(圖1),大小與預期一致。擴增的目的基因片段及慢病毒載體經酶切回收,在適當的條件下重組反應,構建重組慢病毒質粒pHBLV-HIF1α-RFP-Puro。重組慢病毒質粒轉化DH5α細胞,挑選單克隆菌落PCR鑒定,1%瓊脂糖凝膠電泳可見與預計相符的特異性條帶(圖2),由于PCR鑒定用的是載體上的一段通用引物,故比理論大小大400 bp左右。挑選陽性克隆菌液測序,測序的克隆序列和NCBI 數據庫中基因序列比對分析,核苷酸序列完全一致。
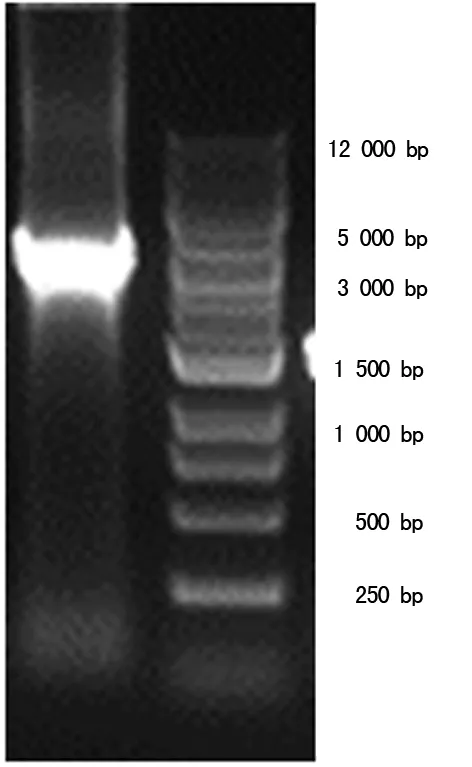
Lane1:HIF1α PCR產物;Lane2:DNA Marker
圖1 目的基因HIF1α PCR產物鑒定
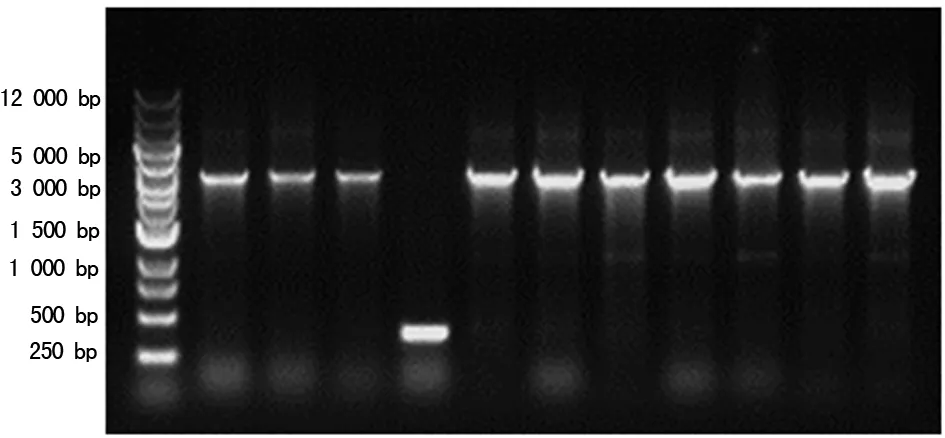
Lane1:DNA Marker;Lane2~12:單克隆PCR產物
圖2 pHBLV-HIF1α-RFP-Puro單克隆PCR產物鑒定
2.2 慢病毒包裝、滴度測定 采用三質粒系統(pHBLV-HIF1α-RFP-Puro、pSPAX2和pMD2G)共轉染293T細胞包裝病毒,高效轉染試劑盒提高轉錄效率。經過濾、濃縮后采用稀釋計數法測定滴度。病毒做3倍梯度稀釋,連續6個濃度,分別感染293T細胞,后加入Puromycin篩除未感染慢病毒的細胞,通過感染后活細胞數目來判定病毒滴度。如果某稀釋度中有10個活細胞,那么說明該稀釋度中至少含有10個病毒顆粒。顯微鏡下觀察加入不同量的慢病毒存活細胞數目(圖3)。LV-HIF1α組0.033 μL病毒孔細胞數目估計為4×104×10%左右,病毒稀釋了30倍。滴度(TU/mL)=細胞數×10%×1(MOI)×病毒稀釋倍數×103=1×108TU/mL。同樣方法計算對照組LV-RFP-Puro病毒滴度。
2.3 LV-HIF1α介導的A549穩定轉染細胞系成功構建 LV-HIF1α及LV-RFP-Puro分別感染A549細胞,利用載體同時帶有RFP報告基因及Puromycin抗性基因的特點,采用Puromycin進行反復篩選。熒光顯微鏡觀察,實驗組和對照組細胞均帶有紅色熒光(圖4),獲得目的基因穩定轉染細胞系A549-HIF1α和陽性對照穩定轉染細胞系A549-RFP-Puro。提取細胞總蛋白,Western blot檢測兩組細胞HIF1α的表達,結果顯示LV-HIF1α組HIF1α的表達明顯高于LV-RFP-Puro組(圖5),熒光顯微鏡及Western blot結果共同證實LV-HIF1α介導的A549細胞穩定轉染細胞系構建成功。

圖3 慢病毒載體滴度測定
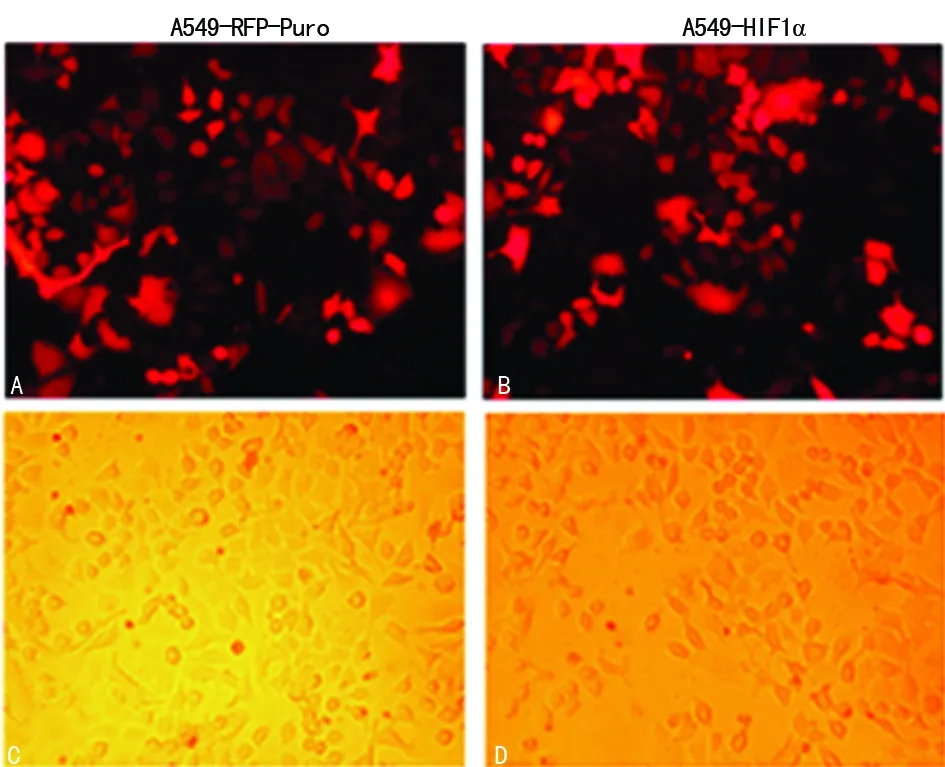
A、B:熒光顯微鏡下觀察到紅色熒光;C、D:普通觀察結果
圖4 熒光顯微鏡下觀察轉染及篩選效果
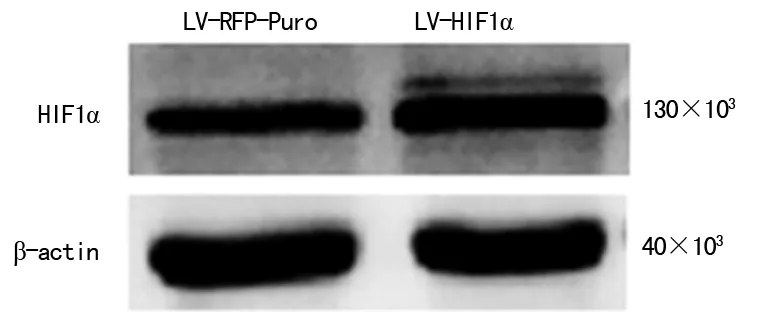
圖5 Western blot檢測HIF1α的表達
3 討 論
腫瘤細胞快速分裂、增殖而腫瘤內異常血管形成,這將導致腫瘤組織氧供需失衡。包括肺癌在內的許多實體腫瘤普遍存在缺氧的現象[6-8]。缺氧的腫瘤細胞將主要通過HIFs激活一系列的轉錄程序,如血管內皮生長因子、糖酵解酶、轉化生長因子等,改變代謝,促進血管生成、侵襲、轉移,并且影響腫瘤細胞對放化療的敏感性[3]。臨床研究發現,HIF1α與肺癌患者臨床病理學和預后相關,HIF1α可能是具有潛質的預后生物標志物及治療靶點[5-9]。近來研究發現,缺氧和HIFs可誘導肺腺癌細胞獲得腫瘤干細胞特性[10-12]。然而,作為缺氧反應的關鍵調控因子,HIF1α在腫瘤干細胞中的作用及機制目前還不明了。因此本研究擬構建慢病毒載體介導HIF1α穩定表達的A549細胞系,為進一步研究HIF1α在肺癌干細胞中的作用及機制建立前期基礎。
體外細胞缺氧模型通常采用缺氧或缺氧模擬物如二氯化鈷來建立,雖然可以激活HIF1α信號通路,但其同時也激活了HIF2α,因此特異性較差。而且該缺氧細胞模型不適合用于體內腫瘤移植實驗。慢病毒介導的外源基因轉移具有高效、穩定、精準等特點,是目前細胞分子生物學研究常用的工具[13-14]。慢病毒可以將其攜帶的目的基因整合進宿主細胞基因組中,目的基因在細胞內長期穩定表達。慢病毒轉染系統是構建穩定過表達或干擾細胞系的主要方式[15]。本研究涉及體內腫瘤移植實驗,因此選擇慢病毒載體系統構建HIF1α過表達載體,進一步篩選其介導的HIF1α穩定表達的A549細胞系。
該病毒同時攜帶有Puromycin抗性基因和RFP基因,利用該特點,采用藥物篩選法篩選出穩定轉染細胞系。未成功轉染或非穩定表達的細胞對藥物敏感,經反復藥物篩選將逐漸篩除。成功轉染并穩定表達的細胞在熒光顯微鏡下可以觀察到紅色熒光。經反復篩選,本研究觀察到細胞形態無明顯變化,70%~80%的細胞可見紅色熒光,剩余細胞未見熒光或熒光較弱。這可能有以下2種情況:(1)本研究所選的篩選濃度可能非最佳篩選濃度,未成功轉染的細胞產生了耐藥;(2)成功轉染的細胞活力受到影響,Puromycin抗性基因和RFP基因表達較弱,但對該濃度的Puromycin抵抗。筆者已采用較低病毒濃度轉染細胞,以盡量減小病毒對細胞活力的影響。因此后續實驗前有必要對細胞活力進行檢測,通過熒光強度能間接反映目的基因的表達情況。Western blot結果顯示LV-HIF1α組HIF1α表達明顯高于LV-RFP-Puro組,進一步證實LV-HIF1α介導的A549穩定轉染細胞系構建成功。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Johnson DH,Schiller JH,Bunn PA.Recent clinical advances in lung cancer management[J].J Clin Oncol,2014,32(10):973-982.
[3]Wigerup C,Pühlman S,Bexell D.Therapeutic targeting of hypoxia and hypoxia-inducible factors in cancer[J].Pharmacol Ther,2016,164(2):152-169.
[4]Keith B,Simon MC.Hypoxia-inducible factors,stem cells,and cancer[J].Cell,2007,129(3):465-472.
[5]Yang SL,Ren QG,Wen L,et al.Clinicopathological and prognostic significance of hypoxia-inducible factor-1 alpha in lung cancer:a systematic review with meta-analysis[J].J Huazhong Univ Sci Technolog Med Sci,2016,36(3):321-327.
[6]Le QT,Chen E,Salim A,et al.An evaluation of tumor oxygenation and gene expression in patients with early stage non-small cell lung cancers[J].Clin Cancer Res,2006,12(5):1507-1514.
[7]TrinkausME,BlumR,RischinD,etal.Imaging of hypoxia with 18F-FAZA PET in patients with locally advanced non-small cell lung cancer treated with definitive chemoradiotherapy[J].J Med Imaging Radiat Oncol,2013,57(4):475-481.
[8]Osinsky S,Zavelevich M,Vaupel P.Tumor hypoxia and malignant progression[J].Exp Oncol,2009,31(2):80-86.
[9]Ren W,Mi D,Yang K,et al.The expression of hypoxia-inducible factor-1α and its clinical significance in lung cancer:a systematic review and meta-analysis[J].Swiss Med Wkly,2013,143(5):w13855.
[10]Mathieu J,Zhang Z,Zhou W,et al.HIF induces human embryonic stem cell markers in cancer cells[J].Cancer Res,2011,71(13):4640-4652.
[11]Murakami A,Takahashi F,Nurwidya F,et al.Hypoxia increases gefitinib-resistant lung cancer stem cells through the activation of insulin-like growth factor 1 receptor[J].PLoS One,2014,9(1):e86459.
[12]Zhao M,Zhang Y,Zhang H,et al.Hypoxia-induced cell stemness leads to drug resistance and poor prognosis in lung adenocarcinoma[J].Lung Cancer,2015,87(2):98-106.
[13]孟凡榮,陳琛,萬海粟,等.慢病毒載體及其研究進展[J].中國肺癌雜志,2014(12):870-876.
[14]張曼,孫秀萍,宋銘晶.慢病毒載體用于轉基因技術的研究進展[J/CD].中華臨床醫師雜志(電子版),2014,8(10):1949-1953.
[15]Khetawat D,Broder CC.A functional henipavirus envelope glycoprotein pseudotyped lentivirus assay system[J].Virol J,2010,7(1):312.
Establishment of A549 cell line with stable expression of HIF1α mediated by lentiviral vector*
ZouBin1,ZhouXueliang1#,ZhanYuliang2,ChenZiqing1,LaiSongqing1,WuXia1,LiuJichun1△
(1.DepartmentofCardiothoracicSurgery;2.DepartmentofCardiology,FirstAffiliatedHospital,NanchangUniversity,Nanchang,Jiangxi330006,China)
Objective To establish the A549 cell line with stable expression of HIF1α by using lentiviral vector system.Methods Primers were designed and synthesized with human HIF1α gene coding sequence by the National Center of Biotechnogical Information(NCBI) as the template.HIF1α was amplified by PCR.The HIF1α fragment recycled by enzyme digestion was recombined with prepared lentiviral vector HBLV-RFP-Puro.The recombinant plasmid was identified by PCR and gene sequencing.The recombinant plasmid and the auxiliary plasmid were co-transfect into 293T cell.After filtration and concentration of packaged virus,the viral titer was detected by using the dilution counting method.The prepared lentivirus was infected A549 cells.The drug screening was adopted to stabilize the transfected cell line.The transfection effect was detected and observed by fluorescence microscope and Western blotting.Results The HIF1α fragment amplified by PCR was successfully verified and the recombinant plasmid was successfully constructed by PCR and gene sequencing identification.High-titer LV-HIF1α was obtained by successful package.After LV-HIF1α infecting A549 cells,the cells showed the red fluorescence by fluorescence microscope.The expression level of HIF1α in the LV-HIF1α group was significant higher than that in the control group by Western blot.Conclusion The 549 cell line with HIF1α stable expression mediated by lentivirus is constructed successfully.
HIF1α;lentivirrus;stable expression;A549
國家自然科學基金資助項目(81260024)。 作者簡介:鄒斌(1980-),主治醫師,博士,主要從事肺癌綜合治療研究。#共同第一作者:周學亮(1980-),主治醫師,博士,主要從事肺癌綜合治療研究。△
E-mail:liujichun999@163.com。
??·基礎研究
10.3969/j.issn.1671-8348.2017.20.003
R734.2
A
1671-8348(2017)20-2744-03
2017-02-09
2017-04-14)

