急性期腦出血患者血清ICAM-1、MMP-9、TNF-α、IL-6水平和出血灶周圍水腫腦組織體積的相關性
張極星,張艷國,趙亮,黃麗娟,王占強
(1齊齊哈爾醫學院附屬三院,黑龍江齊齊哈爾161000;2滄州市人民醫院)
?
急性期腦出血患者血清ICAM-1、MMP-9、TNF-α、IL-6水平和出血灶周圍水腫腦組織體積的相關性
張極星1,張艷國1,趙亮1,黃麗娟1,王占強2
(1齊齊哈爾醫學院附屬三院,黑龍江齊齊哈爾161000;2滄州市人民醫院)
目的 觀察腦出血患者急性期(出血后14 d內)血清細胞間黏附分子1(ICAM-1)、基質金屬蛋白酶9(MMP-9)、血清腫瘤壞死因子α(TNF-α)、白細胞介素6(IL-6)水平及出血周圍水腫腦組織體積變化,并分析其相關性。方法 選擇109例腦出血患者,采用ELISA法檢測患者腦出血后第1、3、7、14天血清ICAM-1、MMP-9、TNF-α、IL-6,行頭顱CT檢查測算出血灶周圍水腫腦組織體積。采用Pearson積矩相關分析法分析患者腦出血后第1、3、7、14天血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平及出血灶周圍水腫腦組織體積的相關性。結果 本組患者腦出血后第3、7天血清ICAM-1、MMP-9水平均高于第1天(P均<0.05),且第7天血清ICAM-1、MMP-9水平高于第3天(P均<0.05);腦出血后第14天血清ICAM-1、MMP-9水平低于第1天(P均<0.05)。本組患者腦出血后第14天血清TNF-α、IL-6水平低于第1、3、7天時(P均<0.05)。患者腦出血后出血灶周圍水腫腦組織體積逐漸增大(P均<0.05)。患者腦出血后第1、3、7、14天血清ICAM-1水平與血清MMP-9水平呈正相關(P均<0.05);腦出血后第1、3、7天血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平及出血灶周圍水腫腦組織體積均呈正相關(P均<0.05);腦出血后第14天血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平呈正相關(P均<0.05)。結論 腦出血患者出血后第1、3、7天血清ICAM-1、MMP-9水平逐漸升高,出血灶周圍水腫腦組織體積逐漸增大。腦出血患者出血后第1、3、7天血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平及出血灶周圍水腫腦組織體積呈正相關;腦出血后第14天血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平呈正相關。
腦出血;腦水腫;細胞間黏附分子1;基質金屬蛋白酶9;腫瘤壞死因子α;白細胞介素6
腦出血后腦組織水腫是導致腦出血患者殘疾和死亡的重要原因[1]。腦出血后腦組織水腫發生的主要原因是出血周圍腦組織微血管通透性增加和炎癥反應。動物實驗發現,細胞間黏附分子1(ICAM-1)、基質金屬蛋白酶9(MMP-9)的表達與腦組織微血管通透性和炎癥反應程度有關[2~4],但尚未見人體的相關研究。本研究觀察了腦出血患者急性期(出血后14 d內)血清ICAM-1、MMP-9、腫瘤壞死因子α(TNF-α)、白細胞介素6(IL-6)水平及出血灶周圍水腫腦組織體積的變化,并分析上述指標的相關性。現報告如下。
1 資料與方法
1.1 臨床資料 收集2014年1月~2016年12月收治的109例腦出血患者。其中男67例、女42例;年齡28~69(58.9±6.2)歲;腦出血后入院時間0.8~9.5(3.8±0.5)h;合并高血壓29例,糖尿病8例。納入標準:①符合全國第四屆腦血管學術會議修訂的腦出血診斷標準[6];②經頭顱CT或者MRI檢查證實為腦出血;③首次出血且病程<24 h;④年齡18~70歲;⑤均行保守治療,治療方法相同,住院時間>14 d。排除標準:①心臟功能不全者;②肝、腎功能障礙者;③外傷所致的腦出血者;④血管畸形或腦動脈瘤破裂所致的腦出血者;⑤急、慢性炎癥性疾病者;⑥合并其他可能影響本研究結果的疾病的患者。本研究已獲得我院醫學倫理委員會的批準,研究對象或家屬均已簽署知情同意書。
1.2 血清ICAM-1、MMP-9、TNF-α、IL-6檢測 分別于患者腦出血后第1、3、7、14天清晨空腹抽取肘靜脈血4 mL,以3 000 r/min離心10 min后收集上清液,-20 ℃保存,留待檢測。采用ELISA法檢測血清ICAM-1、MMP-9、TNF-α、IL-6,嚴格按照試劑盒說明書操作。
1.3 出血灶周圍水腫腦組織體積測算方法 患者腦出血后第1、3、7、14天各行頭顱CT檢查1次,根據多田公式[7]計算血腫和出血灶周圍水腫腦組織體積。血腫體積(mL)=1/2×長徑×寬徑×層厚×層面數。出血灶周圍水腫腦組織體積(mL)=病灶體積-血腫體積。
2 結果
2.1 腦出血后不同時間患者血清ICAM-1、MMP-9、TNF-α、IL-6水平及出血灶周圍水腫腦組織體積變化 見表1。本組患者腦出血后第3、7天血清ICAM-1、MMP-9水平高于第1天(P均<0.05),且腦出血第7天血清ICAM-1、MMP-9水平高于第3天(P均<0.05);腦出血后第14天血清ICAM-1、MMP-9水平低于第1天(P均<0.05)。患者腦出血后第1、3、7天血清TNF-α、IL-6水平差異無統計學意義(P均>0.05);腦出血后第14天血清TNF-α、IL-6水平低于第1、3、7天(P均<0.05)。本組患者腦出血后出血灶周圍水腫腦組織體積逐漸增大(P均<0.05)。
表1 腦出血后不同時間患者血清ICAM-1、MMP-9、TNF-α、IL-6水平及出血灶周圍水腫腦組織體積比較
注:與第1天比較,aP<0.05;與第3天比較,bP<0.05;與第7天比較,cP<0.05。
2.2 腦出血后不同時間患者血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平及出血灶周圍水腫腦組織體積的相關性 詳見表2。患者腦出血后第1、3、7、14天,血清ICAM-1水平與血清MMP-9水平呈正相關(P<0.05);腦出血后第1、3、7天血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平及出血灶周圍水腫腦組織體積均呈正相關(P均<0.05);腦出血后第14天血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平呈正相關(P均<0.05),與出血灶周圍水腫腦組織體積無相關性(P均>0.05)。
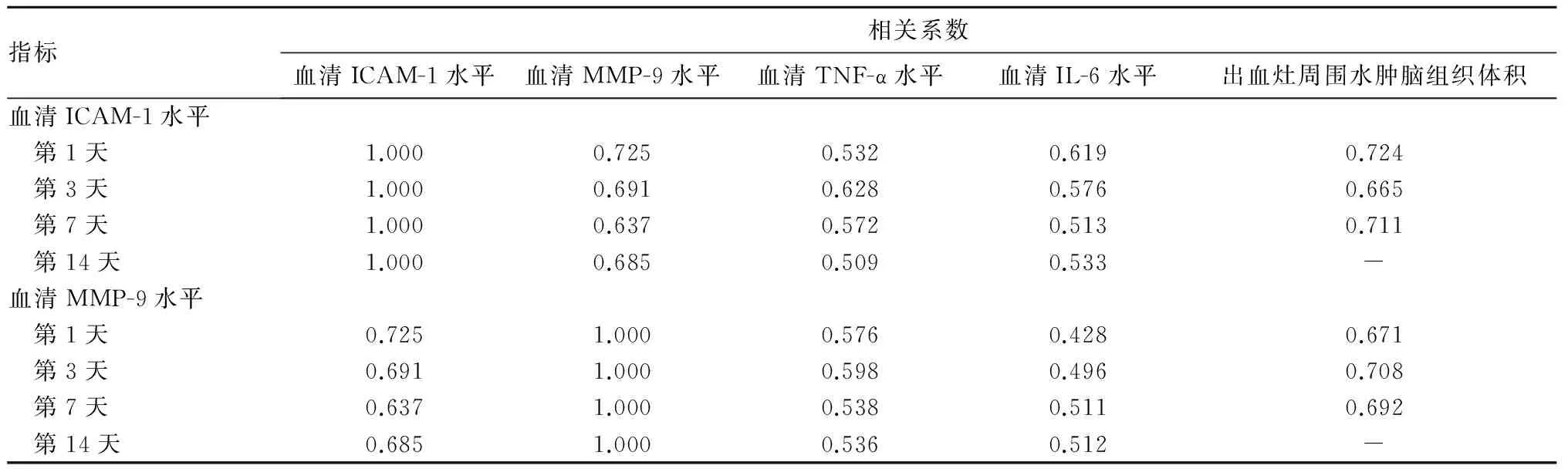
表2 腦出血后不同時間患者血清ICAM-1、MMP-9水平與血清TNF-α、IL-6水平及出血灶周圍水腫腦組織體積的相關系數
3 討論
腦出血后腦水腫是腦出血患者重要的繼發性腦損傷,也是最常見的病理生理改變,炎癥反應在其發生過程中有重要作用[8]。腦出血發生早期,血腫的占位性效應引起炎癥細胞的浸潤,激活黃嘌呤氧化酶系統而使大量的自由基釋放,損傷血管內皮細胞,最終引起細胞毒性腦水腫,并進一步增加血腦屏障的通透性而導致血管性腦水腫[9,10]。
ICAM-1是在中樞神經系統中廣泛表達的黏附分子,通過介導白細胞的黏附和活化而參與機體的炎癥反應。研究表明[11],ICAM-1在正常機體的血管內皮細胞中呈低表達,當組織出現缺血缺氧狀態或者炎癥反應時,ICAM-1表達水平升高。MMP-9可使細胞外基質中的多種成分降解。動物實驗結果顯示[12],在機體出現炎癥反應時,多種細胞因子在轉錄因子激活蛋白1(AP-1)、核轉錄因子κB(NF-κB)的介導下可使MMP-9表達上調,而MMP-9過度表達則可能使血腦屏障遭到破壞,引起血管源性腦水腫。
TNF-α具有廣泛的生物學功能,是由內皮細胞和單核巨噬細胞等所產生和分泌的多肽類細胞因子,參與了炎癥反應、免疫防御及凝血等過程。研究證實[13],TNF-α在腦出血后神經組織中的表達水平明顯上調,可作為腦出血后炎癥反應的重要標志物。IL-6主要是由淋巴細胞以及多種非淋巴細胞在外界因素的刺激下所產生的炎癥因子,在炎癥反應過程中發揮重要作用,不僅能促進急性期蛋白的合成和組織細胞的生長,還能刺激組織細胞的分化,研究[14]表明,腦出血患者血清中IL-6水平升高,可促進抗原大量產生、刺激免疫系統的免疫應答反應,激活炎癥細胞合成和分泌IL-6,是反映腦出血后炎癥反應的重要指標。
本研究結果顯示,腦出血患者腦出血后第1、3、7天,血清ICAM-1、MMP-9水平呈逐漸上升趨勢,第14天血清ICAM-1、MMP-9表達水平低于第1天。提示ICAM-1、MMP-9可能參與了腦出血的病理生理過程。其機制可能是腦出血后炎癥反應增強,炎癥細胞和炎癥因子通過血腦屏障進入到腦組織,刺激ICAM-1、MMP-9表達上調,造成繼發性的腦損傷。研究[15,16]發現,自發性腦出血患者血腫周圍的神經細胞有大量的ICAM-1、MMP-9表達,并且在第3天到達高峰且持續到第10天,與本研究結果變化趨勢相似。
本研究發現,腦出血后第1、3、7天,患者血清TNF-α、IL-6水平上升。腦出血使腦組織細胞損傷或者壞死,誘發大量的抗原刺激免疫系統產生強烈的免疫反應,激活淋巴細胞以及單核巨噬細胞等,最終產生TNF-α、IL-6等炎癥因子[17]。該結果同時說明TNF-α、IL-6可作為反映腦出血患者炎癥反應的重要標志物。本研究結果顯示,腦出血發生后出血灶周圍水腫腦組織體積逐漸增大。腦出血部位因為炎癥反應的刺激,浸潤在病灶組織中的單核細胞及中性粒細胞可產生大量的氧自由基,造成廣泛性腦組織損傷,使血腦屏障通透性增加,腦組織周圍水腫。
Pearson積矩相關分析結果顯示,本組患者出血后第1、3、7、14天,血清ICAM-1與MMP-9呈正相關,提示兩指標通過協同作用共同參與腦出血后腦組織的繼發性損傷。腦出血后第1、3、7、14天,血清ICAM-1、MMP-9與血清TNF-α、IL-6均呈正相關,提示血清ICAM-1、MMP-9也可作為間接反映腦出血患者炎癥反應狀態的重要指標。此外,本研究結果顯示,本組患者腦出血后第1、3、7天血清ICAM-1、MMP-9水平與出血灶周圍水腫腦組織體積呈正相關,提示ICAM-1、MMP-9均參與了腦出血后血腫周圍水腫的形成,可能是因為腦出血后ICAM-1、MMP-9被激活,使得血管基底膜降解而增加了血腦屏障的通透性,加重了血腫周圍水腫。這提示臨床工作者,檢測腦出血患者血清ICAM-1、MMP-9水平有助于評估患者腦水腫的嚴重程度并進行干預。
[1] Lattanzi S, Cagnetti C, Procinciali L, et al. How should we lower blood pressure after cerebral hemorrhage A systematic review and meta-analysis[J]. Cerebrovasc Dis, 2017,43(5-6):207-213.
[2] Hayman EG, Wessell A, Gerzanich V, et al. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2017,26(2):301-310.
[3] Colbers B, Herrmann S, Willfarth W, et al. Impact of hypothermia initiation and duration on perihemorrhagic edema evolution after intracerebral hemorrhage[J]. Stroke, 2016,47(9):2249-2255.
[4] Igarashi Y, Morishita Y, Yoshizawa H, et al. The association between soluble intercellular adhesion molecule-1 levels in drained dialysate and peritoneal injury in peritoneal dialysis[J]. Ren Fail, 2017,39(1):392-399.
[5] Siennicka A, Zuchowski M, Kaczmarczyk M, et al. Spatial differences of matrix metalloproteinase-2 and matrix metalloproteinase-9 within abdominal aortic aneurysm wall and intraluminal thrombus[J]. J Physiol Pharmacol, 2016,67(6):903-910.
[6] 中華神經科學會,中華神經外科學會.各類腦血管疾病診斷要點[J].中華神經科雜志,1996,29(6):379-380.
[7] 張秀玲,宋玉瓊,彭清臻.腦出血后遲發性水腫發生相關危險因素分析[J].實用心腦肺血管病雜志,2013,21(4):78-79.
[8] Urday S, Beslow LA, Dai F, et al. Rate of perihematomal edema expansion predicts outcome after intracerebral hemorrhage[J]. Crit Care Med, 2016,44(4):790-797.
[9] Zheng H, Chen C, Zhang J, et al. Mechanism and therapy of brain edema after intracerebral hemorrhage[J]. Cerebrovasc Dis, 2016,42(3-4):155-169.
[10] Murthy SB, Moradiya Y, Dawson J, et al. Perihematomal edema and functional outcomes in intracerebral hemorrhage:influence of hematoma volume and location[J]. Stroke, 2015,46(11):3088-3092.
[11] Rodriguez-Ruiz ME, Garasa S, Rodriguez I, et al. Intercellular adhesion molecule-1 and vascular cell adhesion molecule are induced by ionizing radiation on lymphatic endothelium[J]. Int J Radiat Oncol Biol Phys, 2017,97(2):389-400.
[12] Gao D, Ding F, Lei G, et al. Effects of focal mild hypothermia on thrombin-induced brain edema formation and the expression of protease activated receptor-1,matrix metalloproteinase-9 and aquaporin 4 in rats[J]. Mol Med Rep, 2015,11(4):3009-3014.
[13] Liang H, Guan D, Gao A, et al. Human amniotic epithelial stem cells inhibit microglia activation through down regulation of tumor necrosis factor-α,interleukin-1β and matrix metalloproteinase-12 in vitro and in a rat model of intracerebral hemorrhage[J]. Cytotherapy, 2014,16(4):523-534.
[14] Li X, Wang R, Wang X, et al. Relevance of IL-6 and MMP-9 to cerebral arteriovenous malformation and hemorrhage[J]. Mol Med Rep, 2013,7(4):1261-1266.
[15] 朱向陽,董政協,周永,等.老年腦出血患者血清基質金屬蛋白酶-9和細胞間黏附分子-1的測定及臨床意義[J].中華老年醫學雜志,2008,27(12):915-916.
[16] Yang JT, Lee TH, Lee IN, et al. Dexamethasone inhibits ICAM-1 and MMP-9 expression and reduces brain edema in intracerebral hemorrhagic rats[J]. Acta Neurochir(Wien), 2011,153(11):2197-2203.
[17] 蔣中鳳,許曉輝,王東生,等.腦出血患者血清MMP-9、IL-6、TNF-α變化及其與灶周水腫的關系[J].山東醫藥,2009,49(21):10-12.
黑龍江省衛生廳科技計劃項目(2014-874)。
張艷國(E-mail: yanguo203@163.com)
10.3969/j.issn.1002-266X.2017.27.017
R651.1
B
1002-266X(2017)27-0058-03
2017-03-19)

