急性腎損傷組織中細胞周期調控蛋白的表達變化及其意義
曹雷,鄭灼,李寧,趙訊,張穎軒
(哈勵遜國際和平醫院,河北衡水053000)
?
急性腎損傷組織中細胞周期調控蛋白的表達變化及其意義
曹雷,鄭灼,李寧,趙訊,張穎軒
(哈勵遜國際和平醫院,河北衡水053000)
目的 觀察細胞周期蛋白B1(Cyclin B1)、細胞周期蛋白依賴性蛋白激酶4(CDK4)、p21在不同原因所致急性腎損傷(AKI)組織中的表達變化,并探討其意義。方法 選擇行腎穿刺活檢術的患者納入研究,包括AKI患者108例和無器質性腎臟病變的腎功能異常的患者(對照組)39例。AKI患者中,腎毒性AKI 63例(腎毒性AKI組)、缺血性AKI 45例(缺血性AKI組)。取各組腎穿刺活檢標本,采用免疫組織法檢測Cyclin B1、CDK4、p21蛋白。結果 腎毒性AKI組、缺血性AKI組的腎小管細胞和腎間質中p21、Cyclin B1、CDK4蛋白表達積分均高于對照組(P均<0.05)。腎毒性AKI組及缺血性AKI組腎組織中Cyclin B1、CDK4、p21蛋白表達積分相比,P均>0.05。結論 AKI組織中p21、Cyclin B1、CDK4蛋白表達上調,在腎毒性AKI和缺血性AKI中三種細胞周期調控蛋白表達變化的趨勢一致;細胞周期調控蛋白的表達與AKI病因無關。
急性腎損傷;細胞周期調控蛋白;細胞周期蛋白B1;細胞周期蛋白依賴性蛋白激酶;細胞周期蛋白依賴性蛋白激酶抑制劑;p21蛋白
急性腎損傷(AKI)病情變化較快,是臨床常見的危急重癥[1,2]。AKI根據病因不同可分為缺血性AKI及腎毒性AKI兩種。缺血性AKI主要是由于腎臟灌注壓下降造成的,腎毒性AKI主要是由于化學物質引起的腎毒性作用。細胞周期正調控蛋白包括細胞周期蛋白(Cyclins)及細胞周期蛋白依賴性蛋白激酶(CDK)。p21蛋白為CDK抑制劑(CKI)家族中的一種,能夠廣譜抑制細胞周期正性調控蛋白的活性[3]。腎損傷等異常刺激作用使得有絲分裂原增加,細胞周期調控蛋白異常表達,調控能力受限,從而造成腎臟結構重塑及組織纖維化[4]。細胞周期調控蛋白表達異常與AKI引起的腎臟細胞增生、肥大及凋亡密切相關[5]。相關研究[6]表明,細胞周期適當的阻滯能夠有利于已經損傷細胞的修復。本研究觀察了Cyclin B1、CDK4、p21在缺血性和腎毒性AKI組織中的表達變化,并探討其臨床意義。
1 資料與方法
1.1 臨床資料 選擇在我院就診的需行腎穿刺活檢術的患者納入研究,患者既往無慢性腎功能不全病史,無孤立腎、小腎,無腎結核、腎周圍組織膿腫,無腎盂腎炎、腎盂積水或積膿,無腎腫瘤或腎動脈瘤,無多囊腎或腎臟大囊腫,無腎臟位置過高或游走腎,3個月內均未使用激素進行相關疾病的治療。共納入AKI患者108例和無器質性腎臟病變的腎功能異常患者(對照組)39例。AKI患者中,依據其病因、病史分為腎毒性AKI 63例(腎毒性AKI組)男31例、女32例,年齡(53.3±9.2)歲;缺血性AKI 45例(缺血性AKI組)男23例、女22例,年齡(53.6±6.7)歲。對照組39例,男19例、女20例,年齡(54.1±3.5)歲。三組患者性別比例、年齡資料差異無統計學意義。
1.2 腎組織中Cyclin B1、p21、CDK4蛋白檢測 采用免疫組化法。取各組腎穿刺活檢標本置于4 ℃、4%多聚甲醛溶液中固定2 h,常規乙醇梯度脫色,二甲苯透明、浸蠟、包埋。將常規石蠟連續切片(3 μm)烘干(60 ℃)8 h,浸入二甲苯Ⅱ、Ⅰ液中各10 min后經梯度濃度乙醇水洗各3 min,使石蠟切片脫蠟至水。3% H2O2封閉內源性過氧化物酶15 min,蒸餾水中止3 min,PBS液浸泡5 min。微波修復抗原15 min,充分暴露抗原決定簇后自然冷卻。消除非特異性背景染色。滴加一抗,4 ℃冰箱過夜,PBS液沖洗3次、每次5 min。滴加生物素標記的二抗,37 ℃,30 min,PBS液沖洗3次、每次5 min。二氨基聯苯胺(DAB)顯色5~10 min,自來水充分沖洗以中止顯色反應。蘇木素襯染3 min,水洗,1%鹽酸及99%乙醇分化20 s,充分水洗后梯度乙醇脫水,二甲苯透明后中性樹膠封片。用對照組腎組織標本做陰性對照。根據染色程度和陽性細胞百分比判定免疫組化結果:細胞染色以胞核、胞質或胞膜呈黃色為陽性,否則為陰性;根據染色程度為無著色、淡黃色、棕黃色、棕褐色分別計0、1、2、3分;隨機選擇10個不重疊視野(400倍光鏡下),每個視野各計數100個細胞,陽性細胞百分比為0計0分、≤10%計l分、>10%~50%計2分、>50%~75%計3分、>75%~100%計4分;上述兩項得分相加,0分以上判定為蛋白表達陽性。
1.3 統計學方法 采用SPSS17.0對數據進行統計分析。蛋白表達積分以中位數和百分位數(25%,75%)表示,等級資料組間比較用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
對照組腎組織中未見p21表達,但AKI組中可見p21染色呈棕黃色及棕褐色,其陽性細胞主要見于腎間質、腎小球系膜細胞、毛細血管內皮細胞胞核及新月體內,陽性細胞數占75%~90%。對照組腎小球及腎間質內Cyclin B1蛋白陽性染色呈棕褐色;AKI組腎小管上皮細胞、腎小球系膜細胞及腎間質中可見Cyclin B1染色深度減弱。各組腎組織中CDK4表達與Cyclin B1表達情況相似,但對照組腎小球細胞中無CDK4陽性表達。腎毒性AKI組、缺血性AKI組的腎小管細胞和腎間質中p21、Cyclin B1、CDK4蛋白表達積分均高于對照組(P均<0.05)。腎毒性AKI組及缺血性AKI組腎組織中Cyclin B1、CDK4、p21蛋白表達積分相比,P均>0.05。
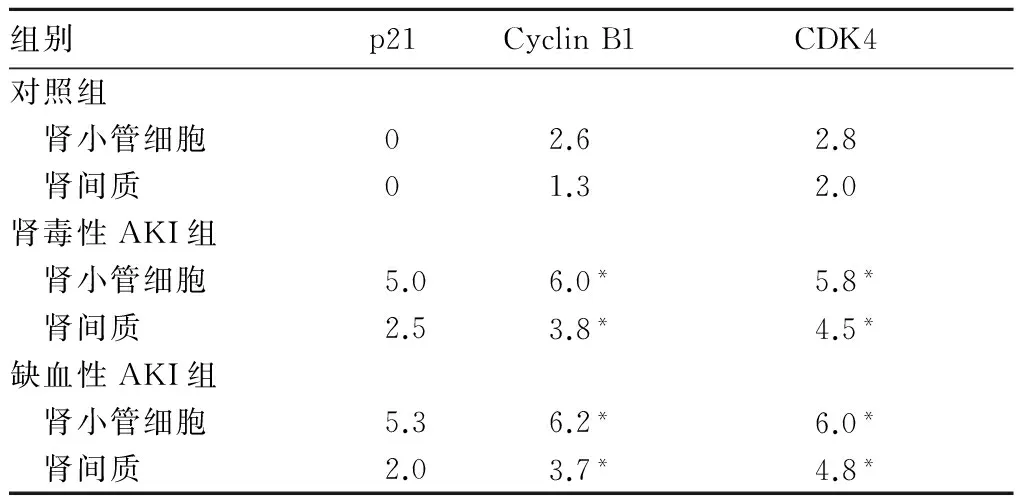
表1 各組腎小管細胞及腎間質中p21、Cyclin B1、CDK4蛋白表達積分比較(分)
注:與對照組相比,*P<0.05。
3 討論
AKI是慢性腎功能不全的常見病因[7,8],以往對AKI的診斷金標準是SCr值升高,但SCr水平與患者的年齡、性別及機體代謝狀況等有關,其數值變化與AKI引起GFR的變化相比具有延遲性。腎組織細胞凋亡及腎小管上皮細胞急性壞死是腎毒性AKI及缺血性AKI的細胞學基礎和主要病理改變[9]。腎小管上皮細胞是急性腎損傷的主要靶細胞,其增殖異常直接導致腎纖維化的發生與發展。研究[10]表明腎小管上皮細胞的再生和重建有利于受損腎臟組織修復。腎臟固有細胞為暫時休止細胞,病理因素或損傷因素產生的有絲分裂原使其活化進入新的細胞周期[11],而細胞周期調節蛋白在腎小管上皮細胞增殖、分化及凋亡中起著不可替代的作用。一個完整的細胞周期包括G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)和M期(有絲分裂期)。細胞周期的每一時象均有其特異性的正負性調控蛋白。了解細胞周期調控蛋白在AKI發病中的作用機制有重要的臨床意義。
Cyclin B1在S期開始形成,G2/M期時達到高峰,是重要的細胞周期正性調控因子之一。研究[16]表明Cyclin B1能激活CDK1參與細胞周期G2/M期轉換,Cyclin B1復合物又稱為成熟促進因子(MPF),能夠在無蛋白合成或被ede25e活化后促進真核細胞進行有絲分裂,其表達水平與AKI病變程度呈正相關。CDK是絲氨酸/蘇氨酸蛋白激酶中的一種,其復合物形式是調控細胞周期的中心環節。CDK4是CDK家族的重要組成成員之一,對細胞由G1期進入S期起重要作用。然而,在外界不良刺激的作用下,Cyclin D1與CDK4結合形成復合物,能夠激活CDK4并促使其下游的pRb蛋白磷酸化[13],通過E2F轉錄子的釋放及活化,啟動信號系統,使細胞周期跨越關卡點,縮短細胞周期,引起細胞周期調節失控和細胞異常增殖[14]。在系膜增生型大鼠腎炎模型中CDK活性明顯升高,且Cyclins免疫染色程度增強。本研究結果顯示,AKI腎組織中Cyclin B1、CDK4陽性表達較強,且其表達變化與急性腎損傷中腎組織細胞的細胞周期分布變化基本一致。
p21蛋白也稱野生型p53激活片段,是一種細胞周期負性調控因子,正常情況下野生型p53半衰期較短,免疫組化法通常檢測不出p21蛋白;但當p53發生基因突變、半衰期延長,p21蛋白可以被檢出。p21能夠與Cyclin B1-CDK1及Cyclin D1-CDK4復合物相黏附,與其特異性結合并使其失活,從而使細胞周期(G1期向S期轉化)被阻滯,促進細胞凋亡。有研究表明p21缺失的小鼠在注射順鉑后比野生鼠更迅速地出現急性腎衰竭癥狀,腎臟形態學損害更加嚴重。本研究中腎毒性AKI組、缺血性AKI組中均發現p21陽性表達水平顯著提高,較對照組的腎小管上皮細胞及腎間質中陽性表達明顯,推測p21陽性表達對腎損傷有一定的抑制作用,這可能與p21調節細胞增殖與凋亡平衡有關。
總之,雖然細胞周期調控蛋白的表達及其功能執行受多種因素影響及干擾,但在腎毒性AKI及缺血性AKI的病變發展中Cyclin B1、CDK4、p21蛋白的表達與其執行的功能相一致。深入研究細胞周期調控蛋白在AKI中的作用,有助于了解AKI的發病機制,在病變早期進行干預,控制病情進展。
[1] Rewa O, Bagshaw SM. Acute kidney injury-epidemiology, outcomes and economic[J]. Nat Rev Nephrol, 2014,10(4):193-207.
[2] 陳智.急性腎損傷致遠隔器官損傷[J].中華實用兒科臨床雜志,2015,30(5):323-324.
[3] 秦福芳,邵鳳民.細胞周期調控蛋白與腎臟疾病[J].醫藥論壇雜志,2011,32(23):205-206.
[4] 唐怡,張凌,付平.細胞凋亡與急性腎損傷[J].中國醫學前沿雜志(電子版),2014,6(9):5-8.
[5] Homsi E, Janino P, de Faria JB. Role of caspases on cell death, inflammation, and cell cycle in glycerol-induced acute renal failure[J]. Kidney Int, 2006,69(8):1385-1392.
[6] 沈云琳,黃文彥.急性腎損傷與細胞周期調控[J].國際兒科學雜志,2014,41(3):331-336.
[7] Goldstein SL. Acute kideny injury in children and its potential consequence in adulthood[J]. Blood Purif, 2012,33(1-3):131-137.
[8] Singbartl K, Kellum JA. AKI in the ICU:definition, epidemiology,risk stracification,and outcomes[J]. Kidney Int, 2012,81(9):819-825.
[9] 林婷,莊永澤.細胞周期調控蛋白在腎臟疾病中的表達及意義[J].中國中西醫結合腎病雜志,2010,11(8):743-746.
[10] 龍超,吳明正,何迷,等.骨髓間充質干細胞移植治療腎損傷的修復理論及歸巢機制的研究進展[J].醫學綜述,2015,21(21):3852-3855.
[11] Obaya AJ, SedivyJM. Regulation of cyclin-CDK activity in mammalian cells[J]. Cell Mol Life Sci, 2002,59(1):126-142.
[12] May M, Wang T, Muller M, et al. Difference in F-Actin depolymerization induced by toxin B from the variant clostridium difficile serotype F striain 1470[J]. Toxins(Basel), 2013,5(1):106-119.
[13] Ehrenthal DB, Jurkovitz C, Hoffman M, et al. Prepregnancy body mass index as an independent risk factor for pregnancy-induced hypertension[J]. J Womens Health, 2011,20(1):67-72.
[14] 金文虎,王達利,聶開瑜,等.增生性瘢痕成纖維細胞中CyclinD1, CDK2,CDK4作用及與細胞周期的相關性[J].中國組織工程研究,2012,16(24):4422-4426.
河北省自然科學基金項目(20150431)。
10.3969/j.issn.1002-266X.2017.27.025
R365
B
1002-266X(2017)27-0082-03
2017-03-08)

