宮頸癌組織中maspin、AKT、p-AKT表達變化及其與腫瘤微淋巴管密度的相關性
許振,劉志強,孟瑋,郭慶枝,孫莉
(濱州醫學院附屬醫院,山東濱州256600)
?
宮頸癌組織中maspin、AKT、p-AKT表達變化及其與腫瘤微淋巴管密度的相關性
許振,劉志強,孟瑋,郭慶枝,孫莉
(濱州醫學院附屬醫院,山東濱州256600)
目的 觀察宮頸癌組織中maspin、蛋白激酶B(AKT)、磷酸化蛋白激酶B(p-AKT)的表達變化,并分析其與腫瘤微淋巴管密度(LMVD)的相關性。方法 收集127例份宮頸石蠟組織標本,其中慢性宮頸炎組織20例份(炎癥組)、CINⅠ級組織20例份(CIN1組)、CINⅡ級組織20例份(CIN2組)、CINⅢ級組織20例份(CIN3組)、宮頸癌組織47例份(宮頸癌組,其中無淋巴結轉移32例為宮頸癌1組、有淋巴結轉移15例為宮頸癌2組)。采用免疫組化SP法檢測各組maspin、AKT、P-AKT,測算腫瘤微淋巴管密度(LMVD)。結果 宮頸癌1組、宮頸癌2組maspin蛋白陽性表達比例低于其余各組(P均<0.05)。宮頸癌1組、宮頸癌2組AKT、p-AKT陽性表達比例高于其余三組(P均<0.05)。宮頸癌2組p-AKT陽性表達比例高于宮頸癌1組(P<0.05)。宮頸癌組織中maspin與AKT表達呈負相關關系(rs=-0.472,P=0.001),maspin與p-AKT表達也呈負相關關系(rs=-0.598,P=0.000)。宮頸癌1組、宮頸癌2組LMVD分別為(19.44±2.95)、(23.24±2.46)支/mm2,淋巴結轉移與LMVD呈正相關關系(rs=0.44,P=0.000)。宮頸癌組織中LMVD與maspin表達呈負相關關系(rs=-0.554,P=0.000),LMVD與p-AKT表達呈正相關關系(rs=0.39,P=0.007)。結論 宮頸癌組織中maspin表達下調,AKT、p-AKT表達上調,且maspin表達與AKT、p-AKT表達均呈負相關關系;宮頸癌組織中LMVD與maspin表達呈負相關關系,LMVD與p-AKT表達呈正相關關系。maspin表達下調可能參與了宮頸癌的發生發展,機制可能與AKT通路異常激活、促進腫瘤微淋巴管生成有關。
宮頸癌;maspin基因;蛋白激酶B;微淋巴管密度
宮頸癌是最常見的女性生殖道惡性腫瘤之一,我國每年新發病例占世界宮頸癌新發病例總數的1/3,每年死于宮頸癌的患者約5萬人[1]。雖然手術、放療及化療的綜合治療已經明顯改善了宮頸癌患者的預后,但對已經發生淋巴結轉移的宮頸癌治療效果仍不太理想。淋巴結轉移是宮頸癌最常見、最重要的轉移途徑之一,也是影響患者預后的重要因素。maspin基因是絲氨酸蛋白酶抑制劑的一員,研究發現maspin對乳腺、前列腺等腫瘤的生長、侵襲、轉移有明顯抑制作用。maspin基因在宮頸鱗癌淋巴管生成及腫瘤轉移中的作用機制尚不清楚。近年來學者們通過對淋巴管標志物及淋巴管生成因子進行研究發現,血管密度及微淋巴管密度(LMVD)是多種實體瘤預后的參考指標之一[2,3]。磷脂酰肌醇-3激酶(PI3K)/絲蘇氨酸蛋白激酶(AKT)信號轉導通路是調控細胞增殖、維持細胞惡性生物學特性的重要轉導通路之一[4]。有研究[5]表明AKT通路在腫瘤淋巴管生成及淋巴結轉移中起著重要作用。本研究觀察了宮頸癌(鱗癌)組織中maspin、AKT、磷酸化AKT(p-AKT)的表達變化,并分析其與腫瘤LMVD的相關性。
1 材料與方法
1.1 組織標本及主要試劑 2009年2月~2016年2月濱州醫學院附屬醫院婦產科宮頸活檢或手術中切取的宮頸石蠟組織標本127例份,其中慢性宮頸炎組織20例份(炎癥組)、CINⅠ級組織20例份(CIN1組)、CINⅡ級組織20例份(CIN2組)、CINⅢ級組織20例份(CIN3組)、宮頸癌組織47例份(宮頸癌組,其中無淋巴結轉移32例為宮頸癌1組、有淋巴結轉移15例為宮頸癌2組)。炎癥組、CIN1組、CIN2組、CIN3組、宮頸癌組患者的年齡分別為(35.3±6.7)、(36.2±5.7)、(38.9±7.5)、(42.3±6.3)、(48.4±6.8)歲。各組標本來源患者均無其他惡性腫瘤病史,獲取標本前均未接受過放療及化療,均經病理檢查證實診斷。兔抗人AKT單克隆抗體購自美國Cell Signaling公司。兔抗人p-AKT(Ser473)單克隆抗體購自美國Cell Signaling公司。即用型鼠抗人D2-40單克隆抗體購自北京中杉金橋生物技術有限公司。兔抗人maspin單克隆抗體購自北京博奧森生物技術有限公司。
1.2 不同宮頸病變組織中maspin、AKT、p-AKT檢測 將標本進行4 μm厚石蠟切片,免疫組化SP法染色,用PBS代替一抗作為陰性對照,用已知陽性片做陽性對照。maspin、AKT、p-AKT定位于細胞核與細胞質,以細胞核與細胞質中出現棕黃色顆粒為陽性細胞。按照著色強度和陽性細胞百分比判定結果:著色強度為無色計0分、淺黃色計1分、黃色及更深顏色計2分,陽性細胞百分比≤50%計0分、>50%~75%計1分、>75%計2分[6];上述兩項得分相乘,≥2判定為目的蛋白表達陽性。
1.3 宮頸癌組織中LMVD觀察及計算方法 利用D2-40單克隆抗體標記宮頸癌組織中的微淋巴管并計算LMVD。參考文獻[7]方法:D2-40表達定位于淋巴管內皮細胞,呈棕黃色或棕褐色顆粒。先在40倍鏡下選擇4個微淋巴管高密度區即所謂的“熱點”,然后在400倍鏡視野(0.16 mm2/視野)下記數,取4個視野的平均數(單位為支/mm2)。含有平滑肌或大于8個內皮細胞的管腔及未染色的管腔不記數。
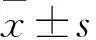
2 結果
2.1 各組Maspin、AKT、p-AKT表達比較 宮頸癌1組、宮頸癌2組maspin蛋白陽性表達比例低于其余各組(P均<0.05)。宮頸癌1組、宮頸癌2組AKT、p-AKT陽性表達比例高于其余三組(P均<0.05)。宮頸癌2組p-AKT陽性表達比例高于宮頸癌1組(P<0.05)。詳見表1、圖1~3。

表1 各組maspin、AKT、p-AKT陽性表達情況(例)

注:A為炎癥組;B為CIN3組;C為宮頸癌組。
圖1 炎癥組、CIN3組、宮頸癌組中mapsin表達情況

注:A為炎癥組;B為CIN3組;C為宮頸癌組。
圖2 炎癥組、CIN3組、宮頸癌組中AKT表達情況

注:A為炎癥組;B為CIN3組;C為宮頸癌組。
圖3 炎癥組、CIN3組、宮頸癌組中p-AKT表達情況
2.2 宮頸癌組maspin、AKT、p-AKT表達的相關性 47例宮頸癌組織中maspin、AKT同時陽性表達的有0例、同時陰性表達的有3例,maspin與AKT表達呈負相關關系(rs=-0.472,P=0.001);宮頸癌組織中maspin、p-AKT同時陽性表達的有3例、同時陰性表達的有4例,maspin與p-AKT表達呈負相關關系(rs=-0.598,P=0.000)。
2.3 宮頸癌組LMVD表達變化及其與maspin、AKT、p-AKT表達的相關性 宮頸癌1組、宮頸癌2組LMVD分別為(19.44±2.95)、(23.24±2.46)支/mm2,淋巴結轉移與LMVD呈正相關關系(rs=0.44,P=0.000)。宮頸癌組中,maspin陽性組、maspin陰性組的LMVD分別為(17.45±2.88)、21.91±3.70)支/mm2,maspin陽性組LMVD低于maspin陰性組(P<0.05);AKT陽性組、AKT陽性組LMVD分別為(21.14±3.19)、(17.00±3.00)支/mm2,AKT陽性組LMVD高于AKT陰性組(P<0.05);p-AKT陽性組、p-AKT陽性組LMVD分別為(21.41±3.17)、(18.62±2.79)支/mm2,p-AKT陽性組LMVD高于p-AKT陰性組(P<0.05)。Spearman相關分析顯示,宮頸癌組織中LMVD與maspin表達呈負相關關系(rs=-0.554,P=0.000),LMVD與p-AKT表達呈正相關關系(rs=0.39,P=0.007)。
3 討論
maspin基因是一種絲氨酸蛋白酶抑制劑基因,其不但對乳腺癌、前列腺癌等腫瘤的生長、侵襲、轉移有明顯抑制作用,而且能上調乳腺癌、前列腺癌細胞中凋亡前蛋白Bax的表達,增強腫瘤細胞對凋亡誘導的敏感性[8]。Nam等[9]將含有maspin基因的質粒注入植有NCIH157肺癌細胞株的裸鼠瘤體中,發現含有maspin基因質粒的實驗組成瘤體積遠小于對照組,預示著maspin基因在腫瘤基因治療方面有著廣闊前景。本研究結果顯示,宮頸癌1組、宮頸癌2組maspin蛋白陽性表達比例低于CIN3組,提示maspin蛋白在宮頸CINⅢ發展到宮頸癌的過程中起著重要作用。大量臨床研究及動物實驗證實maspin基因表達具有抑制侵襲和遷移、抑制腫瘤血管生成的特性[10~12],maspin是一個多功能的抑癌基因。隨著腫瘤微淋巴管的相關研究不斷增多,有學者研究證實maspin基因可調節腫瘤微淋巴管的生成[13,14]。Wang等[13]發現在非小細胞肺癌患者中,maspin基因表達與VEGF-C表達呈負相關,maspin基因表達與淋巴結轉移情況有關。但本研究中宮頸癌1組和宮頸癌2組的maspin陽性表達比例差異無統計學意義,考慮與樣本量較少有關。
PI3K/AKT通路在腫瘤細胞增殖、遷移、侵襲及抗凋亡中都起到舉足輕重的作用[4,15]。PI3K/AKT通路在腫瘤細胞G1期到S期轉變時變得非常活躍,可以調節細胞周期調控關鍵因子P21CIP1、Cyclin D、p27Kip1的蛋白質穩定性[16]。PI3K/AKT通路分子高表達使得腫瘤細胞處于增殖活躍期并具有明顯的抗凋亡作用。有研究[17]顯示人乳頭瘤病毒16(HPV16)分泌的E7蛋白可激活AKT通路,調控腫瘤細胞的增殖和轉移,這與宮頸癌的發生發展關系密切。Chen等[18]利用免疫組化法檢測了55例胃腺癌患者石蠟手術標本中的mTOR、AKT、VEGF-C、VEGF-D,并計算了淋巴管密度,結果表明淋巴管密度與mTOR、AKT、VEGF-C、VEGF-D表達呈正相關關系,提示AKT通路的異常激活可能是眾多惡性腫瘤發生發展及淋巴結轉移的重要因素。本研究結果顯示,宮頸癌1組、宮頸癌2組AKT、p-AKT陽性表達比例高于其余三組,宮頸癌2組p-AKT陽性表達比例高于宮頸癌1組,提示AKT、p-AKT高表達與宮頸癌的發生和進展密切相關,與上述研究結果一致。
淋巴轉移是宮頸癌最常見、最重要的轉移途徑之一。Birner等[19]報道在宮頸癌早期,淋巴管未受侵組5年無病生存率達84.1%,而淋巴管受侵組僅48.2%。腫瘤細胞侵入淋巴管與微淋巴管的超微結構有著密切關系[20]。微淋巴管具有以下特征:管壁很薄,僅由一層連續的內皮細胞和少量結締組織構成;無基膜或基膜不連續;內皮細胞常相互重疊、連接處常存在間隙,內皮外有錨絲等。這些超微結構特點為腫瘤細胞的侵入提供了結構形態基礎。本研究發現,宮頸癌淋巴結轉移與LMVD呈正相關關系,證實了上述結論。我們發現,在宮頸癌組織中,maspin與AKT、p-AKT表達均呈負相關關系,LMVD與maspin表達呈負相關關系,LMVD與p-AKT表達呈正相關關系,推測maspin蛋白可能有抑制AKT通路激活的作用,maspin基因失表達可能與AKT通路異常激活有著密切聯系,而AKT通路與腫瘤微淋巴管生成有關。已有研究[5]表明,AKT通路可進一步促進VEGF-C、VEGF-D、VEGF-3、FGF-2、HGF、IGF、ANG-1等因子表達,促進淋巴管生成,最終導致腫瘤細胞發生淋巴結轉移。
結合上述研究結果,我們推測,maspin表達下調可能參與了宮頸癌的發生發展,機制可能與AKT通路異常激活、促進腫瘤微淋巴管生成有關。但本研究實驗方法較為單一,maspin基因對PI3K/AKT通路的具體作用機制以及maspin蛋白的功能靶點仍有待進一步研究。
[1] 赫捷,陳萬青.2011中國腫瘤登記年報[M].北京:軍事醫學科學出版社,2012:26-37.
[2]Schweiger T, Nikolowsky C, Graeter T, et al. Increased lymphangiogenesis in lung metastases from colorectal cancer is associated with early lymph node recurrence and decreased overall survival[J]. Clin Exp Metastasis, 2015,33(2):1-9.
[3] Zhang N, Xie F, Gao W, et al. Expression of hepatocyte growth factor and c-Met in non-small-cell lung cancer and association with lymphangiogenesis[J]. Mol Med Rep, 2011,11(4):2797.
[4] Yu JS, Cui W. Proliferation, survival and metabolism: the role of PI3K/AKT/mTOR signalling in pluripotency and cell fate determination[J]. Development, 2016,143(17):3050.
[5] 趙靜靜,戴小軍,張曉春.Akt介導的信號通路在腫瘤淋巴管生成中的作用[J].腫瘤防治研究,2016,43(5):422-426.
[6] Khor TO, Gul YA, Ithnin H, et al. Positive correlation between overexpression of phospho-BAD with phosphorylated Akt at serine 473 but not threonine 308 in colorectal carcinoma[J]. Cancer Let, 2004,210(2):139-150.
[7] Weidner N, Carroll PR, Flax J, et al. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma[J]. Am J Pathol,1993,143(2):401-409.
[8] Liu J, Yin S, Reddy N, et al. Bax Mediates the apoptosis-sensitizing effectof maspin[J]. Cancer Res, 2004,64:1703-1711.
[9] Nam E, Park C. Maspin suppresses survival of lung cancer cells through modulation of Akt pathway[J]. Cancer Res Treat, 2010,42(1):42-47.
[10] Al-Mamun MA, Farid DM, Ravenhil L, et al. An in silico model to demonstrate the effects of maspin on cancer cell dynamics[J]. J Theor Biol, 2016,388(4):37-49.
[11] Ciortea D, Jung I, Gurzu S, et al. Correlation of angiogenesis with other immunohistochemical markers in cutaneous basal and squamous cell carcinomas[J]. Rom J Morphol Embryol, 2015,56(2 Suppl): 665-670.
[12] Chen WS, Yen CJ, Chen YJ, et al. miRNA-7/21/107 contribute to HBx-induced hepatocellular carcinoma progression through suppression of maspin[J]. Oncotarget, 2015,6(28):25962-25974.
[13] Wang X, Wang Y, Li S, et al. Decreased maspin combined with elevated vascular endothelial growth factor C is associated with poor prognosis in non-small cell lung cancer[J]. Thor Cancer, 2014, 5(5):383-390.
[14] Strien L, Joensuu K, Heikkila P, et al. Different Expression Patterns of CXCR4, CCR7, Maspin and FOXP3 in Luminal Breast Cancers and Their Sentinel Node Metastases[J]. Anticancer Res, 2017,37(1):175-182.
[15] Zhang L, Wu J, Ling MT, et al. The role of the PI3K/Akt/mTOR signalling pathway in human cancers induced by infection with human papillomaviruses[J]. Molecul Cancer, 2015,14(1):87.
[16] Liang J, Slingerland JM. Multiple roles of the PI3K/PKB (Akt) pathway in cell cycle progression[J]. Cell Cycle, 2003,2(4):339-345.
[17] Pickard A, McDade SS, McFarland M, et al. HPV16 down-Regulates the insulin-Like growth factor binding protein 2 to promote epithelial invasion in organotypic cultures[J]. PLoS Pathog, 2015,11(6): e1004988.
[18] Chen H, Guan R, Lei Y, et al. Lymphangiogenesis in Gastric Cancer regulated through Akt/mTOR-VEGF-C/VEGF-D axis[J]. BMC Cancer, 2015,15(1):103.
[19] Birner P, Obermair A, Schindl M, et al. Selective immunohistochemical staining of blood and lymphatic vessels reveals independent prognostic influence of blood and lymphatic vessels invasion in early-stage cervical cancer [J]. Clin Cancer Res, 2001,7(1):93-97.
[20] Rovenska E. Importance of lymphangiogenesis and ultrastructure of lymphatic capillaries in metastasis of malignant melanoma[J]. Vnitr Lek, 2014,60:582-585.
Expression of maspin, AKT, and p-AKT in cervical carcinoma and its correlation with tumor lymphatic microvessel density
XUZhen,LIUZhiqiang,MENGWei,GUOQizhi,SUNLi
(BinzhouMedicalUniversityHospital,Binzhou256600,China)
Objective To observe the expression changes of maspin, protein kinase B (AKT), and phosphorylated protein kinase B (p-AKT) in the cervical cancer tissues and to analyze its correlation with tumor lymphatic microvessel density (LMVD). Methods Twenty-seven cases of cervical paraffin tissues were collected, including 20 cases of chronic cervicitis (inflammation group), 20 cases of cervical intraepithelial neoplasia (CIN) Ⅰ (CIN1 group), 20 cases of CIN Ⅱ (CIN2 group), 20 cases of CIN Ⅲ (CIN3 group), and 47 cases of cervical cancer tissues (cervical cancer group, including 32 cases without lymph node metastasis of cervical cancer group 1 and 15 cases with lymph node metastasis of cervical cancer group 2). The levels of maspin, AKT, and P-AKT were measured by immunohistochemical SP method, and the LMVD was measured. Results The positive rate of maspin protein in the cervical cancer group 1 and cervical cancer group 2 was lower than that in the CIN3 group (allP<0.05). The positive expression rates of AKT and p-AKT in the cervical cancer group 1 and cervical cancer group 2 were higher than those in the other three groups (allP<0.05). The positive expression rate of p-AKT in the cervical cancer group 1 was higher than that in the cervical cancer group 2 (P<0.05). There was a negative correlation between the expression of maspin and AKT in the cervical cancer tissues (rs=-0.472,P=0.001). There was also a negative correlation between maspin and p-AKT expression (rs=-0.598,P=0.000). LMVD in the cervical cancer groups 1 and 2 were (19.44±2.95) and (23.24±2.46) vessels/mm2, respectively. There was a positive correlation between lymph node metastasis and LMVD (rs=0.44,P=0.000). There was a negative correlation between LMVD and the expression of maspin in the cervical cancer tissues (rs=-0.554,P=0.000). There was a positive correlation between LMVD and p-AKT expression (rs=0.39,P=0.007). Conclusions The expression of AKP and p-AKT is up-regulated in the cervical cancer tissues, and the expression of maspin is down-regulated, which is negatively correlated with both AKT and p-AKT expression. In the cervical cancer tissues, LMVD is negatively correlated with maspin expression, but is positively correlated with AKT expression. The down-regulation of maspin expression may be involved in the development of cervical cancer, and the mechanism may be related to the abnormal activation of AKT pathway and the promotion of tumor micro-lymphangion genesis.
cervical cancer; maspin gene; protein kinase B; lymphatic microvessel density
山東省自然科學基金資助項目(ZR2012HL01)。
許振(1989-),男,碩士,主要研究方向為婦科腫瘤。E-mail:2005891282qq.com
劉志強(1971-),男,博士,教授,主任醫師,主要研究方向為婦科腫瘤。E-mail:2005891282qq.com
10.3969/j.issn.1002-266X.2017.27.006
R737.33
A
1002-266X(2017)27-0023-04
2017-02-27)

