托吡酯腹腔注射后癲癇大鼠海馬組織損傷變化及其機制探討
李香丹,尹明姬,楊洋,林貞花,咸哲民,李今子
(1延邊大學附屬醫院,吉林延吉133002;2延邊大學)
?
托吡酯腹腔注射后癲癇大鼠海馬組織損傷變化及其機制探討
李香丹1,尹明姬1,楊洋2,林貞花2,咸哲民1,李今子1
(1延邊大學附屬醫院,吉林延吉133002;2延邊大學)
目的 觀察托吡酯(TPM)腹腔注射后癲癇大鼠海馬組織損傷改變,并探討其可能機制。方法 將40只大鼠依據隨機數字表法分為正常組、模型組、TPM低劑量組、TPM高劑量組。模型組、TPM低劑量組、TPM高劑量組采用腹腔注射氯化鋰180 mg/kg、匹羅卡品30 mg/kg制作癲癇模型。模型組、TPM低劑量組、TPM高劑量組大鼠分別于癲癇發作后5 h經腹腔注射生理鹽水10 mL/(kg·d)、TPM 40 mg/(kg·d)、TPM 80 mg/(kg·d)。各組連續用藥4周后處死大鼠取海馬組織,HE染色觀察大鼠海馬組織病理變化;應用基因芯片技術篩選各組差異表達的miRNA,并用實時熒光定量PCR法進行驗證;采用TUNEL法檢測海馬組織凋亡細胞,并計算凋亡細胞數;分別采用Western blotting法、免疫熒光法和免疫組化法檢測各組大鼠海馬組織中的Caspase-8。結果 與正常組相比,模型組海馬組織損傷明顯,TPM低劑量組和TPM高劑量組海馬組織損傷較模型組減輕,且TPM低劑量組損傷最輕。基因芯片檢測發現模型組出現12個表達上調的miRNA和14個表達下調的miRNA,經實時熒光定量PCR驗證,只有miR-146a在各組表達的差異有統計學意義。模型組、TPM高劑量組、TPM低劑量組、正常組海馬組織中miR-146a相對表達量依次降低(P均<0.05)。細胞凋亡檢測發現,與正常組相比,模型組大鼠CA1區、CA3區和DG區凋亡細胞細胞數高于正常組(P均<0.05),而TPM高劑量組和TPM低劑量組凋亡細胞數低于模型組(P均<0.05)。Western blotting結果顯示,模型組Caspase-8蛋白相對表達量高于正常組,模型組、TPM高劑量組、TPM低劑量組Caspase-8蛋白相對表達量依次降低(P均<0.01)。免疫熒光結果顯示,與正常組相比,模型組大鼠CA1區、CA3區和DG區Caspase-8陽性細胞數高于正常組(P均<0.05),TPM高劑量組和TPM低劑量組Caspase-8陽性細胞數低于模型組(P均<0.05)。免疫組化結果顯示,模型組IOD值高于正常組,模型組、TPM高劑量組、TPM低劑量組IOD值依次降低(P均<0.05)。結論 TPM腹腔注射可減輕癲癇大鼠海馬組織病理改變,減少海馬組織細胞凋亡,下調海馬組織中miR-146a和Caspase-8的表達,其中40 mg/(kg·d)的TPM較80 mg/(kg·d)效果更加明顯。TPM的抗癲癇作用機制可能與調節miRNA表達、減少細胞凋亡、下調Caspase-8表達有關。
癲癇;托吡酯;海馬;微小RNA;微小RNA146a;細胞凋亡;含半胱氨酸的天冬氨酸蛋白水解酶8
癲癇是一種慢性神經系統疾病,其中耐藥的難治性癲癇占到了1/3[1]。miRNA能通過堿基互補結合靶基因3′非編碼區,抑制其轉錄和(或)增加其降解[2]。我們前期研究發現miRNA廣泛參與癲癇的發生發展,可調節癲癇誘發神經元死亡的過程[3]。托吡酯(TPM)是一種由氨基磺酸酯取代單糖的新型廣譜抗癲癇藥物,生物利用度高,具有多重抗癲癇機制[4]。目前研究表明TPM不僅有助于治療難治性癲癇,也可輔助或單藥治療非難治性癲癇[5]。TPM治療癲癇的具體機制仍不十分明確。本研究采用氯化鋰、匹羅卡品制作癲癇大鼠模型并給予TPM治療,觀察TPM處理后癲癇大鼠海馬組織中miRNA、Caspase-8表達改變,初步探討TPM治療癲癇的可能機制。
1 材料與方法
1.1 實驗動物與主要材料 清潔級雄性SD大鼠40只,體質量(220±20)g,由延邊大學醫學院實驗教學中心動物部提供,分籠飼養在溫度18~25 ℃、相對濕度50%~60%、人工晝/夜循環照明(7:00至19:00)環境中。大鼠可自由飲食。氯化鋰,匹羅卡品,水合氯醛,TRIzol試劑,miRNAs和U6的引物,RNA純化試劑盒,RT-qPCR試劑盒,TUNEL 染色試劑盒,鼠抗Caspase-8抗體,辣根過氧化物酶標記山羊抗鼠IgG,BCA蛋白定量試劑盒,DAB顯色液。
1.2 癲癇模型制作及TPM用法 將大鼠依據隨機數字表法分為正常組、模型組、TPM低劑量組、TPM高劑量組。模型組、TPM低劑量組、TPM高劑量組采用腹腔注射氯化鋰180 mg/kg、匹羅卡品30 mg/kg誘發大鼠癲癇發作。依據Racine標準[6],達到Ⅳ~Ⅴ級癲癇發作標準即為造模成功。未出現癲癇發作的大鼠追加10 mg/kg的匹羅卡品,每間隔30 min給藥1次,直到出現癲癇發作,每只大鼠匹羅卡品用量最多不超過60 mg/kg。正常組給予等量生理鹽水。模型組、TPM低劑量組、TPM高劑量組大鼠分別于癲癇發作后5 h經腹腔注射生理鹽水10 mL/(kg·d)、TPM 40 mg/(kg·d)、TPM 80 mg/(kg·d),連續用藥4周。
1.3 海馬組織病理觀察 在飼養第28天時(用藥4周后)將各組大鼠以10%水合氯醛3 mL/kg腹腔注射麻醉,斷頭取腦,迅速在含有生理鹽水的冰面上鈍性分離出雙側海馬組織,左腦海馬立即進行4%多聚甲醛固定,制備海馬組織石蠟標本,以5 μm厚連續切片,HE染色觀察各組大鼠組織學改變。右腦海馬組織凍存于-80 ℃液氮中用于RNA提取。
1.4 海馬組織中差異表達miRNA篩選 取各組大鼠右腦海馬組織解凍,溶于適量TRIzol試劑中提取總RNA。選取各組RNA標本,依據操作說明加多聚A尾、標記、雜交、洗滌、染色后,用miRNA3.0儀器進行檢測,圖片輸入Expression Console軟件進行分析,獲得原始數據,經背景校正及篩選后,采用BMA進行對數轉化,使用Genesrping軟件進行數據分析。候選miRNAs變化倍數用Java Treeview軟件進行可視化處理。隨后采用實時熒光定量基因驗證差異表達的miRNA。將純化的RNA進行逆轉錄成cDNA,以U6作為內參,所用到的PCR引物序列詳見表1。PCR反應條件為94 ℃ 15 min、94 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,共循環40次,最后72 ℃延伸8 min。每組樣品設3個復孔。以2-ΔΔCt表示目的基因相對表達量。

表1 目的基因與內參基因引物序列
1.5 海馬組織中凋亡細胞檢測 采用TUNEL法檢測海馬組織凋亡細胞。切片脫蠟后按照TUNEL染色試劑盒說明書進行染色,中性樹膠封片。400倍光鏡下,每份腦組織隨機選取3個切片,每個海馬切片的不同區域隨機選取5個區域,計數TUNEL染色陽性細胞數,計算平均數。
1.6 海馬組織中Caspase-8檢測 ①Western blotting法:提取各組海馬組織總蛋白,BCA法蛋白定量,SDS-PAGE電源分離目的條帶,每孔加入20 μL的樣品進行電泳,完成后用孔徑0.45 μm的PVDF膜進行濕轉;用山羊血清常溫封閉30 min,加入鼠抗人Caspase-8一抗(或β-actin一抗,1∶1 000)4 ℃孵育過夜,次日常溫下TBST洗膜3次,加入辣根過氧化物酶標記的羊抗鼠二抗孵育1 h;ECL化學發光法檢測,柯達膠片暗室顯影,采用Quantity one軟件對反應條帶進行分析,蛋白相對表達量用Caspase-8條帶灰度與內參的比值表示。②免疫熒光法:海馬組織石蠟切片經脫蠟、梯度乙醇脫水后,進行抗原修復,PBST漂洗5 min×3次;2% BSA 37 ℃濕盒內封閉30 min,用Caspase-8一抗4 ℃染色過夜,在標本片上滴加1∶20稀釋的熒光標記抗體,放在濕盒中37 ℃孵育60 min,PBS洗5 min×3次;加DAPI(1∶1 000)復染細胞核,PBS漂洗緩沖,甘油封片,在熒光顯微鏡下觀察,各組切片隨機選5個視野計算陽性細胞數。③免疫組化法:海馬組織切片常規脫蠟、水化、抗原修復,用3% H2O2去離子水孵育10 min,PBS沖洗;正常山羊血清封閉液孵育2 h,加入鼠抗鼠Caspase-8一抗(1 μg/mL)4 ℃孵育過夜,加辣根過氧化物酶標記山羊抗兔IgG(1∶200)室溫孵育1 h,其間使用PBS充分洗滌;最后切片入DAB顯色液中顯色5~10 min,貼片,常規脫水透明封片。采用Olympus高清晰彩色圖像處理系統觀察和采集圖像,每只大鼠各取切片3張,隨機選擇5個高倍鏡視野,以Image Pro Plus6.0軟件進行圖像分析,測定并記錄每張圖片的積分光密度(IOD)值。
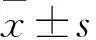
2 結果
2.1 各組大鼠海馬組織病理改變 正常組海馬神經元呈條帶狀分布,排列規則,細胞核大,細胞質少,無神經元壞死表現,CA1和CA3區見大量致密錐體細胞,排列規則,邊緣清晰。模型組海馬結構明顯受損,CA1區、CA3區及齒狀回(DG)區可見神經元細胞腫脹、增大,多數出現壞死,細胞形態改變,界限不清。TPM高劑量組和TPM低劑量組海馬結構損傷較模型組減輕,CA1區細胞形態較好、無明顯變性,CA3區見少量核固縮現象、大部分胞核清晰,DG區顆粒細胞排列尚齊、偶有核固縮和變性,以TPM低劑量組海馬組織損傷最輕。見圖1。

圖1 各組大鼠海馬組織結構變化
2.2 各組大鼠海馬組織中miRNA表達改變 相比于正常組,模型組共發現12個表達上調的miRNA(rno-miR-146a、rno-miR-183、rno-miR-204、rno-miR-210、rno-miR-339、rno-miR-34、rno-miR-351、rno-miR-429、rno-miR-455、rno-miR-466b-1、rno-miR-503、rno-miR-532)和14個表達下調的miRNA(rno-miR-101a、rno-miR-382、rno-miR-451、rno-miR-380、rno-miR-488、rno-miR-499、rno-miR-338、rno-miR-551b、rno-miR-383、rno-miR-592、rno-miR-598-3p、rno-miR-374、rno-miR-9、rno-miR-33)。與模型組比較,TPM低劑量組和TPM高劑量組miRNAs表達譜改變不同。其中關于rno-miR-146a、rno-mir-210、rno-mir-34和rno-mir-488在癲癇中的作用研究甚少。采用實時熒光定量PCR進一步驗證芯片結果發現,只有miR-146a在各組表達的差異有統計學意義。模型組、TPM高劑量組、TPM低劑量組、正常組海馬組織中miR-146a相對表達量依次降低(P均<0.05)。見表2。
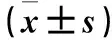
表2 各組海馬組織中rno-miR-146a、rno-mir-210、rno-mir-34a、rno-mir-488相對表達量比較
2.3 各組海馬組織中凋亡細胞數比較 與正常組相比,模型組大鼠CA1區、CA3區和DG區凋亡細胞數高于正常組(P均<0.05),而TPM高劑量組和TPM低劑量組凋亡細胞數低于模型組(P均<0.05)。見表3。

表3 各組大鼠海馬組織中凋亡細胞數比較(個
2.4 各組大鼠海馬組織中Caspase-8表達比較 Western blotting結果顯示,正常組、模型組、TPM低劑量組和TPM高劑量組海馬組織中Caspase-8蛋白相對表達量分別為1.03±0.26、4.33±0.37、1.96±0.19、3.05±0.22,其中模型組Caspase-8蛋白相對表達量高于正常組,模型組、TPM高劑量組、TPM低劑量組Caspase-8蛋白相對表達量依次降低(P均<0.01)。免疫熒光結果顯示,與正常組相比,模型組大鼠CA1區、CA3區和DG區Caspase-8陽性細胞數高于正常組(P均<0.05),TPM高劑量組和TPM低劑量組Caspase-8陽性細胞數低于模型組(P均<0.05)。免疫組化結果顯示,模型組IOD值高于正常組,模型組、TPM高劑量組、TPM低劑量組IOD值依次降低(P均<0.05)。詳見表4、5。

表4 免疫熒光法測各組大鼠海馬組織中Caspase-8陽性細胞數比較(個

表5 免疫組化法測各組大鼠海馬組織中Caspase-8表達比較
3 討論
盡管目前已有許多抗癲癇藥物(AEDs)大大增加了癲癇治療的有效性,但癲癇病死率仍居高不下[7]。耐藥型癲癇大部分都是顳葉癲癇(TLE)。本研究采用氯化鋰、匹羅卡品誘導大鼠癲癇模型,與我們研究組先前采用戊四氮所致癲癇大鼠的行為類似[8]。與正常組比較,模型組海馬組織出現核固縮、碎裂和溶解以及細胞壞死,同時出現大量凋亡細胞,這與我們先前所觀察的癲癇大鼠模型表現一致[6]。TPM作為一種新型廣譜抗癲癇藥物,其作用機制可能包括:①選擇性阻斷鈉離子通道,從而限制癲癇持續、重復發作;②提高γ-氨基丁酸活性,增強抑制性神經遞質作用;③拮抗谷氨酸活性,阻斷其介導的神經興奮作用;④阻斷T型鈣通道,阻斷癲癇持續、反復發作[9]。但是TPM發揮其作用的具體機制仍不明確,且不排除其他作用途徑。本研究結果表明,TPM對癲癇大鼠有效。為進一步探索TPM治療癲癇的機制,我們觀察了各組大鼠海馬組織中miRNA、Caspase-8的表達變化。
多項研究[10]報道miRNA在人類顳葉海馬或癲癇模型中差異表達。有學者[11]首次報道miRNA可能參與神經精神疾病的發生。研究[12]發現,癲癇大鼠miR-181a表達上調,miR-181a能通過降低抗凋亡因子Bcl-2表達水平從而促進神經元細胞凋亡,對大鼠認知功能造成損傷。研究者[13]抑制癲癇大鼠海馬組織中miR-210表達后,發現海馬神經元形態改變減輕,細胞凋亡減少。我們在模型組發現了12個表達上調的miRNA和14個表達下調的miRNA,隨后用實時熒光定量PCR進行驗證,結果顯示只有miR-146a在各組間表達有統計學差異。有學者[14]在大鼠TLE模型中發現miR-146a的表達量相比正常大鼠明顯增高,并證明miR-146a可靶向作用于補體因子H,下調miR-146a能明顯降低癲癇發作敏感性,提示miR-146a在癲癇發生發展有重要作用。本研究同樣發現miR-146a在癲癇大鼠海馬組織中表達升高,并且在TPM干預后miR-146a表達下降,TPM低劑量作用時下降更明顯,于是推測TPM治療癲癇的機制可能與調控miR-146a表達有關。
神經元凋亡參與了癲癇大鼠海馬神經元的損傷過程[15],而Caspases在細胞凋亡過程中發揮重要作用。于是我們檢測了各組大鼠海馬組織中的Caspase-8,結果顯示,TPM治療后,大鼠海馬CA1區、CA3區及DG區Caspase-8表達均減少,其中CA3區最為明顯,且低劑量TPM較高劑量TPM作用明顯;初步提示TPM的抗癲癇作用與抑制神經元凋亡有關。目前有關TPM治療癲癇的劑量學者們仍存在爭議,早期推薦其治療劑量是400 mg/d,但考慮到不良反應,患者實際使用劑量往往更低。一個大型回顧性研究提出TPM治療癲癇的使用劑量在175~200 mg/d[16]。在動物模型實驗中,有研究者認為使用100 mg/(kg·d)劑量能達到控制癲癇的效果[17],也有學者發現用85 mg/(kg·d)和80 mg/(kg·d)[18]的TPM能有效抑制大鼠癲癇發作的頻率和強度。本研究發現低劑量[40 mg/(kg·d)]TPM處理癲癇大鼠在海馬組織形態學改善和抑制神經元凋亡方面效果均較高劑量[80 mg/(kg·d)]TPM要好,而且,低劑量TPM引起miRNA表達譜改變也更為明顯。
結合上述研究結果,我們認為,TPM腹腔注射有助于減輕癲癇大鼠海馬組織病理改變,抑制神經元凋亡,并下調海馬組織中miR-146a和Caspase-8的表達,其中40 mg/(kg·d)的TPM較80 mg/(kg·d)效果更加明顯。我們推測TPM的抗癲癇作用機制與調節miRNA表達、減少神經元細胞凋亡有關。
[1] Behr C, Goltzene MA, Kosmalski G, et al. Epidemiology of epilepsy[J]. Rev Neurol (Paris), 2016,172(1):27-36.
[2] Shukla GC, Singh J, Barik S. MicroRNAs: processing, maturation target recognition and regulatory functions[J]. Mol Cell Pharmacol, 2011,3(3):83-92.
[3] 李香丹,李今子.miRNAs在人類顳葉癲癇中的作用研究進展[J].延邊大學醫學學報,2015(1):74-76.
[4] Guerrini R, Parmeggiani L. Topiramate and its clinical applications in epilepsy[J]. Expert Opin Pharmacother, 2006,7(6):811-823.
[5] Chen J, Quan QY, Yang F, et al. Effects of lamotrigine and topiramate on hippocampal neurogenesis in experimental temporal-lobe epilepsy [J]. Brain Res, 2010,1313:270-282.
[6] 李今子,許書翠,尹明姬,等.厄多司坦對癲癇大鼠海馬氧化應激及腫瘤壞死因子-α、基質金屬蛋白酶-2水平的影響[J].延邊大學醫學學報,2013(4):250-253.
[7] Ngugi AK, Bottomley C, Kleinschmidt I, et al. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach[J]. Epilepsia, 2010,51(5):883-890.
[8] 李今子,文瑛,許書翠.普羅布考對癲癇大鼠海馬神經元的影響[J].延邊大學醫學學報,2011(1):12-14.
[9] Li MM, Li XM, Zheng XP, et al. MicroRNAs dysregulation in epilepsy[J]. Brain Res, 2014,1584:94-104.
[10] Miller DT, Shen Y, Weiss LA, et al. Microdeletion/duplication at 15q13.2q13.3 among individuals with features of autism and other neuropsychiatric disorders[J]. J Med Genet, 2009,46(4):242-248.
[11] Huang Y, Liu X, Liao Y, et al. MiR-181a influences the cognitive function of epileptic rats induced by pentylenetetrazol[J]. Int J Clin Exp Pathol, 2015,8(10):12861-12868.
[12] Chen L, Zheng H, Zhang S. Involvement of upregulation of miR-210 in a rat epilepsy model [J]. Neuropsychiatr Dis Treat, 2016,12:1731-1737.
[13] He F, Liu B, Meng Q, et al. Modulation of miR-146a/complement factor H-mediated inflammatory responses in a rat model of temporal lobe epilepsy[J]. Biosci Rep, 2016,36(6):00433.
[14] Zhang B, Zhang JW, Wang WP, et al. Effect of lamotrigine on epilepsy-induced cognitive impairment and hippocampal neuronal apoptosis in pentylenetetrazole-kindled animal model[J]. Synapse, 2017,71(2). doi: 10.1002/syn.21945.
[15] Hu Y, Lu Y, Yu W, et al. Long-term retention rate of topiramate as initial monotherapy in Chinese patients with newly diagnosed epilepsy: a prospective, observational study[J]. Epilepsy Res, 2010,90(3):278-284.
[16] Poston S, Dickson M, Johnsrud M, et al. Topiramate prescribing patterns among medicaid patients: diagnosis, comorbidities, and dosing [J]. Clin Ther, 2007,29(3):504-518.
[17] Gurses C, Orhan N, Ahishali B, et al. Topiramate reduces blood-brain barrier disruption and inhibits seizure activity in hyperthermia-induced seizures in rats with cortical dysplasia[J]. Brain Res, 2013,1494:91-100.
[18] Ye F, Chen XQ, Bao GS, et al. Effect of topiramate on interleukin 6 expression in the hippocampus of amygdala-kindled epileptic rats [J]. Exp Ther Med, 2014,7(1):223-227.
Changes of hippocampal injuries in epileptic rats after intraperitoneal injection of topiramate and its mechanism
LIXiangdan1,YINMingji,YANGYang,LINZhenhua,XIANZhemin,LIJinzi
(1TheAffiliatedHospitalofYanbianUniversity,Yanji133002,China)
Objective To observe the changes of hippocampal injuries in epileptic rats after intraperitoneal injection of topiramate (TPM), and to explore its potential mechanisms. Methods Forty rats were randomly divided into the normal group, model group, low-dose TPM group, and high-dose TPM group. The rats in the model group, low-dose TPM group, and high-dose TPM group were treated with 10 mL/kg/d saline, 40 mg/kg/d TPM and 80 mg/kg/d TPM, respectively, for 4 weeks to make the epileptic models. At 5 h after epileptic seizure, rats in the model group, low-dose TPM group, and high-dose TPM group were intraperitoneally injected with 10 mL/(kg·d) normal saline , 40 mg/(kg·d) TPM , and 80 mg/(kg·d) TPM. After 4 weeks of continuous administration, rats were sacrificed to obtain the hippocampus tissues. HE staining was performed to observe the morphological changes of hippocampus. The differentially expressed miRNAs were obtained by miRNA microarray and were identified by real-time fluorescent quantitative PCR. TUNEL assay was used to detect apoptosis of hippocampal neurons and the number of apoptotic cells were counted. The expression levels of Caspase-8 were detected by Western blotting, immunohistochemistry (IHC) and immunofluorescence (ICC). Results The hippocampus was obviously damaged in model group as compared with that of the normal group, whereas the injuries were alleviated in both low-dose TPM group and high-dose TPM group, especially the former one. A total of 12 miRNAs were up-regulated and 14 miRNAs were down-regulated in the model group as compared with those of the normal group. Interestingly, the miR-146a expression was significantly down-regulated both in low- and high-dose TPM groups as compared with that of the model group (allP<0.05). Compared with the normal group, the number of apoptotic cells in the CA1, CA3 and DG regions was significantly higher in the model group (allP<0.05). Meanwhile, the number of apoptotic cells was smaller in the low-dose TPM group and high-dose TPM group than that of the model group (allP<0.05). Western blotting showed that the Caspase-8 protein expression of the model group was higher than that of the normal group, and the Caspase-8 protein expression was successively decreased in the model group, high-dose, and low-dose TPM groups (allP<0.01). Similarly, ICC showed that the number of Caspase-8 positive cells in the CA1, CA3 and DG regions significantly increased in the model group as compared with that of the normal group (allP<0.05). Compared with the model group, the number of Caspase-8 positive cells in the low-dose TPM group and high-dose TPM group were dramatically reduced (allP<0.05). What's more, the results of IHC identified that the integrated option density (IOD) value was significantly higher in the model group as compared with that of the normal group. The value of IOD was successively decreased in the model group, low-dose TPM group, and high-dose TPM group (allP<0.05).Conclusions The intraperitoneal injection of TPM effectively alleviates hippocampal injuries in epileptic rats, inhibits neuronal apoptosis and down-regulates the expression of miR-146a and Caspase-8. Meanwhile, 40 mg/(kg·d) TMP shows greater effect than 80 mg/(kg·d). The anti-epileptic mechanism of TPM may be associated with the regulation of miRNA expression, down-regulation of Caspase-8, and reduction of neuronal apoptosis.
epilepsy; topiramate; hippocampus; miRNAs; miR-146a; apoptosis; Caspase-8
吉林省醫藥衛生科研計劃項目(C2017103)。
李香丹(1987-),女,在讀博士,主要研究方向為發作性疾病。E-mail:2015001051@ybu.edu.cn
李今子(1963-),女,博士生導師,主任醫師,主要研究方向為發作性疾病。E-mail:yjzli@ybu.edu.cn
10.3969/j.issn.1002-266X.2017.27.004
R742.1
A
1002-266X(2017)27-0014-05
2017-02-19)

