胰島素通過SCF/KIT信號通路延緩或防止糖尿病小鼠便秘
張國權,王 宇,金 迅,李 輝,江 濤*
(1武警后勤學院人體解剖與組織胚胎學教研室,天津 300309;2蘭州醫科大學第二附屬醫院血管外科;*通訊作者,E-mail:jiangtao-wjhq@sina.com)
胰島素通過SCF/KIT信號通路延緩或防止糖尿病小鼠便秘
張國權1,王 宇2,金 迅1,李 輝1,江 濤1*
(1武警后勤學院人體解剖與組織胚胎學教研室,天津 300309;2蘭州醫科大學第二附屬醫院血管外科;*通訊作者,E-mail:jiangtao-wjhq@sina.com)
目的 觀察胰島素對糖尿病便秘的作用,探討其可能機制。 方法 選用生后7-8周的雄性BALB/c小鼠,腹腔注射鏈脲佐菌素建立糖尿病模型,將小鼠分為:胰島素組、模型組以及對照組,每組15只。胰島素組小鼠在糖尿病造模成功后即每日給予胰島素進行治療,而對照組則每日給予同體積的檸檬酸緩沖液。各組小鼠均在糖尿病造模成功8周后取結腸,測量結腸內存留糞便的質量以及結腸縱行肌條收縮張力;制備全層鋪片進行Cajal間質細胞(interstitial cells of Cajal,ICC)免疫熒光染色;Western blot檢測ICC細胞KIT受體及其配體SCF的蛋白表達。 結果 糖尿病8周時,模型組小鼠結腸內存留的糞便增加,肌層收縮強度明顯減弱,ICC數量減少,細胞網絡結構破壞,肌層KIT及SCF的蛋白表達減少,各項指標與對照組相比,差異有統計學意義(P<0.01)。胰島素組小鼠結腸內存留的糞便減少,肌層收縮強度顯著增強,ICC數量和KIT及SCF的蛋白表達均顯著升高,各項指標與模型組相比,差異有統計學意義(P<0.05或P<0.01)。 結論 糖尿病早期給予胰島素治療可以阻止結腸ICC細胞和SCF蛋白表達的缺失,通過調控SCF/KIT信號,改善結腸收縮力,從而延緩或防止糖尿病便秘的發生。
胰島素; 糖尿病; 便秘; 結腸動力; SCF/KIT信號道路
糖尿病是發病率較高的一種代謝性疾病,其發病率呈逐年升高的趨勢。有調查顯示,6%-83%的糖尿病人出現胃腸動力學性狀的改變,表現為吞咽困難,進食返流,早飽,惡心,嘔吐,腹痛或者便秘等臨床癥狀[1],其中便秘是最常見的糖尿病胃腸道并發癥[2]。雖然糖尿病便秘本身并不危及患者生命,但嚴重影響患者的生活質量,影響病人的血糖控制。有關糖尿病便秘的發病原因,目前還不完全清楚。近年來越來越多的證據顯示,Cajal間質細胞(interstitial cells of Cajal,ICC)與胃腸運動功能障礙性疾病的發生發展密切相關。ICC作為胃腸自主節律性運動的起搏細胞,普遍分布于哺乳動物的消化管壁內[3]。當ICC數量減少,細胞網絡結構被破壞時,患者可出現胃腸動力學改變的各種臨床表現[4]。在ICC的細胞膜上有KIT受體,該受體的天然配體是干細胞因子(stem cell factor,SCF),任何原因導致的SCF/KIT信號通路障礙,均可影響ICC的存活和功能,進而引起胃腸運動功能障礙性疾病[5]。
目前有研究認為,對于糖尿病患者早期應用胰島素治療,可能預防或延緩各種并發癥的發生發展[6]。因此,本研究重點關注早期應用胰島素對糖尿病小鼠便秘的作用以及其可能的作用機制。
1 材料和方法
1.1 糖尿病小鼠模型的制備和分組
選用生后7-8周健康雄性BALB/c小鼠,體質量22-26 g(購于北京軍事醫學科學院實驗動物中心,SPF級),經過1周的適應以后,開始糖尿病造模。造模前15 h小鼠禁食,自由飲水。造模時一次性腹腔注射鏈脲佐菌素(購自Sigma公司,No.S0130),劑量為200 mg/kg體質量,造模后72 h用血糖儀(ACCU-CHEK?Active,Roche)測定小鼠的空腹血糖,血糖水平高于11.1 mmol/L被認為糖尿病造模成功,血糖不高者棄用。將糖尿病小鼠隨機分為模型組和胰島素組,每組15只。胰島素組小鼠,從測定血糖升高時每日腹腔注射胰島素治療(諾和靈N,精蛋白生物合成人胰島素注射液,丹麥諾和諾德公司,批號CVG0129),劑量為2.4 IU/只。選用同批次同體質量的15只小鼠,腹腔注射同體積的檸檬酸緩沖液作為對照組。對照組、模型組和胰島素組小鼠均在糖尿病造模成功8周后取結腸,測量結腸內存留糞便的質量和結腸長度,并進行后續實驗。
1.2 結腸縱行肌條收縮張力的測定
將小鼠斷頸處死,迅速取出結腸置于預冷并充氧的Kreb’s液,沿系膜側剪開,去除結腸內容物并徹底清洗內表面。取結腸中段縱行肌條(2 mm×10 mm),置于盛有8 ml Kreb’s液的器官浴槽內,水浴溫度維持在37 ℃,持續通入95%O2/5%CO2的混合氣體。將肌條固定于張力換能器,給予初始張力為1 000 mg,肌條在器官浴槽內平衡60 min,待自發節律性運動穩定后,張力反應被與計算機相連的應變儀連續記錄(Powerlab biology signal recording system;AD Instruments, Bella Vista,NSW,Australia)。以單位時間內運動張力曲線面積(運動指數)為檢測單位(mg×1 min)。
1.3 全層鋪片的制備
將小鼠處死后,快速取出完整結腸,用預冷的0.01 mol/L PBS沖洗去除腔內容物。結扎結腸的一端,用注射器將預冷的丙酮注入結腸腔內,使其維持最大充盈狀態,再結扎另一端,置入相同固定液中固定24 h。實驗前去除結扎部分,沿系膜緣剪開腸管,取0.5 cm×0.5 cm大小的樣本,置于平皿中,黏膜面向上。在解剖顯微鏡下,用眼科鑷依次將黏膜層、黏膜下層剝離,再將環行平滑肌層與縱行平滑肌撕開,并剪成適當大小的標本塊,置于預冷的0.01 mol/L PBS中4 ℃保存備用。
1.4 免疫熒光染色檢測ICC的數量及分布
將制備好的全層鋪片標本置于裝有0.01 mol/L PBS的6孔板中漂洗3次,然后用0.3% Triton-X 100漂洗10 min,再以1% BSA室溫孵育1 h以降低非特異性,棄去多余的孵育液,滴加0.1% BSA稀釋的一抗(大鼠抗小鼠ACK2,稀釋度1 ∶200,購自eBioscience公司),室溫下濕盒內孵育1 h,4 ℃過夜。漂洗3次,再滴加0.1% BSA稀釋的二抗(Cy3標記的羊抗大鼠IgG,稀釋度1 ∶200,購自Invitrogen公司),濕盒內室溫避光孵育1 h;漂洗3次,水溶性熒光封片劑封片,熒光顯微鏡觀察。
1.5 Western blot檢測結腸肌層KIT及SCF蛋白表達

1.6 ICC細胞計數
全層鋪片免疫熒光染色用熒光顯微鏡(Nikon 80i,日本)觀察并拍照。每組取5只動物,每個動物計數10個視野,用Image-Plus Pro 6.0軟件(Media Cybernetics, Silver Spring, MD, USA)計數ICC細胞。
1.7 統計學分析
2 結果
2.1 結腸長度與存留糞便的質量
糖尿病造模成功8周時,與對照組相比,模型組小鼠結腸長度(cm)顯著增長(6.2±0.8vs9.8±0.8,P<0.01),同時腸內存留的糞便質量(g)也增加(1.6±0.8vs5.4±1.0,P<0.01)。而與模型組相比,胰島素組小鼠結腸長度(7.5±0.5)顯著縮短(P<0.01),結腸內存留的糞便質量(3.3±0.6)也相應的減少(P<0.05),差異有統計學意義(見圖1)。
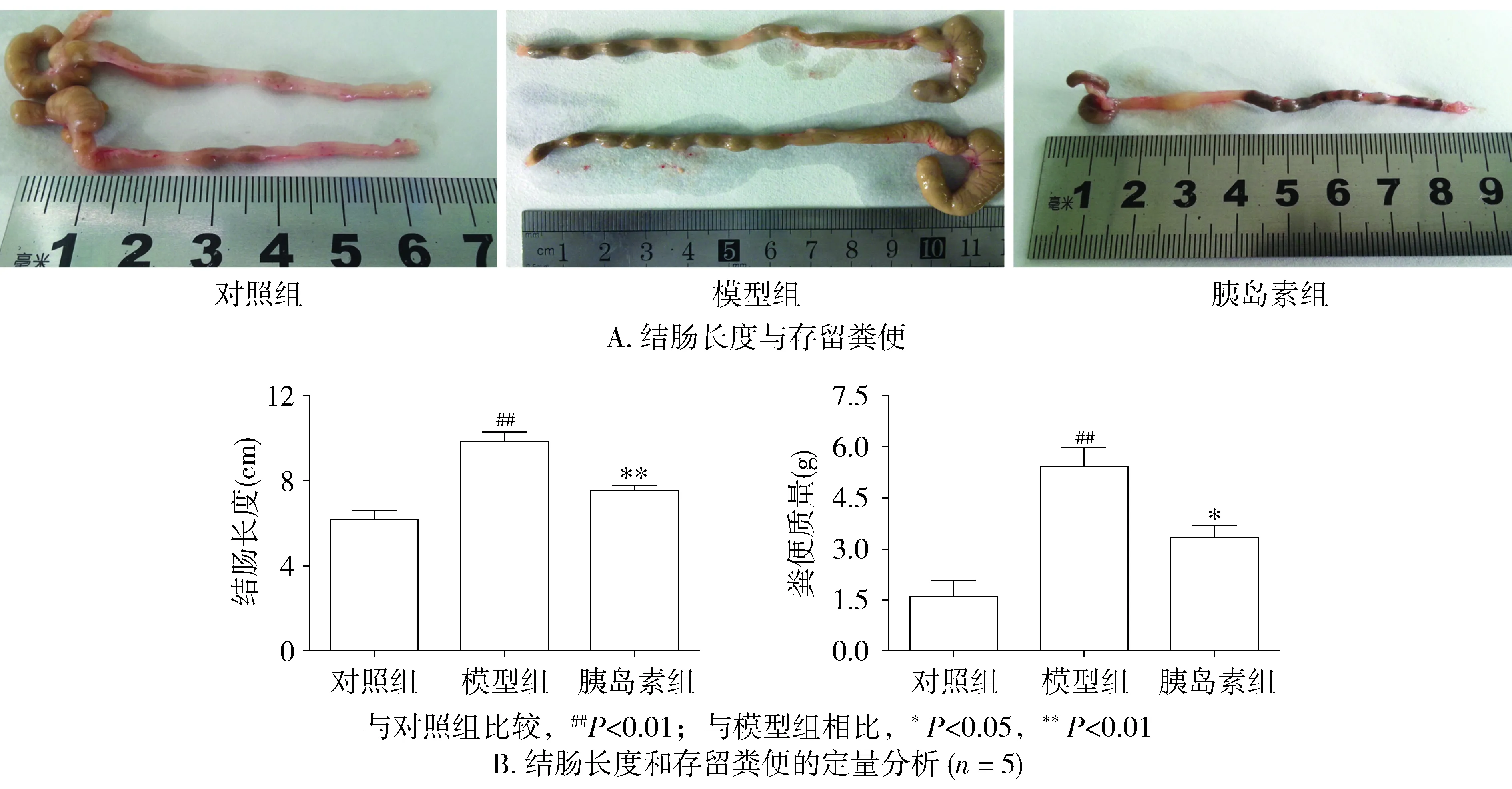
圖1 小鼠結腸長度與存留糞便的質量變化Figure 1 The alteration of colonic length and remaining faeces in the mice
2.2 離體結腸縱行肌條收縮張力的測定結果
與對照組相比,模型組小鼠在糖尿病造模成功8周時,離體結腸縱行肌條收縮強度明顯減弱(226.0±20.7vs92.0±19.2,P<0.01,n=5)。而在糖尿病早期給予胰島素治療后,小鼠結腸肌層收縮強度(216.0±20.7)顯著升高大于模型組且差異有統計學意義(P<0.01,n=5,見圖2)。
2.3 結腸ICC全層鋪片免疫熒光染色結果
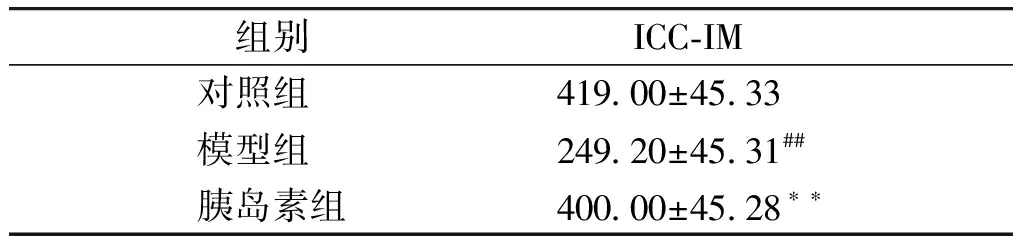
結腸ICC根據細胞所在位置可以分為以下類型:肌內ICC(intramuscular ICC,ICC-IM),位于環行肌與縱行肌之內;肌間神經叢周圍的ICC(myenteric ICC,ICC-MY),位于環行肌與縱行肌之間的肌間神經叢周圍;黏膜下ICC(submucosal ICC,ICC-SM),位于黏膜下層,緊貼環行肌的內表面。全層鋪片免疫熒光染色結果發現,對照組ICC的突起反復分支,彼此連接形成獨立的細胞網絡;而模型組ICC細胞網絡結構破壞,細胞突起間形成較為稀疏的網絡;給予胰島素治療后,ICC細胞網絡結構恢復正常(見圖3)。與對照組相比,糖尿病造模成功8周時,模型組小鼠結腸壁內ICC-IM、ICC-MY、ICC-SM的數量均明顯減少(P<0.01),細胞網絡結構破壞。而早期給予胰島素治療后,這三個部位的ICC數量均又顯著增加,與糖尿病模型組相比,差異有統計學意義(P<0.01,見表1)。
2.4 Western blot檢測結腸肌層KIT及SCF蛋白表達結果
電泳結果顯示,與對照組相比,糖尿病造模成功8周時,模型組小鼠結腸肌層KIT蛋白表達減少
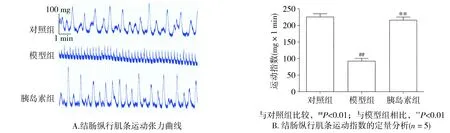
圖2 小鼠離體結腸縱行肌條收縮張力的測定Figure 2 The measurement of contractile tension of isolated colonic longitudinal muscle strips in the mice
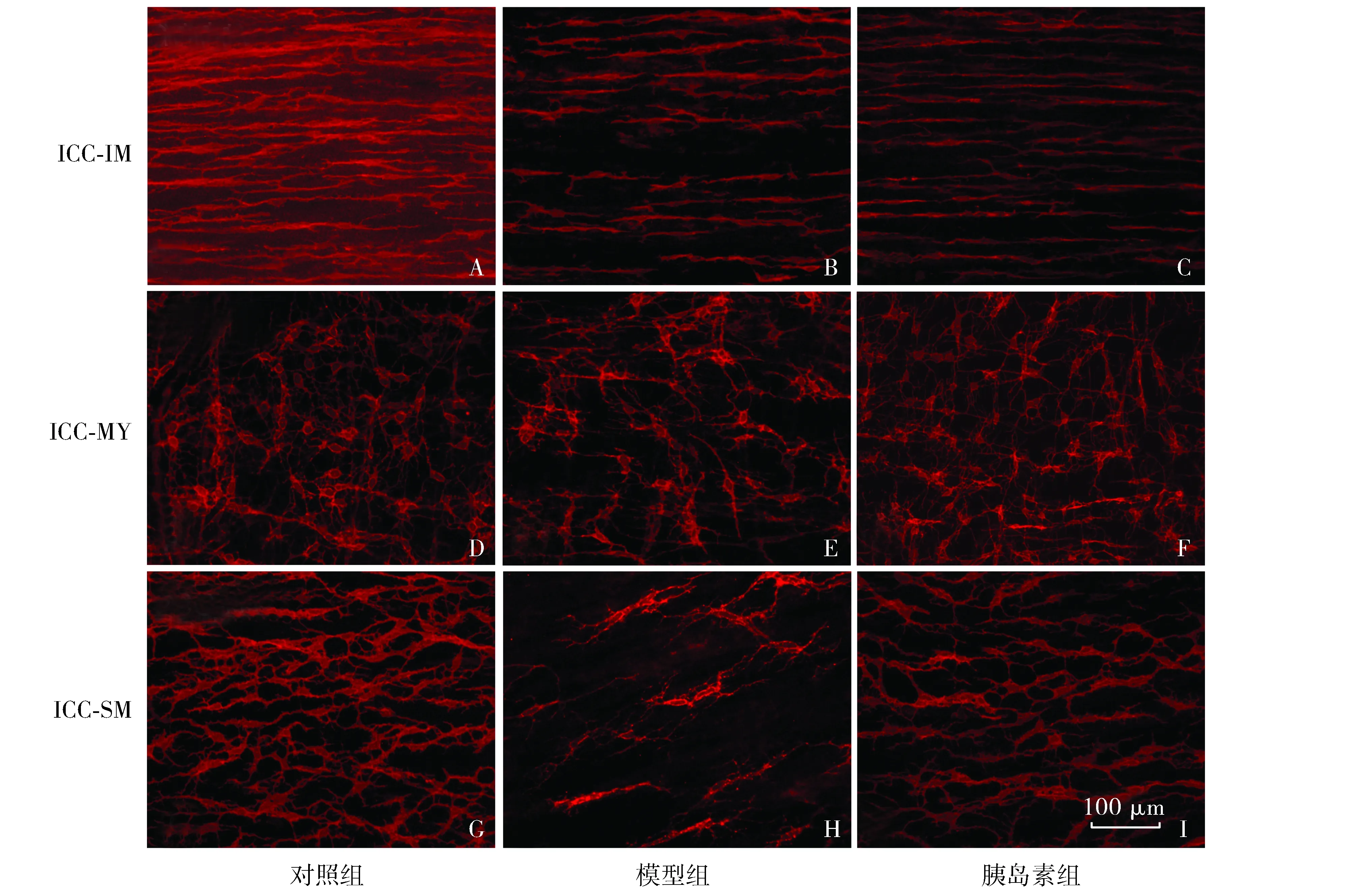
圖3 結腸ICC全層鋪片免疫熒光染色Figure 3 Immunofluorescent staining of ICC labeled with ACK2 on whole mount preparation of the mice colon
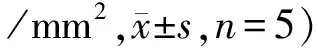

組別 ICC?IM ICC?MY ICC?SM對照組 41900±453374680±462759800±3834模型組 24920±4531##50200±6300##12860±2569##胰島素組40000±4528??73260±5054??52660±3497??
與對照組比較,##P<0.01;與模型組相比,**P<0.01
(0.91±0.09vs0.29±0.07,P<0.01),而作為KIT蛋白的天然配體,干細胞因子(SCF)的表達也相應減少(1.05±0.11vs0.43±0.08,P<0.01)。而早期給予胰島素治療后,KIT及SCF的蛋白表達水平均顯著升高(KIT蛋白0.77±0.10,SCF蛋白0.95±0.10),與糖尿病模型組相比,差異均有統計學意義(P<0.01,見圖4)。
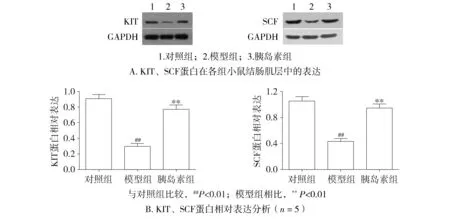
圖4 Western Blot檢測結腸KIT及SCF蛋白表達Figure 4 Western blot analysis of the expression levels of KIT and SCF proteins in the colon muscle layer
3 討論
有文獻報道,小鼠糖尿病胃輕癱等糖尿病胃腸道并發癥一般是在糖尿病發病的4-5周時出現,最晚是在第8周時出現[7]。我們的研究也發現,在糖尿病造模成功8周后,模型組小鼠結腸收縮張力減弱,結腸內存留的糞便增多,結腸長度增加,出現糖尿病便秘的癥狀。而在糖尿病早期就給予胰島素治療后,小鼠結腸未見明顯的便秘癥狀,提示胰島素可以延遲或者預防糖尿病便秘的發生。
胃腸道蠕動與Cajal間質細胞(ICC)密切相關,ICC普遍分布于哺乳動物的消化管壁內,但不同器官的ICC分布存在一定差異。在結腸壁有3種ICC,即ICC-IM,ICC-MY和ICC-SM,其中ICC-MY和ICC-SM被認為具有起搏功能[8,9],可產生電慢波并通過縫隙連接傳遞給相鄰的ICC和平滑肌,引發平滑肌機械性收縮。而ICC-IM作為一種傳遞介質,可將神經興奮從腸神經系統傳遞給平滑肌細胞[10]。
酪氨酸激酶受體KIT是由原癌基因c-kit編碼的一種跨膜蛋白,通常表達于多種細胞,如造血干細胞、肥大細胞、精原細胞、黑色素細胞及ICC等。而在哺乳動物胃腸道的肌層,KIT主要標記于ICC,胃腸道的平滑肌能夠產生KIT受體的天然配體干細胞因子(SCF),SCF與KIT受體胞外段結合后,誘導其特定部位的酪氨酸殘基自體磷酸化,并導致PI3K/Akt,Ras/MAPK和STAT等信號途徑的激活[11]。研究發現,SCF/KIT信號通路對體外培養的ICC和哺乳動物ICC的存活、分裂、增殖、分化、以及數量的維持有重要的調控作用[12,13]。任何原因導致的胃腸道ICC的數量減少、網絡結構的破壞或SCF/KIT信號通路受損,都會引起胃腸動力學異常。到糖尿病第8周時,模型組結腸壁內不僅具有起搏功能的ICC-MY和ICC-SM數量減少,同時作為傳遞介質的ICC-IM數量也相應的減少,細胞網絡結構破壞,KIT和SCF的蛋白表達降低,SCF/KIT信號通路出現異常,這與以往的文獻報道基本一致[14,15]。ICC的這些變化和信號系統的異常可能是導致糖尿病時結腸平滑肌收縮張力減弱,腸腔內糞便堆積增加以及結腸的長度增加的主要原因。
關于糖尿病時胃腸道病變的機制,有研究認為,高血糖是糖尿病胃腸道病變時ICC異常改變的重要機制之一,Lin等[16]發現糖尿病小鼠結腸ICC的異常不是由于高血糖所致,而是由于內源性SCF的缺失,給予外源性的SCF后可以部分恢復糖尿病小鼠結腸壁內ICC的病理改變。Horvth等[17]也認為在糖尿病相關的胃腸道病變中,ICC的缺失不可能是由于慢性或復發性的高血糖所致,而是由于胰島素(insulin)/胰島素樣生長因子1(insulin-like growth factor 1,IGF-1)相關信號的轉導障礙所致。在BALB/c小鼠胃肌層的體外培養中,若在培養基中加入胰島素或IGF-1,則可以完全阻止ICC的減少和維持胃ICC的電慢波[17],這些結果提示ICC數量和電活動的正常維持,需要胰島素或IGF-I。然而Horvth等[18]進一步研究發現,小鼠胃ICC不表達SCF,也不表達Insulin/IGF-1受體,而胃平滑肌不僅表達Insulin/IGF-1受體,同時也可產生SCF。小鼠胃ICC的存活依靠SCF信號,但是ICC也需要Insulin/IGF-1的維持,這就提示SCF能夠介導Insulin/IGF-1的作用。在器官培養時,給予Insulin/IGF-1不僅可以阻止ICC的缺失同時也伴有平滑肌以及SCF表達的恢復,而且IGF-1是以濃度依賴和時間依賴的方式刺激結腸平滑肌細胞內SCF的表達[19],所以我們在糖尿病早期應用胰島素治療,可能使得胰島素與結腸平滑肌細胞上的胰島素受體結合,通過一系列信號途徑(可能是ERK/MAPK信號傳導通路[20])促進平滑肌細胞對SCF的表達,后者再通過SCF/KIT信號,維持ICC的數量和網絡結構的正常,使結腸平滑肌保持正常的收縮張力,這些結果提示糖尿病時早期給予胰島素治療可能會延遲或預防便秘的發生,但胰島素對于長期信號紊亂即已經發生的糖尿病結腸并發癥的治療效果還需要進一步探討。
[1] You S, Anitha M, deSouza SM,etal. Hepatic insulin gene therapy prevents diabetic enteropathy in STZ-treated CD-1 mice[J]. Mol Ther Methods Clin Dev, 2015, 2:15028.
[2] Prasad VG, Abraham P. Management of chronic constipation in patients with diabetes mellitus[J]. Indian J Gastroenterol, 2017, 36(1): 11-22.
[3] Blair PJ, Rhee PL, Sanders KM,etal. The significance of interstitial cells in neurogastroenterology[J]. J Neurogastroenterol Motil, 2014, 20(3): 294-317.
[4] Pasternak A, Szura M, Gil K,etal. Interstitial cells of Cajal-systematic review[J]. Folia Morphol (Warsz), 2016, 75(3): 281-286.
[5] Li X, Xue H, Kang Q,etal. Alterations of the interstitial cells of Cajal and the microstructure of the gastrointestinal tract in KIT distal kinase mutant mice[J]. Cell Tissue Res, 2014, 355(1): 49-58.
[6] Watkins CC, Sawa A, Jaffrey S,etal. Insulin restores neuronal nitric oxide synthase expression and function that is lost in diabetic gastropathy[J]. J Clin Invest, 2000, 106(3): 373-384.
[7] Choi KM, Gibbons SJ, Nguyen TV,etal. Heme oxygenase-1 protects interstitial cells of Cajal from oxidative stress and reverses diabetic gastroparesis[J]. Gastroenterology, 2008, 135(6): 2055-2064.
[8] Hashitani H, Garcia-Londono AP, Hirst GD,etal. Atypical slow waves generated in gastric corpus provide dominant pacemaker activity in guinea pig stomach[J]. J Physiol, 2005, 569 (Pt 2): 459-465.
[9] Smith TK, Park KJ, Hennig GW. Colonic migrating motor complexes, high amplitude propagating contractions, neural reflexes and the importance of neuronal and mucosal serotonin[J]. J Neurogastroenterol Motil, 2014, 20 (4): 423-446.
[10] Daniel EE, Yazbi AE, Mannarino M,etal. Do gap junctions play a role in nerve transmissions as well as pacing in mouse intestine[J]? Am J Physiol Gastrointest Liver Physiol, 2007, 292 (3): G734-G745.
[11] Roskoski R Jr. Structure and regulation of Kit protein-tyrosine kinase-the stem cell factor receptor[J]. Biochem Biophys Res Commun, 2005, 338(3):1307-1315.
[12] Han J, Zhou YP, Jiang YZ,etal. Postnatal development of interstitial cells of Cajal in mouse colon in response to Kit signal blockade with Imatinib (Glivec)[J]. Acta Histochemica, 2010, 112 (3):215-221.
[13] McCann CJ, Hwang SJ, Bayguinov Y,etal. Establishment of pacemaker activity in tissues allotransplanted with interstitial cells of Cajal[J]. Neurogastroenterol Motil, 2013, 25 (6): e418-e428.
[14] Wu YS, Lu HL, Xu H,etal. Diabetes-induced loss of gastric ICC accompanied by up-regulation of natriuretic peptide signaling pathways in STZ-induced diabetic mice[J]. Peptides, 2013, 40(2):104-111.
[15] Park KS, Cho KB, Hwang IS,etal. Characterization of smooth muscle, enteric nerve, interstitial cells of Cajal, and fibroblast-like cells in the gastric musculature of patients with diabetes mellitus[J]. World J Gastroenterol, 2016, 22 (46):10131-10139.
[16] Lin L, Xu L M, Zhang W,etal. Roles of stem cell factor on the depletion of interstitial cells of Cajal in the colon of diabetic mice[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298(2): G 241-247.
[19] 寧月季,張蔚,成家飛,等.胰島素樣生長因子1對大鼠結腸平滑肌細胞中干細胞因子表達的影響[J].世界華人消化雜志,2009,17(34):3502-3506.
[20] 寧月季,張蔚,成家飛,等.胰島素樣生長因子1調節胃平滑肌細胞表達干細胞因子的ERKMAPK通路[J].中華醫學雜志,2010,90(34):2402-2406.
Insulin delays/prevents diabetic constipation by SCF/KIT signaling pathway in BALB/c mice
ZHANG Guoquan1,WANG Yu2,JIN Xun1,LI Hui1,JIANG Tao1*
(1DepartmentofHistologyandEmbryology,LogisticsUniversityofChinesePeople’sArmedPoliceForces,Tianjin300309,China;2DepartmentofVascularSurgery,SecondAffiliatedHospital,LanzhouMedicalUniversity;*Correspondingauthor,E-mail:jiangtao-wjhq@sina.com)
ObjectiveTo observe the effect of insulin on diabetic constipation in mice and investigate its possible mechanism.MethodsMale BALB/c mice(7-8 weeks old)were selected. The mice were divided into three groups(n=15 for each): insulin group, model group and control group. The mice were intraperitoneally injected with streptozotocin to induce the diabetic model. The mice were administered with insulin daily after the model was induced successfully in insulin group, whereas the mice in control group were given the same volume of citrate buffer solution. The colon was collected at 8 week after the modeling, and then the residual feces and contraction tension of longitudinal muscle strip were measured. ICC quantities were analyzed by immunofluorescent staining in whole mount preparation. KIT and SCF protein expression in colonic muscle layer was detected by Western blot.ResultsAt 8 week after modeling, the residual feces increased, the smooth muscle contractile tension decreased, the ICC decreased, the cellular network was damaged, and KIT and SCF protein expression reduced in model group, and all these indexes was significantly different between model group and control group(P<0.01). Compared with model group, the residual feces decreased in insulin group, the smooth muscle contractility increased in the colon, ICC and KIT and SCF protein expression increased(P<0.05 orP<0.01).ConclusionThe results suggest that early insulin treatment in diabetic mice could prevent depletion of ICC and reduction of SCF protein expression, and ameliorate the colon contractility by regulating SCF/KIT signaling, consequently prevent or delay the development of diabetic constipation.
insulin; diabetes; constipation; colonic motility; SCF/KIT signaling pathway
國家自然科學基金資助項目(31570985);武警后勤學院博士啟動金資助項目(WHB201304)
張國權,男,1973-01生,博士,副教授,E-mail:zhangguoquan2005@163.com
2017-03-21
R587.2
A
1007-6611(2017)07-0665-06
10.13753/j.issn.1007-6611.2017.07.006

