小電導鈣激活鉀通道SK2在容量超負荷心力衰竭大鼠竇房結表達的改變
倪雅娟,張京文,白鴻遠,楊國棟,馬愛群*
(1西安交通大學第二附屬醫院心血管內科,西安 710004;2西安交通大學第一附屬醫院心血管內科;*通訊作者,E-mail:yuxi1128-@163.com)
小電導鈣激活鉀通道SK2在容量超負荷心力衰竭大鼠竇房結表達的改變
倪雅娟1,張京文2,白鴻遠1,楊國棟2,馬愛群2*
(1西安交通大學第二附屬醫院心血管內科,西安 710004;2西安交通大學第一附屬醫院心血管內科;*通訊作者,E-mail:yuxi1128-@163.com)
目的 觀察小電導鈣激活鉀通道SK2通道在心力衰竭(HF)大鼠竇房結組織中表達的改變。 方法 以腹主動脈-下腔靜脈穿刺造瘺術建立容量超負荷心力衰竭大鼠模型(n=7),假手術對照組(SO)大鼠切開腹腔,穿刺腹主動脈,但不造成腹主動脈-下腔靜脈之間的瘺(n=7)。于術后8周通過超聲心動圖測定左心室射血分數(left ventricular ejection fraction,LVEF)、左心室短軸縮短率(left ventricular fraction shortening,LVFS)、左心室收縮末內徑(left ventricular end-systolic diameter,LVEDs)、左心室舒張末內徑(left ventrieular end-diastolic diameter,LVEDd),并于取材時測定心臟質量/體質量(heart weight/body weight),評價心臟結構與功能改變。分離大鼠竇房結細胞以免疫熒光染色法觀察SK2通道蛋白的表達,同時取材竇房結組織,提取組織蛋白,行Western blot測定比較心衰大鼠竇房結組織SK2通道表達的改變情況。 結果 超聲心動圖結果顯示,心力衰竭大鼠心臟收縮功能與舒張功能明顯減低[LVEDd(mm):SO 5.91±0.36vsHF 11.15±0.91,P<0.01;LVEDs(mm):SO 2.89±0.28vsHF 7.89±0.70,P<0.01;LVEF(%):SO 87.10±1.63vsHF 62.10±2.57,P<0.01;LVFS(%):SO 51.27±2.03vsHF 30.05±1.66,P<0.01],心臟質量/體質量明顯增大(SO 244.19±36.87vsHF 593.21±28.72,P<0.01)。單細胞免疫熒光染色結果示SK2通道表達于兩組大鼠竇房結細胞膜上,Western blot定量分析結果示心力衰竭組大鼠竇房結組織SK2通道蛋白表達水平較假手術組明顯減低(0.22±0.10vs0.31±0.16,P<0.05)。 結論 SK2通道在心力衰竭大鼠竇房結組織中表達明顯下調。
小電導鈣激活鉀通道; SK2通道; 心力衰竭; 竇房結; 大鼠
竇房結是哺乳類心臟的正常節律性沖動的發源地,竇房結細胞通過自發性舒張期除極化,引起其自主性起搏。一般認為竇房結的起搏和傳導功能是在多種離子電流的共同參與下形成,如延遲整流鉀電流、背景鈉電流、超極化激活內向電流等[1]。心力衰竭時竇房結發生重構,主要為功能重構[2],其本質為竇房結離子通道重構,致竇房結動作電位(APD)延長[3,4],研究發現,竇房結功能不全主要是因為竇房結離子通道重構致,包括鉀通道、鈣通道、鈉通道、超極化激活陽離子通道等通道重構,但具體機制仍不十分清楚。
小電導鈣激活鉀通道(small conductance calcium activated potassium channel,SK)于1986年被發現并正式命名,是一種電導較小(60 pF)的鉀通道,依賴于細胞內鈣離子激活[5]。SK通道主要有3種亞型:SK1、SK2、SK3[6],研究顯示,SK2通道介導復極化電流,在心肌細胞、房室結復極化中起重要作用[7-9]。最近的研究發現SK2通道在竇房結細胞動作電位的復極化過程中也起重要作用,若將其阻斷,竇房結細胞動作電位時程延長,起搏頻率減低[10],因此SK2通道在竇房結APD中起重要作用。然而,通道表達是其功能的基礎,心力衰竭過程中SK2通道的表達是否重構,竇房結中的表達情況仍無研究。本研究通過建立容量超負荷大鼠心衰模型,觀察心力衰竭竇房結組織的小電導鈣激活鉀通道表達的變化,以探討心力衰竭竇房結重構的分子機制。
1 材料與方法
1.1 實驗動物
SPF級雄性SD大鼠,遺傳基本組成為遠交群大鼠,系雜合的雄性大鼠和Wistar雌性大鼠雜交后育成的一個白化封閉群大鼠,5周齡,體質量140-160 g,購于西安交通大學醫學院實驗動物中心,生產許可證號:SCXK(陜)2012-003。
1.2 主要試劑與儀器
SK2兔抗大鼠多克隆抗體(以色列Alomone Labs公司),兔抗大鼠GAPDH抗體(美國Santa Cruz公司)、羊抗兔IgG-FITC(武漢博士德生物工程有限公司),蛋白Marker(加拿大Fermentas公司),Ⅱ型膠原酶(美國Worthingtong公司),蛋白酶、牛血清白蛋白(美國Sigma公司),SZ-61型解剖顯微鏡、BX51型熒光生物顯微鏡(Olympus公司),TCS-SP2激光共聚焦顯微鏡(德國Leica公司),THONOS 2500心臟彩色超聲診斷儀(美國惠普公司),激光共聚焦顯微鏡(德國Leica公司),微型凝膠電泳系統、ChemiDoc XRS化學發光熒光成像儀(美國Bio-Rad公司),ECL發光液(美國Pierce公司),BCA蛋白定量試劑盒、單去污裂解液(美國Bio tech公司),蛋白酶抑制劑混合物(cocktail,美國Roche公司)。
1.3 主要溶液配制
①臺式液:NaCl 140 mmol/L、KCl 5.4 mmol/L、MgCl2 1.0 mmol/L、CaCl21.8 mmol/L、HEPES 10.0 mmol/L、Glucose 10.0 mmol/L(NaOH調節pH值為7.35-7.45);②無鈣臺式液:NaCl 140 mmol/L、KCl 5.4 mmol/L、MgCl21.0 mmol/L、HEPES 10.0 mmol/L、Glucose 10.0 mmol/L(NaOH調節pH值為7.35-7.45);③竇房結細胞消化酶液:30 ml無鈣臺式液中加入Ⅱ型膠原酶220 IU/ml,蛋白酶0.03%,BSA 30 mg(0.1%),CaCl20.06 mmol/L(NaOH調節pH值為6.8);④心肌細胞儲存液(Kraftbrabe,KB):KCl 25 mmol/L,KH2PO410.0 mmol/L, MgCl23.0 mmol/L,牛磺酸 20.0 mmol/L,L-谷氨酸80.0 mmol/L,EGTA 0.5 mmol/L, HEPES 10.0 mmol/L, Glucose 10.0 mmol/L,KOH調節pH值為7.35-7.45。免疫熒光、Western blot所需液體配制方法同本課題組既往報道[11]。
1.4 容量超負荷心力衰竭大鼠模型的建立及評價
SD大鼠隨機分為心衰組(heart failure,HF;n=14)和假手術組(sham operation,SO;n=14),心衰組采用腹主動脈一下腔靜脈穿刺造瘺術建立容量超負荷心衰模型[12],簡而言之,大鼠麻醉后腹部正中切口4 cm,充分暴露腹主動脈和下腔靜脈,自左側腎動脈下方,鈍性分離出腹主動脈和下腔靜脈,顯微持針器持9/0帶線縫合針,在左右髂總動脈分支上方3 mm處腹主動脈前壁做U形縫合,并在左側腎動脈下方夾閉腹主動脈血流,持留置針頭(內充低分子肝素鈉抗凝)從U形縫合口進針穿入腹主動脈,針頭沿前壁向上行至腹主動脈和下腔靜脈的聯合部,向右穿破此處的相鄰動靜脈壁,行至下腔靜脈,造成動-靜脈瘺。退出針頭并迅速收緊縫合口,此時靜脈膨脹,顏色變紅并有搏動,穿刺部位可見明顯渦流。假手術組只穿刺進入腹主動脈,不進入下腔靜脈造瘺,其余手術步驟與動-靜脈瘺組相同。假手術組只切開腹腔,穿刺腹主動脈,不穿刺下腔靜脈,即不造成腹主動脈-下腔靜脈之間的瘺,余步驟同心衰組。術后8周行心臟超聲檢查,評價兩組大鼠心功能。
1.5 單個竇房結細胞的分離及鑒定
實驗大鼠取心臟,解剖顯微鏡下取竇房結組織,左右界限為界嵴和房間隔,上下邊界為上、下腔靜脈,竇房結的長軸幾乎于界溝的走向一致[13]。分離竇房結細胞的方法在小鼠竇房結細胞分離方法上有所改進[14]。將竇房結組織剪成1 mm的小條置入消化酶液中,37 ℃恒溫消化過程持續15-19 min,肉眼觀察組織條粉紅透亮、膨脹松軟、呈現云絮狀,以KB液終止消化,輕柔牽拉組織條,KB液變渾濁,竇房結細胞即釋放至KB液中。220 μm尼龍網過濾以除去組織塊,室溫靜置30 min,逐漸復鈣至1.0 mmol/L。分離細胞的鑒定:①形態學觀察:光學顯微鏡下觀察細胞形態,竇房結細胞呈不規則形態,有梭形、彎曲、弧形等;②HCN4免疫熒光染色:HCN4為特異性表達于竇房結組織的超極化陽離子通道,通常以其的陽性表達來鑒定竇房結細胞[15]。
1.6 定性觀察SK2通道在竇房結組織表達
分離兩組大鼠單個竇房結細胞,行單細胞免疫熒光染色,步驟如文獻[16]所述,以激光共聚焦顯微鏡觀察SK2通道在竇房結細胞的表達情況。
1.7 定量檢測心力衰竭竇房結組織SK2通道表達的改變
Western blot定量觀察兩組大鼠竇房結組織SK2通道蛋白的表達水平。竇房結組織取材后,提取組織蛋白的方法如文獻[17]所述,95 ℃煮沸5 min使蛋白變性,BCA法測定蛋白濃度,SDS-PAGE凝膠電泳分離蛋白,冰浴100 V恒壓轉膜90 min,將蛋白轉移至PVDF膜。PVDF膜在含5%脫脂奶粉的TBST中4 ℃過夜封閉,漂洗后予一抗室溫下孵育2 h,洗滌后予二抗(羊抗兔IgG HRP抗體)室溫下孵育1 h,ECL試劑盒使條帶顯色,ChemiDoc XRS化學發光熒光成像儀采集圖像,Quality One軟件分析結果,以目的條帶累計光密度值/內參GAPDH累計光密度值,獲得結果。
1.8 統計學分析
2 結果
2.1 心力衰竭大鼠模型的成功建立
腹主動脈-下腔靜脈造瘺術后8周,行超聲心動圖檢查,結果顯示,心衰組大鼠左心室射血分數(left ventricular ejection fraction,LVEF)與左心室短軸縮短率(left ventricular fraction shortening,LVFS)較假手術組明顯降低(均P<0.01,見表1),心衰組大鼠左心室收縮末內徑(left ventricular end-systolic diameter,LVEDs)、左心室舒張末內徑(left ventrieular edn-diastolic diameter,LVEDd)較假手術對照組大鼠明顯增加(均P<0.01,見表1)。結果證明與假手術組相比,心衰組大鼠左心室收縮與舒張功能明顯下降,左心室心腔明顯擴張,表明容量超負荷心衰模型成功建立。
表 1 HF組大鼠和SO組大鼠超聲心動學指標比較 (n=7)
Table 1 Comparison of echocardiographical results between HF and SO rats (n=7)
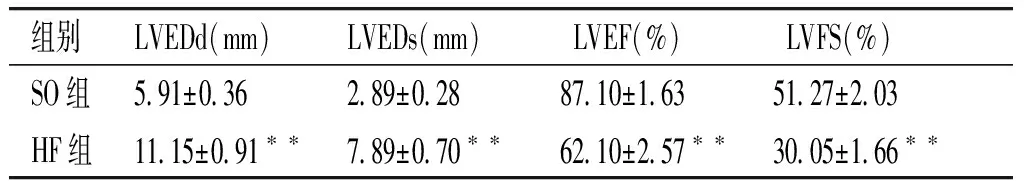
組別LVEDd(mm)LVEDs(mm)LVEF(%)LVFS(%)SO組591±036289±0288710±1635127±203HF組1115±091??789±070??6210±257??3005±166??
LVEDd:左室舒張末內徑;LVEDs:左室收縮膜內徑;LVEF:左室射血分數;LVFS:短軸縮短率;與SO組比較,**P<0.01
2.2 兩組大鼠心臟質量/體質量結果
稱量大鼠體質量、心臟重量,計算兩組大鼠心臟質量/體質量,并行統計學分析,結果顯示,心衰組大鼠心臟質量及心臟質量/體質量比均較假手術組顯著增加(P<0.01,見表2),證明在慢性心衰過程中發左心室重構,心腔擴大,心臟結構改變,心臟增大。
表 2 兩組大鼠組大鼠體質量、心臟質量、心臟質量/體質量的比較
Table 2 Comparison of BW,HW,HW/BW between HF and SO rats

組別 BW(g) HW(g)HW/BW(mg/100g)SO組(n=7)34152±3046081±01924419±3687HF組(n=7)37229±3451??219±067??59321±2872??
BW:體質量;HW:心臟重量;HW/BW:心臟質量/體質量;與SO組比較,**P<0.01
2.3 竇房結細胞的鑒定
酶解分離的單個竇房結細胞行HCN4免疫熒光染色,激光共聚焦顯微鏡觀察結果可見,竇房結細胞形態不規則,有梭形、弧形、彎曲形等,細胞橫紋清楚、細胞核可見。HCN4均勻地表達于竇房結細胞的細胞上,因HCN4在竇房結表達具有特異性,進一步證實分離所得的細胞為竇房結細胞,結果見圖1。

圖1 HCN4在SO組與HF組大鼠的分離細胞呈陽性表達Figure 1 The positive expression of HCN4 in isolated cells of SO and HF rats
2.4 SK2通道在SO組及HF組大鼠竇房結細胞表達的定性觀察
以上述方法分離的單個竇房結細胞,行SK2通道免疫熒光染色,激光共聚焦顯微鏡觀察結果可見,SK2通道表達于SO組及HF組大鼠竇房結細胞膜上,細胞核、細胞漿區表達呈陰性(見圖2);肉眼可見HF組竇房結細胞的熒光強度較假手術對照組低。
2.5 SO組及HF組大鼠SK2通道表達的定量分析
Western blot定量結果表明SK2通道在兩組大鼠竇房結均有表達,HF組大鼠竇房結SK2通道表達水平明顯低于SO組大鼠(SO 0.31±0.16,HF 0.22±0.10,P<0.05,見圖3),證明SK2通道在心力衰竭組大鼠竇房結組織發生重構,表達明顯下調。
3 討論
竇房結功能的基礎是竇房結細胞膜上離子電流的共同作用,形成動作電位。研究顯示SK2通道參與竇房結細胞復極化過程,在竇房結功能中起重要作用[10],而SK2通道在竇房結組織的表達如何尚無研究。本研究通過分離單個竇房結細胞行免疫熒光染色,結果證實SK2通道表達于大鼠的竇房結細胞膜上,在細胞核、細胞漿均無表達,提示竇房結細胞SK2的表達是SK2通道作用于竇房結復極化的分子基礎。
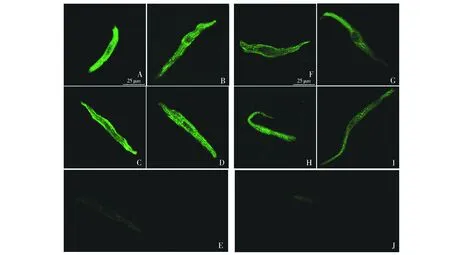
A,B,C,D.SO組大鼠竇房結細胞SK2通道的表達;E.SO組陰性對照細胞;F,G,H,I.HF組大鼠竇房結細胞SK2通道的表達;J.HF組陰性對照細胞圖2 SO組與HF組大鼠竇房結細胞SK2通道的免疫熒光染色Figure 2 The immunofluorescence staining results of SK2 in sinoatrial node cells of SO and HF rats

圖3 SO組及HF組大鼠竇房結組織SK2通道蛋白Western blot結果Figure 3 Western blot analysis of SK2 protein in the sinoatrial node tissue of HF and SO rats
心力衰竭是多種心血管疾病的最終歸宿,其患病率高,預后差。心力衰竭患者易并發竇房結功能不全,表現為固有心率顯著減慢,固有竇性周期長度、校正后竇房結恢復時間及竇房傳導時間明顯延長。研究表明,心力衰竭竇房結功能不全的本質為竇房結細胞膜上的離子通道表達和功能異常,離子電流重構,導致竇房結APD延長。大量研究顯示心力衰竭時竇房結細胞If、IKs明顯下調,鉀通道(ERG、KvLQT1、Kir2.4、TASK1、TWIK1、TWIK2)、鈣通道、鈉-氫交換體等離子通道的表達顯著上調,致竇房結固有心率下降,校正后竇房結恢復時間延長[3,4],本實驗室前期研究證實,心力衰竭時竇房結組織神經型鈉通道Nav1.1,Nav1.6表達明顯下調,可能參與心力衰竭竇房結功能不全的形成[11]。
綜上所述,SK2通道介導復極化電流,參與心房肌、房室結、竇房結等細胞復極化過程,其通道蛋白表達于竇房結細胞膜上,在竇房結細胞APD中起重要作用,藥物阻斷后竇房結細胞APD延長,竇房結組織起搏頻率明顯減慢。心力衰竭竇房結功能不全的本質為竇房結細胞膜上離子通道的重構致APD延長,而SK2通道在竇房結APD中的作用重大,為探討SK2通道在心力衰竭竇房結中的表達情況,本研究通過建立容量超負荷大鼠心力衰竭模型,采用分離竇房結細胞行免疫熒光染色及免疫印跡等方法證實,SK2通道在心力衰竭竇房結組織中發生重構,通道蛋白表達明顯下調,可能致竇房結細胞APD延長及竇房結起搏頻率減慢,進而參與心力衰竭竇房結功能不全的形成。闡明SK2通道在心力衰竭竇房結中表達的重構情況對進一步認識心力衰竭竇房結功能不全的發生機制具有重要意義,為心力衰竭竇房結功能不全的靶向治療手段的研發提供重要的理論依據。
[1] Lei M, Zhang H, Grace AA,etal. SCN5A and sinoatrial node pacemaker function[J]. Cardiovasc Res, 2007, 74(3):356-365.
[2] Sanders P, Morton JB, Davidson NC,etal. Electrical remodeling of the atria in congestive heart failure-Electrophysiological and electroanatomic mapping in humans[J].Circulation, 2003, 108(12):1461-1468.
[3] Verkerk AO, Wilders R, Coronel R,etal. Ionic remodeling of sinoatrial node cells by heart failure[J].Circulation, 2003, 108(6):760-766.
[4] Yanni J, Tellez JO, Maczewski M,etal. Changes in Ion Channel Gene Expression Underlying Heart Failure-Induced Sinoatrial Node Dysfunction[J]. Circ Heart Fail, 2011, 4(4):496.
[5] Blatz AL, Magleby KL. Single apamin-blocked Ca-activated K+channels of small conductance in cultured rat skeletal-muscle[J]. Nature, 1986, 323(6090):718-720.
[6] Weatherall KL, Goodchild SJ, Jane DE,etal. Small conductance calcium-activated potassium channels: From structure to function[J]. Prog Neurobiol, 2010, 91(3):242-255.
[7] Li N, Timofeyev V, Tuteja D,etal. Ablation of a Ca2+-activated K+channel (SK2 channel) results in action potential prolongation in atrial myocytes and atrial fibrillation[J]. J Physiol, 2009, 587(5):1087-1100.
[8] Zhang Q, Timofeyev V, Lu L,etal. Functional roles of a Ca2+-activated K+channel in atrioventricular nodes[J]. Circ Res, 2008, 102(4):465-471.
[9] Koivumaki JT, Skibsbye L, Christ T,etal. Action potential repolarisation in healthy and fibrillating human atria: contribution of small conductance calcium-activated potassium channels[J]. Acta Physiol, 2014, 211:56.
[10] Huang JH. Apamin modulates electrophysiological characteristics of the pulmonary vein and the Sinoatrial Node (vol 43, pg 957, 2013)[J]. Eur J Clin Invest, 2016, 46(7):675.
[11] Du Y, Huang X, Wang T,etal. Downregulation of neuronal sodium channel subunits Nav1.1 and Nav1.6 in the sinoatrial node from volume-overloaded heart failure rat[J]. Pflugers Arch, 2007, 454(3):451-459.
[12] Garcia R, Diebold S. Simple, rapid, and effective method of producing aortocaval shunts in the rat[J]. Cardiovasc Res, 1990, 24(5):430-432.
[13] Nygren A, Lomax AE,Giles WR. Heterogeneity of action potential durations in isolated mouse left and right atria recorded using voltage-sensitive dye mapping[J]. Am J Physiol Heart Circ Physiol, 2004, 287(6):H2634-H2643.
[14] Lei M, Jones SA, Liu J,etal. Requirement of neuronal-and cardiac-type sodium channels for murine sinoatrial node pacemaking[J]. J Physiol, 2004, 559(3):835-848.
[15] Verkerk AO,Wilders R. Pacemaker Activity of the Human Sinoatrial Node: An Update on the Effects of Mutations in HCN4 on the Hyperpolarization-Activated Current[J]. Int J Mol Sci, 2015, 16(2):3071-3094.
[16] Ni Y, Wang T, Zhuo X,etal. Bisoprolol reversed small conductance calcium-activated potassium channel (SK) remodeling in a volume-overload rat model[J]. Mol Cell Biochem, 2013, 384(1-2):95-103.
[17] Bai H, Dong X, Zhang J,etal. Apamin-sensitive small conductance calcium-activated potassium channels were negatively regulated by captopril in volume-overload heart failure rats[J]. J Membr Biol, 2016, 249(4):429-436.
Changes of small conductance calcium-activated potassium channel SK2 expression in sinoatrial node of heart failure rats induced by volume-overload
NI Yajuan1,ZHANG Jingwen2,BAI Hongyuan1,YANG Guodong2,MA Aiqun2*(1
DepartmentofCardiology,SecondAffiliatedHospital,SchoolofMedicine,Xi’anJiaotongUniversity,Xi’an710004,China;2DepartmentofCardiology,FirstAffiliatedHospital,SchoolofMedicine,Xi’anJiaotongUniversity;*Correspondingauthor,E-mail:yuxi1128-@163.com)
ObjectiveTo investigate the changes of SK2 channel expression in sinoatrial node of the heart failure(HF) rats induced by volume-overload.MethodsThe volume-overload HF rats were induced by aortocaval fistula(ACF,n=7),and the sham-operated rats were regarded as control group(SO,n=7). The abdominal cavity was opened to puncture abdominal aorta without making a fistula between abdominal aorta and inferior vena cava in SO rats. The echocardiogram indexes such as left ventricular end-systolic diameter(LVEDs),left ventricular end-diastolic diameter(LVEDd),left ventricular fraction shortening(LVFS),left ventricular end-systolic diameter(LVEDs) were measured at week 8 after operation, and the ratio of heart weight(HW) to body weight(BW) was caculated. Then the sinoatrial node cells were isolated and collected to observe the expression of the SK2 channel protein by immunofluorescent staining. Meanwhile, sinoatrial node tissues of rats were isolated to determine the change of SK2 channel protein expression by Western blot.ResultsThe data of echocardiogram showed that the systolic and diastolic function in HF rats significantly declined [LVEDd(mm):SO 5.91±0.36vsHF 11.15±0.91,P<0.01;LVEDs(mm):SO 2.89±0.28vsHF 7.89±0.70,P<0.01;LVEF(%):SO 87.10±1.63vsHF 62.10±2.57,P<0.01;LVFS(%):SO 51.27±2.03vsHF 30.05±1.66,P<0.01)], and the ratio of HW to BW significantly increased (SO 244.19±36.87vsHF 593.21±28.72,P<0.01). The results of immunofluorescent staining indicated that the SK2 channels were located on membrane of single sinoatrial node cell. The Western blot results demonstrated that the protein expression of SK2 was down-regulated significantly in sinoatrial node of HF rats compared with SO rats(0.22±0.10vs0.31±0.16,P<0.01).ConclusionThe expression of SK2 channel protein is significantly down-regulated in sinoatrial node of HF rats.
small conductance calcium-activated potassium channel; SK2 channel; heart failure; sinoatrial node; rats
中央高校基本科研業務費專項基金資助項目(0817-1191320076)
倪雅娟,女,1986-11生,博士,住院醫師,E-mail:finley007@163.com
2017-03-02
R541.6
A
1007-6611(2017)07-0641-06
10.13753/j.issn.1007-6611.2017.07.001

